Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Переваривание и всасывание белков.Содержание книги
Поиск на нашем сайте
В сутки с пищей поступает около 100 г белков. Переваривание белков осуществляют протеолитические ферменты желудочного панкреатического и кишечного соков. Расщепление пищевых белков начинается в полости желудка под действием желудочного сока. Желудочный сок содержит фермент пепсин. Вначале пепсин активируется при этом в его предшественнике – пепсиногене – открывается активный центр. Этот механизм активации называется аутокатализ. Образование активного центра в полости желудка предупреждает нежелательное воздействие этого фермента на белки клеток желудка, где происходит его образование. Муцин, покрывающий защитным слоем поверхность пищеварительного тракта, устойчив к действию пепсина. Под воздействием пепсина в пищевых белках расщепляются пептидные связи, находящиеся в глубине молекул. В результате такого действия пепсина белковые молекулы превращаются в смесь полипептидов различной длины, которую иногда называют пептон. Тепловая переработка пищи вызывает денатурацию белков, то есть изменение пространственной формы белковой молекулы. Это делает внутренние пептидные связи более доступными для пепсина и других протеолитических ферментов. В состав желудочного сока входит и соляная кислота. Она также способствует активизации пепсина. Кроме того, она создает оптимальную для действия пепсина сильнокислую среду. Соляная кислота также вызывает денатурацию пищевых белков, что способствует облегчению действия пепсина. Наконец, соляная кислота обладает бактерицидным действием, обезвреживает пищу от микроорганизмов. Дальнейшее переваривание белков протекает в тонком кишечнике. Из желудка поступает полипептидная смесь, состоящая из фрагментов разной величины и длины. В тонком кишечнике эта смесь вначале подвергается действию ферментов поджелудочной железы (трипсина, химотрипсина, эластазы). Эти ферменты расщепляют полипептиды, поступившие в кишечник до ди- и трипептидов. Причем, эластаза расщепляет прочные белки – коллаген и эластин. Таким образом, возникают олигопептиды. Завершается переваривание белков в тонком кишечнике под действием ферментов кишечного сока. Эти ферменты встроены в стенки микроворсинок и выделяются в полость кишечника. Выделяют два типа переваривания пристеночное и полостное. Аминокислоты, возникающие на поверхности микроворсинок, сразу всасываются в кровь. Незначительная часть аминокислот всасывается в лимфатическую систему. Всасывание аминокислот процесс активный, идущий с затратами АТФ,
Катаболизм белков. Внутри клеток также имеются протеолитические ферменты – внутриклеточные протеиназы или катепсины. Эти ферменты сосредоточены в специальных органоидах клетки – лизосомах. Мембраны, окружающие лизосомы непроницаемы для ферментов, но они пропускают белки внутрь, чтобы подвергнуть их протеолизу. Белки, которые необходимо подвергнуть протеолизу, расщепляются в лизосомах до отдельных аминокислот. Кроме того, в цитоплазме клеток имеются особые мультиферментные комплексы – протеосомы, предназначенные для избирательного расщепления белков, которых не должно быть в клетках. Это чужеродные и дефектные белки, а также молекулы, присутствие которых ограничено во времени. Для предотвращения нежелательного переваривания белков в цитоплазме имеются особые белки – эндогенные ингибиторы протеиназ. Ингибиторов такого рода особенно много в плазме крови. В сутки внутриклеточному протеолизу подвергается от 200 до 300 г собственных белков. Глубокий распад белков, сопровождающийся расщеплением всех пептидных связей и приводящий к образованию аминокислот, называется тотальным протеолизом. В некоторых случаях под действием протеолитических ферментов в молекуле белка избирательно расщепляется лишь одна пептидная связь между строго определенными аминокислотами и от белка отщепляется часть его молекулы – полипептид. Такой распад белков называют ограниченный протеолиз. Примером ограниченного протеолиза является превращение проферментов в действующие ферменты: переход неактивных форм факторов свертывания крови в активные.
Синтез белков. В синтезе белков из аминокислот можно выделить три этапа. Первый этап – транскрипция – был описан в предыдущей теме. Он состоит в образовании молекул РНК на матрицах ДНК. Для синтеза белка особое значение имеет синтез матричных или информационных РНК, так как здесь записана информация о будущем белке. Транскрипция протекает в ядре клеток. Затем с помощью специальных ферментов, образовавшаяся матричная РНК перемещается в цитоплазму. Второй этап называется рекогниция. Аминокислоты избирательно связываются с своими переносчиками транспортными РНК. Все т-РНК построены сходным образом. Молекула каждой т-РНК представляет собой полинуклеотидную цепь, изогнутую в виде «клеверного листа». Молекулы т-РНК устроены таким образом, что имеют разные концы, имеющие сродство и с м-РНК (антикодон) и с аминокислотами. Т-РНК имеет в клетке 60 разновидностей. Для соединения аминокислот с транспортными РНК служит особый фермент т-РНКсинтетаза или, точнее, амино-ацил – т-РНК синтетаза. Третий этап биосинтеза белка называется трансляция. Он происходит на рибосомах. Каждая рибосома состоит из двух частей – большой и малой субъединиц. Они состоят из рибосомных РНК и белков. Трансляция начинается с присоединения матричной РНК к рибосоме. Затем к образовавшемуся комплексу начинают присоединяться т-РНК с аминокислотами. Присоединение это происходит путем связывания антикодона т-РНК к кодону информационной РНК на основании принципа комплементарности. Одновременно к рибосоме могут присоединится не более двух т-РНК. Далее аминокислоты соединяются друг с другом пептидной связью, образуя постепенно полипептид. После этого рибосома передвигает информационную РНК ровно на один кодон. Дальше процесс повторяется снова до тех пор пока информационная РНК не закончится. На конце и-РНК находятся бессмысленные кодоны, которые являются точками в записи и одновременно командой для рибосомы, что она должна отделиться от и-РНК Таким образом, можно выделить несколько особенности биосинтеза белков. 1. Первичная структура белков формируется строго на основе данных записанных в молекулах ДНК и информационных РНК, 2. Высшие структуры белка (вторичная, третичная, четвертичная) возникают самопроизвольно на основе первичной структуры. 3. В некоторых случаях полипептидная цепь после завершения синтеза подвергается незначительной химической модификации, в результате чего в ней появляются некодируемые аминокислоты, не относящиеся к 20 обычным. Примером такого превращения является белок коллаген, где аминокислоты лизин и пролин превращаются в оксипролин и оксилизин. 4. Синтез белков в организме ускоряется соматотропным гормоном и гормоном тестостероном. 5. Синтез белков очень энергоемкий процесс, требующий огромного количества АТФ. 6. Многие антибиотики подавляют трансляцию.
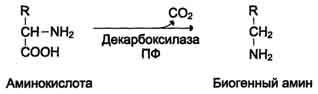
Метаболизм аминокислот. Аминокислоты могут использоваться для синтеза различных небелковых соединений. Например, из аминокислот синтезируется глюкоза, азотистые основания, небелковая часть гемоглобина – гем, гормоны – адреналин, тироксин и такие важные соединения, как креатин, карнитин, принимающие участие в энергетическом обмене. Часть аминокислот подвергается распаду до углекислого газа, воды и аммиака. Распад начинается с реакций общих для большинства аминокислот. К ним относятся. 1. Декарбоксилирование - отщепление от аминокислот карбоксильной группы в виде углекислого газа.
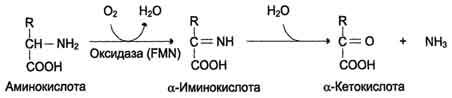
Так, например, образуется гистамин из аминокислоты гистидина. Гистамин – важное сосудорасширяющее вещество. 2. Дезаминирование - отцепление аминогруппы в виде NH3. У человека дезаминирование аминокислот идет окислительным путем.
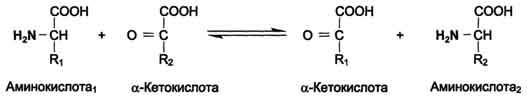
3. Трансаминирование – реакция между аминокислотами и α-кетокислотами. В ходе этой реакции её участники обмениваются функциональными группами.
Трансаминированию подвергаются все аминокислоты. Этот процесс – главное превращение аминокислот в организме, так как у него скорость значительно выше, чем у двух первых описанных реакций. Трансаминирование выполняет две основные функции. 1. За счет этих реакций одни аминокислоты превращаются в другие. При этом общее количество аминокислот не меняется но меняется общее соотношение между ними в организме. С пищей в организм поступают чужеродные белки, у которых аминокислоты находятся в иных пропорциях. Путем трансаминирования происходит корректировка аминокислотного состава организма. 2. Трансаминирование является составной частью процесса косвенного дезаминирования аминокислот – процесса, с которого начинается распад большинства аминокислот.
|
||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 119; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.42.1 (0.009 с.) |