Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Автор: Кучерявый Всеволод Владимирович.Содержание книги
Поиск на нашем сайте
Автор: Кучерявый Всеволод Владимирович. ОСНОВЫ БИОХИМИИ СПОРТА курс лекций для студентов, обучающихся по направлению подготовки 050100.62 «Педагогическое образование. Профиль: физическая культура» ЧАСТЬ 1. ОСНОВЫ ОБЩЕЙ БИОХИМИИ Раздел 1. Общая характеристика метаболизма Тема 1. Строение белков и ферментативный катализ. Тема 2. Этапы метаболизма и биологическое окисление. Тема1. СТРОЕНИЕ БЕЛКОВ И ФЕРМЕНТАТИВНЫЙ КАТАЛИЗ.
§1.Введение. §2.Биологическая роль белков. §3. Строение молекулы белка. §4. Классификация белков. §5. Физико-химические свойства белков. §6. Строение ферментов. §7. Механизм действия ферментов. Специфичность. §8. От чего зависит скорость ферментативных реакций? §9. Классификация и номенклатура ферментов.
Введение. Биохимия изучает химические процессы, происходящие в живых системах. Иначе говоря, биохимия изучает химию жизни. Наука эта относительно молодая. Она родилась в 20 веке. Условно курс биохимии можно разделить на три части. Общая биохимия занимается общими закономерностями химического состава и обмена веществ разных живых существ от мельчайших микроорганизмов и кончая человеком. Оказалось, что эти закономерности во многом повторяются. Частная биохимия занимается особенностями химических процессов, протекающих у отдельных групп живых существ. Например, биохимические процессы у растений, животных, грибов и микроорганизмов имеют свои особенности, причем, в ряде случаев очень существенные. Функциональная биохимия занимается особенностями биохимических процессов протекающих в отдельных организмах, связанных с особенностями их образа жизни. Направление функциональной биохимии, исследующее влияние физических упражнений на организм спортсмена называется биохимией спорта или спортивной биохимией. Развитие физической культуры и спорта требует от спортсменов и тренеров хороших знаний в области биохимии. Это связано с тем, что без понимания того, как работает организм на химическом, молекулярном уровне трудно надеяться на успех в современном спорте. Многие методики тренировки и восстановления базируются в наше время именно на глубоком понимании того, как работает организм на субклеточном и молекулярном уровне. Без глубокого понимания биохимических процессов невозможно бороться и допингом – злом, которое может погубить спорт. Биологическая роль белков. Роль белков в организме трудно переоценить. Именно поэтому наш курс начинается с описания роли и строения именно этого класса биоорганических соединений. Белки в организме выполняют следующие функции. 1. Структурная и ли пластическая функция. Белки являются универсальным строительным материалом, из которого состоят практически все структуры живых клеток. Например, в организме человека белки составляют около 1/6 от массы тела. Причем, у тренированных людей с хорошо развитыми мышцами эта цифра может быть и выше. 2. Каталитическая функция. Многие белки, называемые ферментами или энзимами, выполняют в живых системах функцию катализаторов, то есть изменяют скорости протекания химических реакций (о чем подробно будет сказано ниже) 3. Сократительная функция. Именно белковые молекулы лежат в основе всех форм движения живых систем. Мышечное сокращение = это, прежде всего работа белков. 4. Регуляторная функция. В основе этой функции лежит способность белковых молекул реагировать и с кислотами и основаниями, называемуют в химии амфотерностью. Белки участвуют в создании гомеостаза организма. Многие белки являются гормонами. 5. Рецепторная функция. В основе этой функции лежит способность белков реагировать на возникающие изменения условий внутренней среды организма. Различные рецепторы в организме, чувствительные к температуре, давлению, освещенности являются белками. Рецепторы гормонов – это тоже белки. 6. Транспортная функция. Белковые молекулы имеют большой размер, хорошо растворимы в воде, что позволяет им легко перемещаться по водным растворам и переносить различные вещества. Например, гемоглобин переносит газы, альбумины крови переносят жиры и жирные кислоты. 7. Защитная функция. Белки защищают организм, прежде всего, участвуя в создании иммунитета. 8. Энергетическая функция. Белки не являются главными участниками энергетического обмена, но все же до 10% суточной потребности организма в энергии обеспечивают именно они. В то же время, это слишком ценный продукт, чтобы использовать его, как источник энергии. Поэтому белки используются в качестве источника энергии только после углеводов и жиров. Строение молекулы белка. Белки – этот высокомолекулярные азотсодержащие соединения, состоящие из аминокислот. В состав белков входят сотни остатков аминокислот. Однако все белки, независимо от происхождения образуются 20 видами аминокислот. Эти 20 аминокислот называют, поэтому протеиногенными. Аминокислоты содержат карбоксильную группу COOH и аминогруппу NH 2. Правда, некоторые белки все же содержат в очень малых количествах аминокислоты, не входящие в состав протеиногенных. Такие аминокислоты называют минорными. Они образуются из протеиногенных аминокислот после завершения синтеза белковых молекул. Аминокислоты соединяются друг с другом пептидной связью, образуя длинные неразветвленные цепи – полипептиды. Пептидная связь возникает при взаимодействии карбоксильной группы одной аминокислоты и аминогруппы другой с выделением воды. Пептидные связи обладают высокой прочностью, их образуют все аминокислоты. Именно, эти связи образуют первый уровень организации белковой молекулы – первичную структуру белка. Первичная структура – это последовательность аминокислотных остатков в полипептидной цепи белка. Вторичная структура белка представляет собой спиральную структуру, образованную, главным образом, за счет водородных связей. Третичная структура белка представляет собой глобулу или клубочек, в которую сворачивается вторичная спираль в некоторых белках. В образовании глобулы участвуют различные межмолекулярные силы, прежде всего дисульфидные мостики. Поскольку дисульфидные связи образуются аминокислотами, которые содержат серу, то глобулярные белки обычно содержат много серы. Некоторые белки образуют четвертичную структуру, состоящую из нескольких глобул, называемых тогда субъединицами. Например, молекула гемоглобина состоит из четырех субъединиц, выполняющих единую функцию. Классификация белков.
Классификация белков базируется на их химическом составе. Согласно этой классификации белки бывают простые и сложные. Простые белки состоят только из аминокислот, то есть из одного или нескольких полипептидов. К простым белкам, имеющимся в организме человека, относятся альбумины, глобулины, гистоны, белки опорных тканей. В молекуле сложного белка, кроме аминокислот, ещё имеется неаминокислотная часть, называемая простетической группой. В зависимости от строения этой группы выделяют такие сложные белки, как фосфопротеиды( содержат фосфорную кислоту), нуклеопротеиды (содержат нуклеиновую кислоту), гликопротеиды (содержат углевод), липопротеиды (содержат липоид) и другие. Согласно классификации, которая базируется на пространственной форме белков, белки разделяются на фибриллярные и глобулярные. Фибриллярные белки состоят из спиралей, то есть преимущественно из вторичной структуры. Молекулы глобулярных белков имеют шаровидную и эллипсоидную форму. Примером фибриллярных белков является коллаген – самый распространенный белок в теле человека. На долю этого белка приходится 25 – 30% от общего числа белков организма. Коллаген обладает высокой прочностью и эластичностью. Он входит в состав сосудов мышц, сухожилий, хрящей, костей, стенки сосудов. Примером глобулярных белков являются альбумины и глобулины плазмы крови. Строение ферментов. Ферменты или энзимы – это белки, выполняющие в организме каталитические функции. Катализ предусматривает, как ускорение, так и замедление химических реакций. Ферменты практически всегда ускоряют химические реакции в организме, причем, ускоряют в десятки и сотни раз. У иных реакций, проходящих под контролем ферментов, скорость в их отсутствие падает практически до нуля. Участок фермента, который непосредственно участвует в катализе, называется активным центом. Он может быть по разному организован у ферментов, имеющих только третичную и четвертичную структуру. У сложных белков в образовании активного цента участвуют, как правило, все субъединицы, а также их простетические группы. В активном центре выделяют два участка – адсорбционный и каталитический. Адсорбционный участок – это центр связывания. Он по своему строению соответствует структуре реагирующих веществ, называемых в биохимии субстратами. Говорят, что субстраты и адсорбционный центр фермента совпадает как ключ и замок. У большинства ферментов один активный центр, но бывают ферменты, имеющие несколько активных центров. Надо сказать, что в ферментативной реакции принимает участи не только активный центр фермента, но и другие его части. Общая конформация фермента играет важную роль в его активности. Поэтому, изменение даже одной аминокислоты в части молекулы, которая не имеет отношения непосредственно к активному центру, может сильно повлиять на активность фермента и даже свести её к нулю.Благодаря изменению конформации фермента происходит «приспособление» его активного центра к структуре субстратов, участвующих в ускоряемой ферментом реакции.
Катаболизм – это процессы расщепления веществ, результатом которых является извлечение энергии и получение молекул меньшего размера. Конечными продуктами катаболизма являются углекислый газ, вода, аммиак. Катаболизм в организме человека и большинства живых существ характеризуется следующими особенностями. · В процессе катаболизма преобладают реакции окисления. · Катаболизм протекает с потреблением кислорода. · В процессе катаболизма выделяется энергия, примерно половина которой аккумулируется в форме молекул аденозинтрифосфата (АТФ). Значительная часть энергии выделяется виде тепла.
Анаболизм – это реакции синтеза. Для этих процессов характерны следующие особенности. · Анаболизм – это, главным образом, реакции восстановления. · В процессе анаболизма происходит потребление водорода. · Источником энергии для реакций анаболизма служит АТФ.
Тканевое дыхание. Тканевое дыхание – это основной способ получения АТФ используемый абсолютным большинством клеток организма. В процессе тканевого дыхания от окисляемого вещества отнимаются два атомов водорода и по дыхательной цепи, состоящей из ферментов и коферментов, передаются на молекулярный кислород, доставляемый кровью из воздуха во все ткани организма. В результате присоединения атомов кислорода и водорода образуется вода. За счет энергии, выделяющееся при движении электронов, по дыхательной цепи, в митохондриях осуществляется синтез АТФ из АДФ и фосфорной кислоты. Обычно синтез трех молекул АТФ сопровождается образованием одной молекулы воды. В качестве субстрата окисления в тканевом дыхании используются разнообразные промежуточные продукты распада углеводов, жиров и белков. Однако наиболее часто подвергаются окислению промежуточные продукты цикла лимонной кислоты, называемого иначе циклом трикарбоновых кислот или циклом Кребса (изолимонная, альфа-кетоглутаровая, янтарная, яблочная кислоты – это субстраты цикла трикарбоновых кислот). Цикл лимонной кислоты – это завершающий этап катаболизма, в ходе которого происходит окисление остатка уксусной кислоты, входящей а ацетилкофермент А до углекислого газа и воды. В свою очередь ацетилкофермент А – универсальное вещество организма, в которое при своем распаде превращаются главные органические вещества – белки, жиры и углеводы. Тканевое дыхание – это сложный ферментативный процесс. Ферменты тканевого дыхания делятся на три группы: никотинамидные дегидрогеназы, флавиновые дегидрогеназы и цитохромы. Эти ферменты и составляют дыхательную цепь. Никотинамидные дегидрогеназы отнимают два атома водорода у окисляемого субстрата и присоединяют его к молекуле кофермента НАД (никотинамидадениндинуклеотид) При этом НАД переходит в свою восстановленную форму НАД. Н2. Флавиновые дегидрогеназы отщепляют два атома водорода от НАД. Н2 и временно присоединяют к ФМН (флавинмононуклеотид). Это кофермент в состав которого входит витамин В2. Затем происходит передача двух атомов водорода флавину, который в свою очередь передает эти атомы на цитохромы. Цитохромы – это ферменты, содержащие в своем составе ионы трехвалентного железа, которые, присоединяя водород, переходят в двухвалентную форму. Цитохромов несколько и они обозначаются латинскими буквами a, a -3 b, c. Цитохромы передают водород на молекулярный кислород, и образуется вода. При движении по дыхательной цепи выделяется энергия, которая аккумулируется виде молекул АТФ. Этот процесс называется окислительным или дыхательным фосфорилированием. В сутки в организме образуется не менее 40 кг АТФ. Особенно интенсивно эти процессы идут в мышцах при физической работе.
Тема 6. Обмен белков.
Общая схема ГДФ-пути
Глюкозо-6- фосфат
Пировиноградная кислота
Ацетилкофермент А Лактат
Н2О CO2 (38 молекул АТФ при распаде 1 молекулы глюкозы и 39АТФ при распаде 1 молекулы гликогена)
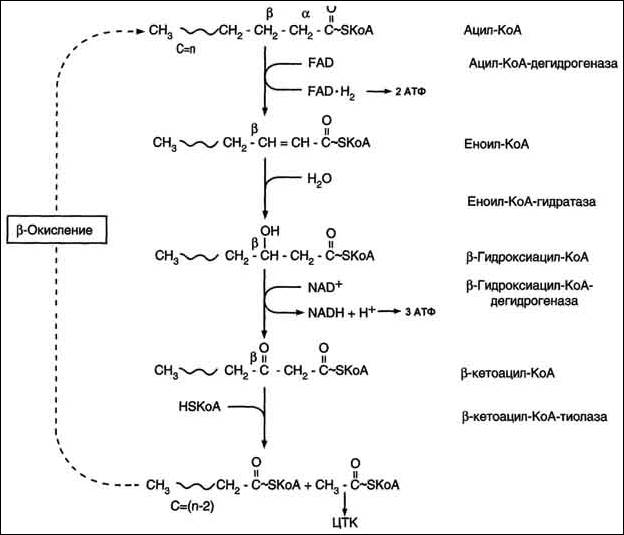
Катаболизм жиров. Использование жира в качестве источника энергии начинается с его выхода из жировых депо в кровяное русло. Этот процесс называется мобилизация жира. Мобилизация жира ускоряется под действием симпатической нервной системы и гормона адреналина. В печени происходит гидролиз жира до глицерина и жирных кислот. Глицерин легко переходит в фосфоглицериновый альдегид. Это вещество является также промежуточным продуктом углеводов в поэтому легко вовлекается в углеводный обмен. Жирные кислоты соединяются с коферментом А и образуют соединение ацилкофермент А (ацил-КоА). эти процессы происходят в цитоплазме. Далее ацил-КоА передает жирную кислоту корнетину. Корнетин переносит жирную кислоту внутрь митохондрии и вновь отдает ее кофермента А, но в этот раз митохондриальному. В митохондриях окисление жирных кислот проходит в два этапа. Первый этап – β-окисление. Окислению подвергается углеродный атом жирной кислоты, находящийся в положении «бета». От жирной кислоты, связанной с КоА, дважды отщепляется по два атома водорода, которые затем по дыхательной цепи передаются на молекулярный кислород. В итоге образуется вода и образуется пять молекул АТФ. Этот процесс повторяется многократно, пока жирная кислота полностью не превратится в ацетил-КоА.
Схема бета-окисления
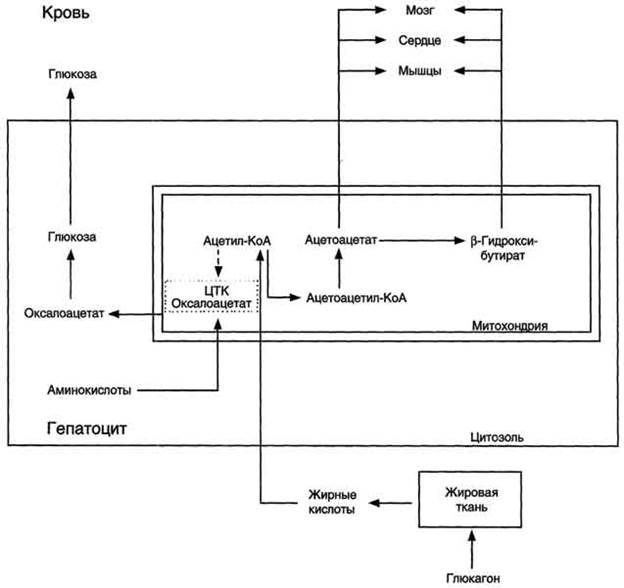
Второй этап окисления – цикл трикарбоновых кислот, в котором происходит дальнейшее окисление остатка уксусной кислоты, входящей в ацетилкофермент А, до углекислого газа и воды. При окислении одной молекулы ацетилкофермента А выделяется до 12 молекул АТФ. Таким образом, окисление жирных кислот до углекислого газа и воды дает большое количество энергии. Например, из одной молекулы пальмитиновой кислоты (С15 Н31СООН) образуется 130 молекул АТФ. Однако, в силу особенностей строения жирных кислот (слишком много атомов углерода по сравнению с кислородом) их окисление существенно затруднено по сравнению с углеводами. Поэтому жир обеспечивает организм энергией при работе средней мощности, но зато продолжительной. Отсюда вывод, чтобы сжигать жир нужно осуществлять работу средней мощности, но продолжительную. При продолжительных физических нагрузках и избыточном образовании ацетилкофермента А, происходит реакция конденсации уксусной кислоты с образованием кетоновых тел. В мышцах, почках и миокарде эти тела вновь переходят в ацетилкофермент А.Таким образом кетоновые тела играют важную роль при длительных спортивных тренировках. Однако при перетренировке они могут образовывать в крови ацетон, который выделяется с потом, мочой и выдыхаемым воздухом.
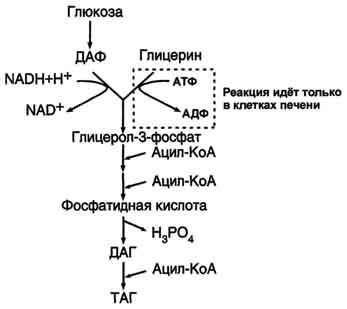
. Схема. Активация синтеза кетоновых тел при голодании. Точечные линии - скорость метаболических путей снижена; сплошные линии - скорость метаболических путей повышена. При голодании в результате действия глюкагона активируются липолиз в жировой ткани и 3-окисление в печени. Количество оксалоацетата в митохондриях уменьшается, так как он, восстановившись до малата, выходит в цитозоль, где опять превращается в оксалоацетат и используется в глюконеогенезе. В результате скорость реакций ЦТК снижается и, соответственно, замедляется окисление ацетил-КоА. Концентрация ацетил-КоА в митохондриях увеличивается, и активируется синтез кетоновых тел. Синтез кетоновых тел увеличивается также при сахарном диабете Синтез жиров Синтезируются жиры из глицерина и жирных кислот. Глицерин в организме возникает при распаде жира (пищевого и собственного), а также легко образуются из углеводов. Жирные кислоты синтезируются из ацетилкофермента А. Ацетилкофермент А – универсальный метаболит. Для его синтеза необходимы водород и энергия АТФ. Водород же получается из НАДФ.Н2. В организме синтезируются только насыщенные и мононасыщенные (имеющие одну двойную связь) жирные кислоты. Жирные кислоты, имеющие две и более двойных связей в молекуле, называемые полинасыщенные, в организме не синтезируются и должны поступать с пищей. Для синтеза жира могут быть использованы жирные кислоты – продукты гидролиза пищевого и собственного жиров. Все участники синтеза жира должны быть в активном виде: глицерин в форме глицерофосфата, а жирные кислоты в форме ацетилкофермента А. Синтез жира осуществляется в цитоплазме клеток (преимущественно жировой ткани, печени, тонкой кишки). Пути синтеза жиров представлены в схеме.
Следует отметить, что глицерин и жирные кислоты могут быть получены из углеводов. Поэтому при избыточном потреблении их на фоне малоподвижного образа жизни развивается ожирение.
Строение мононуклеотидов.
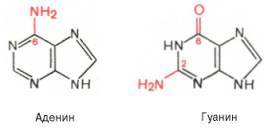
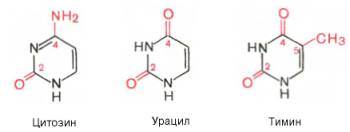
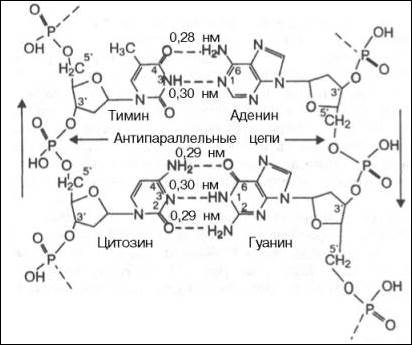
По своему строению нуклеиновые кислоты являются полинуклеотидами, состоящими из мононуклеотидов или нуклеотидов. Нуклеотид сложное органическое соединение, состоящее из трех частей: азотистого основания, углевода и остатков фосфорной кислоты. Азотистые основания - это гетероциклические органические соединения, относящиеся к двум классам – пурины и пиримидины. Из пуринов в состав нуклеиновых кислот входят аденин и гуанин,
а из пиримидинов - цитозин, тимин (ДНК) и урацил (РНК).
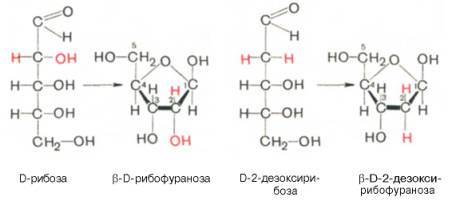
Углеводом, входящим в состав нуклеотидов может быть рибоза (РНК) и дезоксирибоза (ДНК)
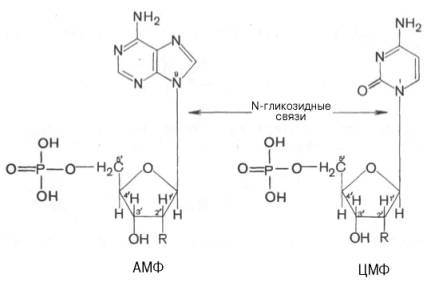
Азотистое основание, связанное с углеводом называется нуклеозидом. Фосфорная кислота присоединяется эфирной связью к пятому атому углерода рибозы или дезоксирибозы. Нуклеотиды, входящие в состав нуклеиновых кислот имеют один остаток фосфорной кислоты и называются мононуклеотидами. Однако в клетке встречаются ди- и тринуклеотиды.
Например, нуклеотид, состоящий из аденина, рибозы и одного остатка фосфорной кислоты называется аденозинмонофосфат или АМФ, а из цитозина и одного остатка фосфорной кислоты цитозинмонофосфат или ЦМФ.
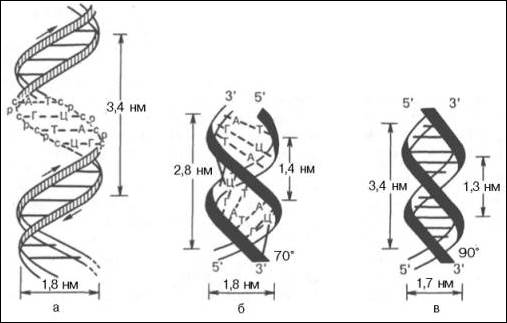
Структура ДНК
Принцип комплементарности.
Помимо ДНК в клетках встречаются три разновидности РНК: информационные (и-РНК), транспортные (т-РНК) и рибосомные (р-РНК). Все они отличаются от ДНК рядом особенностей. Во-первых, вместо азотистого основания тимина они содержат урацил. Во-вторых, вместо сахара дезоксирибозы они содержат рибозу. В-третьих, они, как правило, односпиральные. Синтез нуклеотидов.
Все клетки организма способны синтезировать необходимые нуклеиновые кислоты и не нуждаются в наличии в пище готовых нуклеиновых кислот или их составных частей. Поэтому содержание готовых нуклеиновых кислот в пище для организма принципиального значения не имеет, хотя продукты их распада могут частично использоваться организмом. Синтез пуриновых и пиримидиновых нуклеотидов происходит на основе рибозо-5-фосфата. из глюкозы при её распаде по ГМФ-пути. Свободные азотистые основания обычно для этого синтеза не используются. При синтезе пуриновых нуклеотидов к рибозо-5-фосфату присоединяются атомы углерода и азота, из которых образуется пуриновое кольцо. Источниками этих атомов являются аминокислоты глицин, глутамин, аспарагиновая кислота. Часть атомов углерода поставляется коферментами, содержащими в своём составе фолиевую кислоту и биотин. Промежуточным продуктом синтеза пуриновых нуклеотидов является инозиновая кислота. Далее из инозиновой кислоты образуются пуриновые нуклеотиды. Синтезу пиримидиновых нуклеотидов предшествует образование необычного азотистого основания оротовой кислоты, содержащей пиримидиновое кольцо. Синтезируется оротовая кислота из аммиака и аспарагиновой кислоты. Оротовая кислота присоединяется к рибозо-5-фосфату и возникает пиримидиновый нуклеотид оротидинмонофосфат. Далее оротовая кислота в составе этого нуклеотида преобразуется в обычные азотистые основания, в результате чего появляются пиримидиновые нуклеотиды. В связи с высокой важностью оротовой кислоты в спортивной практике в качестве пищевой добавки используется её соль оротат калия. Дезоксирибонуклеотиды образуются из соответствующих рибонуклеотидов путём восстановления входящей в них рибозы в дезоксирибозу.
Синтез нуклеиновых кислот.
Для синтеза нуклеиновых кислот используются мононуклеотиды обязательно в трифосфатной форме. Такие нуклеотиды содержат в своей молекуле три остатка фосфорной кислоты и обладают повышенным запасом энергии. Переход нуклеотидов в трифосфатную форму осуществляется путем взаимодействия с АТФ. Для синтеза РНК используются АТФ, ГТФ, УТФ, ЦТФ. А для синтеза ДНК, соответственно, дАТФ, дГТФ, дТТФ, дЦТФ. Процесс репликации или редупликации ДНК иначе можно назвать удвоением. Он происходит перед делением клетки. Осуществляет его специальный фермент ДНК полимераза. Этот фермент разделяет две цепи двойной спирали и достраивает к каждой из них комплементарную ей цепь. Таким образом, из одной молекулы образуется две одинаковые дочерние молекулы, причем обе цепи ДНК служат матрицами для дочерних цепей. По мере присоединения к матрице нуклеотиды связываются в полинуклеотидные нити, которые сразу же закручиваются в двойную спираль. Биологический смысл репликации состоит в том, что из одной молекулы ДНК появляются две ее полные копии. Процесс этот идет с очень высокой точностью – ошибки крайне редки. Процесс синтеза РНК называется транскрипцией. Процесс образования белков на матрицах информационной РНК называется трансляцией. Транскрипцию осуществляет фермент РНК-полимераза. Этот фермент соединяет между собой рибонуклеотиды, составляющие остов молекулы РНК. Делает это фермент на основании считывания последовательности молекулы ДНК и, достраивая комплементарные ей последовательности. Показано, что в этом процессе только одна из двух цепей ДНК играет роль матрицы. Бывают, правда, и исключения – это ДНК некоторых вирусов. В процессе транскрипции участвует только ограниченный участок ДНК. Именно этот участок ДНК и понимают в молекулярной биологии, как ген.
Тема 6. ОБМЕН БЕЛКОВ. 1. Переваривание и всасывание белков. 2. Катаболизм белков. 3. Синтез белков. 4. Метаболизм аминокислот. 5. Азотистый баланс. Обезвреживание аммиака. Катаболизм белков. Внутри клеток также имеются протеолитические ферменты – внутриклеточные протеиназы или катепсины. Эти ферменты сосредоточены в специальных органоидах клетки – лизосомах. Мембраны, окружающие лизосомы непроницаемы для ферментов, но они пропускают белки внутрь, чтобы подвергнуть их протеолизу. Белки, которые необходимо подвергнуть протеолизу, расщепляются в лизосомах до отдельных аминокислот. Кроме того, в цитоплазме клеток имеются особые мультиферментные комплексы – протеосомы, предназначенные для избирательного расщепления белков, которых не должно быть в клетках. Это чужеродные и дефектные белки, а также молекулы, присутствие которых ограничено во времени. Для предотвращения нежелательного переваривания белков в цитоплазме имеются особые белки – эндогенные ингибиторы протеиназ. Ингибиторов такого рода особенно много в плазме крови. В сутки внутриклеточному протеолизу подвергается от 200 до 300 г собственных белков. Глубокий распад белков, сопровождающийся расщеплением всех пептидных связей и приводящий к образованию аминокислот, называется тотальным протеолизом. В некоторых случаях под действием протеолитических ферментов в молекуле белка избирательно расщепляется лишь одна пептидная связь между строго определенными аминокислотами и от белка отщепляется часть его молекулы – полипептид. Такой распад белков называют ограниченный протеолиз. Примером ограниченного протеолиза является превращение проферментов в действующие ферменты: переход неактивных форм факторов свертывания крови в активные.
Синтез белков. В синтезе белков из аминокислот можно выделить три этапа. Первый этап – транскрипция – был описан в предыдущей теме. Он состоит в образовании молекул РНК на матрицах ДНК. Для синтеза белка особое значение имеет синтез матричных или информационных РНК, так как здесь записана информация о будущем белке. Транскрипция протекает в ядре клеток. Затем с помощью специальных ферментов, образовавшаяся матричная РНК перемещается в цитоплазму. Второй этап называется рекогниция. Аминокислоты избирательно связываются с своими переносчиками транспортными РНК. Все т-РНК построены сходным образом. Молекула каждой т-РНК представляет собой полинуклеотидную цепь, изогнутую в виде «клеверного листа». Молекулы т-РНК устроены таким образом, что имеют разные концы, имеющие сродство и с м-РНК (антикодон) и с аминокислотами. Т-РНК имеет в клетке 60 разновидностей. Для соединения аминокислот с транспортными РНК служит особый фермент т-РНКсинтетаза или, точнее, амино-ацил – т-РНК синтетаза. Третий этап биосинтеза белка называется трансляция. Он происходит на рибосомах. Каждая рибосома состоит из двух частей – большой и малой субъединиц. Они состоят из рибосомных РНК и белков. Трансляция начинается с присоединения матричной РНК к рибосоме. Затем к образовавшемуся комплексу начинают присоединяться т-РНК с аминокислотами. Присоединение это происходит путем связывания антикодона т-РНК к кодону информационной РНК на основании принципа комплементарности. Одновременно к рибосоме могут присоединится не более двух т-РНК. Далее аминокислоты соединяются друг с другом пептидной связью, образуя постепенно полипептид. После этого рибосома передвигает информационную РНК ровно на один кодон. Дальше процесс повторяется снова до тех пор пока информационная РНК не закончится. На конце и-РНК находятся бессмысленные кодоны, которые являются точками в записи и одновременно командой для рибосомы, что она должна отделиться от и-РНК Таким образом, можно выделить несколько особенности биосинтеза белков. 1. Первичная структура белков формируется строго на основе данных записанных в молекулах ДНК и информационных РНК, 2. Высшие структуры белка (вторичная, третичная, четвертичная) возникают самопроизвольно на основе первичной структуры. 3. В некоторых случаях полипептидная цепь после завершения синтеза подвергается незначительной химической модификации, в результате чего в ней появляются некодируемые аминокислоты, не относящиеся к 20 обычным. Примером такого превращения является белок коллаген, где аминокислоты лизин и пролин превращаются в оксипролин и оксилизин. 4. Синтез белков в организме ускоряется соматотропным гормоном и гормоном тестостероном. 5. Синтез белков очень энергоемкий процесс, требующий огромного количества АТФ. 6. Многие антибиотики подавляют трансляцию.
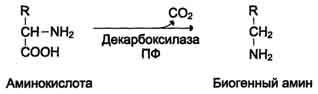
Метаболизм аминокислот. Аминокислоты могут использоваться для синтеза различных небелковых соединений. Например, из аминокислот синтезируется глюкоза, азотистые основания, небелковая часть гемоглобина – гем, гормоны – адреналин, тироксин и такие важные соединения, как креатин, карнитин, принимающие участие в энергетическом обмене. Часть аминокислот подвергается распаду до углекислого газа, воды и аммиака. Распад начинается с реакций общих для большинства аминокислот. К ним относятся. 1. Декарбоксилирование - отщепление от аминокислот карбоксильной группы в виде углекислого газа.
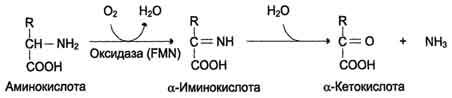
Так, например, образуется гистамин из аминокислоты гистидина. Гистамин – важное сосудорасширяющее вещество. 2. Дезаминирование - отцепление аминогруппы в виде NH3. У человека дезаминирование аминокислот идет окислительным путем.
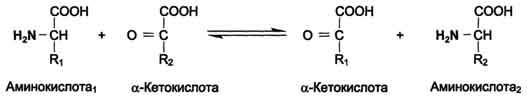
3. Трансаминирование – реакция между аминокислотами и α-кетокислотами. В ходе этой реакции её участники обмениваются функциональными группами.
Трансаминированию подвергаются все аминокислоты. Этот процесс – главное превращение аминокислот в организме, так как у него скорость значительно выше, чем у двух первых описанных реакций. Трансаминирование выполняет две основные функции. 1. За счет этих реакций одни аминокислоты превращаются в другие. При этом общее количество аминокислот не меняется но меняется общее соотношение между ними в организме. С пищей в организм поступают чужеродные белки, у которых аминокислоты находятся в иных пропорциях. Путем трансаминирования происходит корректировка аминокислотного состава организма. 2. Трансаминирование является составной частью процесса косвенного дезаминирования аминокислот – процесса, с которого начинается распад большинства аминокислот.
Таблица. Основные источники аммиака
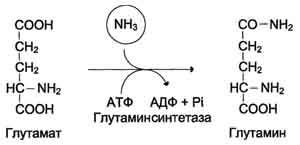
По мере образования, аммиак во всех тканях связывается с глутаминовой кислотой с образованием глутамина.
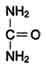
Это временное обезвреживание аммиака. С током крови глутамин поступает в печень, где распадается опять на глутаминовую кислоту и аммиак. Глутаминовая кислота с кровью снова поступает в органы для обезвреживания новых порций аммиака. Освободившийся аммиак, а также углекислый газ используются в печени для синтеза мочевины:
Синтез мочевины – это циклический многостадийный процесс, идущий с большими затратами энергии. В синтезе мочевины важнейшую роль играет аминокислота орнитин Синтез мочевины часто называют о рнитиновым циклом. В процессе синтезе к орнитину присоединяются две молекулы аммиака и молекула углекислого газа, и орнитин превращается в другую аминокислоту – аргинин. От аргинина отщепляется мочевина и вновь образуется орнитин. Синтез мочевины – это окончательное обезвреживание аммиака. Из печени с кровью мочевина поступает в почки и выделяется с мочой. В сутки её образуется 20 – 35 г. выделение мочевины с мочой характеризует интенсивность распада белков в организме. Орнитиновый цикл. Окислительное дезаминирование
|
||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 268; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.135.212.177 (0.016 с.) |


 Гликоген Глюкоза
Гликоген Глюкоза



 (2 молекулы АТФ при распаде 1молекулы глюкозы)
(2 молекулы АТФ при распаде 1молекулы глюкозы)