Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Получение и химические свойства углеводородов
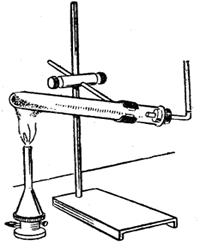
Опыт 1. Получение метана. Химические свойства метана. Реактивы и оборудование: смесь кристаллического безводного ацетата натрия и натронной извести (смесь гидроксида натрия и оксида кальция), Ход работы: в сухую пробирку насыпают (на ¼ объёма) смесь ацетата натрия и натронной извести. Пробирку закрывают пробкой с газоотводной трубкой, закрепляют в штативе, как показано на рис. 10 (а) (с небольшим наклоном отверстия пробирки вниз во избежание растрескивания пробирки при нагревании из-за выделяющейся в ходе опыта воды) и нагревают сначала осторожно всю пробирку, а затем сильно всю смесь. Уравнение реакции процесса имеет вид: СН3СООNa + NaОН — t → Через 1-2 минуты выделяющийся газообразный метан поджигают у конца газоотводной трубки, как показано на рис. 10(а). Метан сгорает _____________пламенем. Уравнение реакции горения метана имеет вид:
Не прекращая нагревания смеси, газоотводную трубку последовательно вводят (см. рис. 10(б) в пробирку с бромной водой (1-2 мл), пропуская несколько минут метан, а затем в пробирку с раствором перманганата калия, пропуская метан 1-2 минуты. Наблюдаем, что ____________________________________________________________________ Вывод:
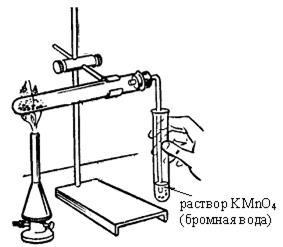
Опыт 2. Получение этена. Химические свойства этена. Реактивы и оборудование: смесь этилового спирта и концентрированной серной кислоты (в объёмном соотношении 1:2), 2 % раствор перманганата калия, бромная вода, 10 % раствор соды, кипятильники, три пробирки, газоотводная трубка с пробкой, штатив, спички, спиртовка. Ход работы: а) в сухую пробирку наливают 5 мл смеси для получения этилена. Затем в реакционную смесь помещают несколько кипятильников – для равномерного кипения реакционной смеси, закрывают пробирку пробкой с газоотводной трубкой и закрепляют пробирку в штативе как показано на рис. 11(а) (с небольшим наклоном отверстия пробирки вверх). В штатив ставят пробирки с 2 мл бромной воды и 2 мл 2 % раствора перманганата калия, в который добавлено 0,5 мл 10 % раствора соды. Пробирку со смесью для получения этилена осторожно нагревают, следя за тем, чтобы вспенивающуюся жидкость не перебросило в газоотводную трубку. Уравнение реакции получения этилена имеет вид:
__________________________________________________________________
б) выделяющийся этилен пропускают через бромную воду (рис. 11(а). В результате реакции наблюдаем ________________________________________ Это качественная реакция на кратные связи. Уравнение реакции взаимодействия этилена с бромной водой имеет вид:
в) выделяющийся этилен затем пропускаем (рис. 11(а)) во вторую пробирку с водным 2 % раствором перманганата калия (реакция Е. Е. Вагнера). Наблюдаем
Уравнение реакции окисления этилена водным 2 % раствором перманганата калия – качественная реакция на кратные связи – имеет вид:
г) прекращаем пропускание этилена через растворы и поджигаем его у конца газоотводной трубки (рис. 11 (б)), наблюдая, что этилен горит _______________ пламенем. Уравнение реакции горения этилена имеет вид:
Вывод:
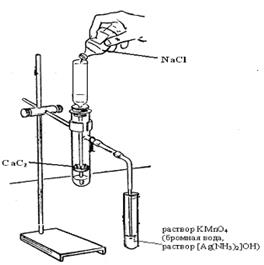
Опыт 3. Получение этина. Химические свойства этина. Реактивы и оборудование: карбид кальция, насыщенный раствор хлорида натрия, 2 % раствор КМnO4, бромная вода, 10 % раствор соды, аммиачный раствор оксида серебра (I), пробирки, прибор для получения газов, газоотводные резиновые трубки со стеклянным наконечником, воронка для фильтрования, фильтры, асбестовая сетка, электрическая плитка, штатив, спички. Ход работы: а) в штатив ставят пробирки с 2 мл бромной воды, 2 мл раствора перманганата калия, в который добавлено 0,5 мл раствора соды и 2 мл аммиачного раствора оксида серебра. В сухую колбу осторожно помещают несколько кусочков карбида кальция (размером ≈ 0,5 см3), закрепляют её в штативе (см. рис. 12(а)) и приливают из капельной воронки немного насыщенного раствора хлорида натрия. Наблюдаем _____________________________________________________ Уравнение реакции получения ацетилена имеет вид: __________________________________________________________________
б) пропускаем выделяющийся ацетилен через аммиачный раствор оксида серебра (I) ([Ag(NH3)2]OH) (рис. 12(а)). Наблюдаем _______________________ Выделяющееся вещество – это _________________________. Уравнение реакции имеет вид: HC≡CH + [Ag(NH3)2OH] →__________________________________ Осадок отфильтровывают и высушивают между листками фильтровальной бумаги. Небольшой кусочек ацетиленида серебра кладут на асбестовую сетку, покрывают другой сеткой и нагревают на плитке. Через некоторое время ацетиленид серебра взрывается. в) выделяющийся ацетилен пропускают через бромную воду (рис. 12(а)). В результате реакции наблюдаем ______________________________________ Это качественная реакция на кратные связи. Уравнение реакции взаимодействия ацетилена с бромной водой имеет вид:
г) выделяющийся ацетилен затем пропускаем (рис. 12(а)) во вторую пробирку с водным раствором перманганата калия. Наблюдаем________________________________________________________ Уравнение реакции окисления ацетилена водным раствором перманганата калия – качественная реакция на кратные связи – имеет вид:
д) прекращаем пропускание ацетилена через растворы и поджигаем его у конца газоотводной трубки (рис. 12(б)), наблюдая, что ацетилен горит _______________ пламенем, так как ____________________________________. Уравнение реакции горения ацетилена имеет вид:
Вывод: Опыт 4. Химические свойства бензола и его гомологов. А. Горение бензола Реактивы и оборудование: бензол, фарфоровая чашка, спички. Ход работы: в фарфоровую чашку вносят 1-2 капли бензола и поджигают (под тягой). Наблюдаем, что бензол горит ____________________ Уравнение реакции горения бензола имеет вид:
Вывод: Б. Нитрование бензола Реактивы и оборудование: бензол, концентрированная серная и азотная кислоты, вода, охлаждённая до 0о С, пробирка с пробкой и воздушным холодильником, водяная баня, электрическая плитка, стакан. Ход работы: в пробирку с пробкой и воздушным холодильником налить 1 мл концентрированной серной и 1 мл концентрированной азотной кислоты. Охладить эту смесь. К охлаждённой смеси прилить небольшими порциями 0,5 мл бензола, постоянно встряхивая пробирку. Закрыть пробирку пробкой с воздушным холодильником и поставить на водяную баню, нагретую до 60оС на 10 мин, периодически встряхивая. После этого реакционную смесь охладить и вылить в стакан с 20 мл ледяной воды. Кислоты растворяются в воде, а полученное вещество ___________________ в виде ___________________________________________________собирается на дне стакана. Вещество имеет запах горького миндаля. Уравнение реакции нитрования бензола имеет вид:
Вывод: В. Действие окислителей на бензол и толуол. Реактивы и оборудование: бензол, толуол, раствор перманганата калия, серная кислота, пробирки, водяная баня, электрическая плитка, воздушный холодильник. Ход работы: работа ведётся под тягой. В две пробирки налить по 1 мл в одну бензола, в другую – толуола и в обе добавить по 1 мл раствора перманганата калия, слегка подкисленного серной кислотой. Смеси взболтать, закрыть пробирки воздушным холодильником и нагреть на водяной бане. Наблюдаем, что фиолетовая окраска исчезла только в пробирке с _______________. Уравнение реакции окисления ________________ имеет вид:
Вывод:
|
||||||||||||||||||
|
Последнее изменение этой страницы: 2021-02-07; просмотров: 178; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.220.13.70 (0.016 с.) |