
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
ГЛАВА 1. Общая характеристика органических соединенийСодержание книги
Поиск на нашем сайте § 1.1. Теория химического строения органических соединений Теория химического строения А.М. Бутлерова (1861) позволила систематизировать экспериментальный материал, предсказать пути синтеза органических веществ и существование новых соединений. Основные положения теории химического строения А.М. Бутлерова: 1. Атомы в молекулах органических веществ соединены друг с другом в строго определенном порядке согласно их валентности. Порядок соединения атомов в молекуле называется химическим строением. · Валентность элементов, входящих в состав органических веществ:
· Виды формул органических веществ: молекулярные формулы, например С4Н8, С3Н6О (показывают качественный и количественный состав, но не показывают порядок соединения атомов в молекуле); структурные формулы (полные и сокращенные: показывают порядок соединения атомов в молекуле) Таблица 1. Виды формул органических веществ
2. Свойства вещества определяются качественным и количественным составом его молекул, а также химическим строением. · Качественный и количественный состав описывается общей формулой. · Представители одного гомологического ряда отвечают одной общей формуле, имеют сходное строение (виды связей, функциональные группы) и отличаются на одну и более групп ─СН2─. · Изомеры – это вещества, имеющие одинаковый качественный и количественный состав, но разное строение. Таблица 2. Виды изомерии
· Характеристики гомологических рядов некоторых органических соединений представлены в табл. 3: Таблица 3. Характеристики гомологических рядов органических веществ
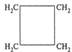
3. Атомы в молекулах оказывают взаимное влияние друг на друга, причем это влияние может осуществляться непосредственно или через другие атомы. Взаимное влияние передается, в основном, через систему ковалентных связей, с помощью электронных эффектов. Электронными эффектами называют смещение электронной плотности в молекуле под влиянием заместителей. Смещение электронной плотности может происходить, как по σ-, так и по π-связям. σ-связь – образуется при перекрывании электронных облаков по линии, соединяющей центры атомов (рис.1):
Рис. 1. Схемы образования σ-связей π-связь образуется при перекрывании электронных облаков в плоскости перпендикулярной плоскости σ-связей (рис. 2):
Рис. 2. Схема образования π-связи Смещение электронной плотности по цепи σ-связей называют индуктивным (индукционным) эффектом и обозначают буквой I. Индкутивный эффект затухает по цепи. Направление смещения электронной плотности по индуктивному эффекту обозначается прямыми стрелками, по σ-связи (→). В зависимости от направления смещения электронной плотности к заместителю (●), или от него, выделяют, соответственно, отрицательный (– I эф) или положительный (+ I эф) индуктивный эффект: Виды и степень проявления индуктивных эффектов у разных заместителей различны, и представлены на рис. 3.
Рис. 3. Индуктивные (индукционные) эффекты заместителей Смещение электронной плотности по π-связям называют мезомерным эффектом (эффектом сопряжения) и обозначают буквой М. Направление смещения электронной плотности по мезомерному эффекту обозначается изогнутыми стрелками ( Выделяют 3 варианта мезомерных эффектов: р,π-сопряжение, π,π-сопряжение и σ,π-сопряжение (гиперконьюгация). Виды и степень проявления мезомерных эффектов у разных заместителей различны, и представлены на рис. 4.
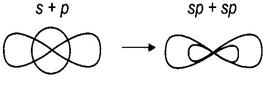
Рис. 4. Мезомерные эффекты заместителей 4. Химическое строение вещества можно установить на основании данных о его реакционной способности и, наоборот, по строению вещества можно судить о его свойствах. § 1.2. Гибридизация атомных орбиталей при образовании связей в органических веществах Гибридизация атомных орбиталей – это выравнивание электронных облаков по форме и по энергии. Для атомов углерода в органических веществах характерно проявление трех видов гибридизации: sp3- (первое валентное состояние), sp2- (второе валентное состояние) и sp-(третье валентное состояние) гибридизации. Образующиеся при этом гибридные орбитали имеют форму неправильной восьмерки Сокращенная электронная и электронно-графическая формула атома углерода органических веществ имеет вид.
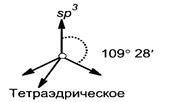
Первое валентное состояние (sp3-гибридизация, рис. 5) – характерно для всех атомов углерода в молекуле алканов, и атомов углерода, образующих только σ-связи, у других классов органических соединений. В процессе гибридизации участвуют одно 2s- и все три 2р-облака атома углерода.
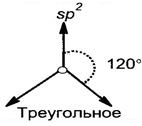
Рис. 5. Схема образования sp3-гибридных орбиталей и и их расположение в пространстве Второе валентное состояние (sp2-гибридизация, рис. 6) – характерно для атомов углерода, образующих двойные (С═С, С═О) связи. В процессе гибридизации участвуют одно 2s- и два 2р-облака атома углерода.
Рис. 6. Схема образования sp2-гибридных орбиталей и и их расположение в пространстве
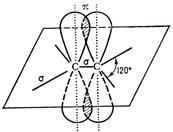
Одна негибридная 2рz-орбиталь sp2-гибридного атома углерода имеет форму правильной восьмерки и участвует в образовании одной π-связи с другим sp2-гибридным атомом углерода (рис. 7).
Рис. 6. Схема перекрывания негибридных 2р-облаков атома углерода при образовании одной π-связи
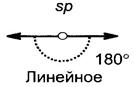
Третье валентное состояние (sp-гибридизация, рис. 8) – характерно для атомов углерода, образующих тройные (С≡С) связи. В процессе гибридизации участвуют одно 2s- и одно 2р-облако атома углерода.
Рис. 8. Схема образования sp-гибридных орбиталей и и их расположение в пространстве
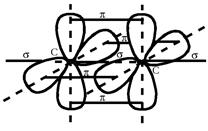
Две негибридных 2р-орбитали (2py и 2pz) sp-гибридного атома углерода имеют форму правильных восьмерок и участвует в образовании двух π-связей с другим таким же sp-гибридными атомами углерода (рис. 9).
Рис. 9. Схема перекрывания негибридных 2р-облаков атома углерода при образовании двух π-связей
§ 1.3. Основные типы реакций в органической химии
Выделяют три основных типа признаков классификации органических реакций: 1) по характеру изменения состава и структуры органических веществ – реагентов: · реакции замещения (S); · реакции присоединения (A); · реакции отщепления (элиминирования, E); · реакции перегруппировки (изомеризации). 2) по виду реагента: · реагент – радикал (реакции радикального замещения – SR; реакции радикального присоединения – А R); радикал образуется в ходе гомолитического разрыва неполярных или малополярных связей в реагенте: Х •─ │ ─• Х → 2 Х•, или Х •─ │ ─• Y → Х• + Y•. Такой разрыв инициируется светом (hυ) или температурами выше 500 оС. · реагент – нуклеофил – «любящий ядро», заряжен отрицательно – Nu – (реакции нуклеофильного замещения – SN; реакции нуклеофильного присоединения AN); нуклеофил образуется в ходе гетеролитического разрыва полярных связей в реагенте: Х │ •─• Nu → Х+ + Nu –; нуклеофильные реагенты – это анионы или другие частицы, имеющие свободную пару электронов: Cl–, H2O:,: NH3, RO– и т.п. · реагент – электрофил – «любящий электроны», заряжен положительно – Е+ (реакции электрофильного замещения – S Е; реакции электрофильного присоединения A Е); электрофил образуется в ходе гетеролитического разрыва полярных связей в реагенте: Е │ •─• Y → Е+ + Y –; электрофильные реагенты – это катионы: Н+, R+, NO2+. 3) по некоторым частным признакам: · гидрирование (гидрогенизация) – присоединение водорода; · дегидрирование (дегидрогенизация) – отщепление водорода; · галогенирование – введение галогена (реации присоединения и замещения); · дегалогенирование – отщепление галогена; · гидратация – присоединение воды; · дегидратация – отщепление воды; · гидролиз – разложение исходного вещества под действием воды (реакция обмена); · гидрогалогенирование – присоединение галогенводорода; · дегидрогалогенирование – отщепление галогенводорода; · полимеризация – синтез высокомолекулярных веществ (ВМС, полимеров), путем последовательного соединения низкомолекулярных веществ (мономеров); · поликонденсация – синтез ВМС, сопровождающийся выделение низкомолекулярного вещества (воды, спирта, галогенводорода и др.); · окисление – окислительно-восстановительная реакция – горение, медленное окисление под действием окислителей [О]: О2, KMnO4, K2Cr2O7 и др. · восстановление – окислительно-восстановительная реакция под действие восстановителей [Н]: Н2, (NH4)2S.
ГЛАВА 2. Углеводороды § 2.1. Алканы Алканы (парафины) – это предельные углеводороды, углеродная цепь которых незамкнута и не содержит кратных (двойных и тройных) связей. · Общая формула: СnН2n+2, где n≥1 (гомологический ряд см. приложение, табл. 4). · Молярная масса: М = 14n+2. · Характерное окончание в названиях по номенклатуре ИЮПАК «ан». · Особенности строения молекул алканов: * длина связи С – С равна 0,154 нм; * длина связи С – Н равна 0,109 нм; * вид гибридизации каждого из атомов углерода – sp3; * валентный угол равен 1090 28′. · Виды изомерии (табл. 2): структурная (изомерия углеродного скелета) и пространственная конформационная. · Общая формула одновалентных алифатических радикалов (алкилов, R): – СnН2n+1, где n≥1. · Характерное окончание в названиях алкилов «ил». · Формулы и названия некоторых одновалентных радикалов представлены в табл. 4: Таблица 4. Формулы и названия предельных одновалентных радикалов
· Для алканов характерны реакции замещения, окисления, расщепления, изомеризации. Задания для самостоятельной работы
1. Определите вид гибридизации углеродных атомов в молекулах этана и пентана, изобразите их пространственное строение. 2. Закончите следующие сокращённые структурные формулы веществ, дописав атомы водорода: С ― С ― С ― С; С ― С ― С ― С; С ― С; С ― С │ │ С С ― С Сколько веществ обозначено формулами? Назовите эти вещества по систематической номенклатуре. 3. Составьте структурные формулы всех изомеров н -гексана и н -пентана. Назовите их по систематической номенклатуре. Какие из них содержат третичные и четвертичные углеродные атомы? 4. Закончите формулы: а) С ― С ― С ― С; б) С ― С ― С; в) С ― С ― С ― С ― С; │ │ │ С С С С С │ │ г) С ― С ― С ― С ― С― С ― С; д) С ― С ― С; е) С ― С ― С ―С │ │ │ С С С Укажите изомеры среди веществ, формулы которых приведены выше, и назовите все вещества по систематической номенклатуре. 5. Составьте сокращённые структурные формулы следующих соединений: 2-метил-4-этилгептан, 3,3-диметил-5-пропилнонан, 3,3,6-триметил-5-этилоктан, 2,4-диметилгексан. 6. Какие галогеналканы должны быть использованы для получения бутана и гексана (по методу Вюрца)? Назовите их и напишите уравнения реакций. 7. Рассмотрите механизм реакции хлорирования этана. Назовите все вещества по систематической номенклатуре. 8. Напишите структурные формулы монохлорпроизводных, которые могут образоваться при хлорировании пропана, бутана и изобутана. Составьте соответствующие уравнения реакций. 9. Напишите уравнения реакций нитрования пропана и 3-метилпентана по Коновалову. Назовите полученные вещества. 10. Проведите реакции по схеме, назовите вещество Б:
Пропан ── Br 2 ─→ А ── 2 Na ─→ Б 11. Получите реакцией Вюрца следующие углеводороды: 12. В каких валентных состояниях находятся атомы углерода в
§ 2.2. Непредельные углеводороды Непредельными (олефинами) называются углеводороды, содержащие одну или несколько кратных (двойных или тройных) углерод-углеродных связей. Алкены Алкены – это непредельные углеводороды с одной двойной связью в молекулах. · Общая формула: СnН2n, где n≥2. · Молярная масса: М = 14n. · Характерное окончание в названиях по номенклатуре ИЮПАК «ен». · Особенности строения молекул алкенов: * содержат одну двойную связь, состоящую из одной σ- и одной π-связи; * длина связи С = С равна 0,134 нм; * вид гибридизации атомов углерода, соединённых двойной кратной связью – sp2, все остальные атомы углерода находятся в состоянии sp3-гибридизации; * валентный угол для атомов углерода в sp2-гибридизации равен 1200. · Виды изомерии (табл. 2): структурная (изомерия углеродного скелета, изомерия положения кратной связи, межклассовая с циклоалканами) и пространственная (конфигурационная, геометрическая: цис-, транс-). · Общая формула одновалентных радикалов: – СnН2n-1, где n≥2. · Характерное окончание в названиях одновалентных радикалов «ил» или «енил». · Формулы и названия некоторых непредельных одновалентных радикалов представлены в табл. 5: Таблица 5. Формулы и названия непредельных одновалентных радикалов
· Характерны реакции присоединения, окисления, полимеризации, замещения водорода при sp3-гибридном атоме при температуре выше 5000 С. · Качественная реакция – реакция с раствором перманганата калия и бромной водой (обесцвечивание растворов). Алкины Алкины – это непредельные углеводороды с одной тройной связью в молекулах. · Общая формула: СnН2n-2, где n≥2. · Молярная масса: М = 14n – 2. · Характерное окончание в названиях по номенклатуре ИЮПАК «ин». · Особенности строения молекул алкинов: * содержат одну тройную связь, состоящую из одной σ- и двух π-связей; * длина связи С ≡ С равна 0,120 нм; * вид гибридизации атомов углерода, соединённых тройной кратной связью – sp, все остальные атомы углерода находятся в состоянии sp3-гибридизации; * валентный угол для атомов углерода в sp-гибридизации равен 1800. · Виды изомерии (приложение, таблица 10): структурная (изомерия углеродного скелета, изомерия положения кратной связи, межклассовая с диеновыми углеводородами). · Общая формула одновалентных радикалов: – СnН2n-3, где n≥2. · Характерное окончание в названиях одновалентных радикалов «инил», например, ─ С ≡ СН – этинил. · Характерны реакции присоединения, окисления, замещения водорода у алкинов-1, ди-, три- и полимеризации. · Качественная реакция – реакция с раствором перманганата калия и бромной водой (обесцвечивание растворов), образование ацетиленидов серебра и меди.
Задания для самостоятельной работы 13. Напишите структурную формулу алкена состава С6Н12, имеющего один четвертичный атом углерода и назовите его по систематической номенклатуре. Определите вид гибридизации всех углеродных атомов, изобразите молекулу одного из изомеров с использованием знания о гибридизации электронных облаков и определите, какие типы ковалентной химической связи в нём присутствуют. 14. Закончите формулы, назовите следующие углеводороды по систематической номенклатуре и составьте для каждого структурную формулу одного гомолога и по одному изомеру на каждый из видов изомерии алкенов: С ═С ―С ―С С ―С―С―С ═ С―С │ │ │ С ―С С С―С │ С 15. Какой простейший непредельный углеводород имеет цис- и транс-изомеры? Приведите примеры этих изомеров и назовите их по систематической номенклатуре. 16. Назовите вещество, углеродный скелет которого приведен ниже, по систематической номенклатуре. Составьте для него формулы изомеров, назовите их, определите вид гибридизации всех углеродных атомов. Каким углеродным атомом (первичным, вторичным, третичным, четвертичным) является углеродный атом, обозначенный звездочкой (*). С*– С – С ║ С – С – С 17. Для каких из приведенных ниже веществ возможна цис-, транс-изомерия: а) СН3 – С = СН – СН3; б) СН3 – СН = СН – СНО; в) СН2 = СН – СН2ОН │ С2Н5
18. Возможна ли геометрическая изомерия: а) пентена-2; 19. Составьте структурные формулы 3-этилпентена-1, октена-2, гексадиена-1,4, метилциклогексана, 3,3,4-триметилпентена-1 и выберите среди этих веществ пары изомеров. 20. Среди перечисленных ниже веществ выберите а) изомеры, 21. Рассмотрите механизм реакции гидрогалогенирования пентена-1. 22. Рассмотрите механизм реакции гидратации 3-хлорбутена-1. 23. Рассмотрите механизм реакции гидрогалогенирования бутена-1 в присутствии пероксида водорода. 24. Определите массу вещества, полученного в результате реакции окисления (по Вагнеру) этилена, объёмом 100 мл. 25. При помощи каких реакций можно из пентена-1 получить 26. Назовите вещества, являющиеся продуктами реакций, поясните выбранный Вами ход реакций:
27. Составьте структурные формулы всех изомеров вещества состава С5Н8 и назовите их по систематической номенклатуре. Определите вид гибридизации всех углеродных атомов, изобразите молекулу одного из изомеров с использованием знания о гибридизации электронных облаков и определите, какие типы ковалентной химической связи в нём присутствуют. 28. Осуществите цепочки превращений (формулы веществ записывайте в структурном виде): а) бутан → 2-хлорбутан → бутен-2 → бутанол-2 → бутен-2; ↓ ↓ ↓ изобутан 2-хлорбутан 2,3-дихлорбутан б) бутин-2 → 2-хлорбутен-2 29. В каких валентных состояниях находятся атомы углерода в пропине. Приведите графическую схему гибридных орбиталей атома углерода в этом соединении с учетом их пространственного строения. Обозначьте вид каждой связи (σ, π). 30. Назовите вещество, углеродный скелет которого приведен ниже, по систематической номенклатуре. Составьте для него формулы изомеров, назовите их, определите вид гибридизации всех углеродных атомов. Каким углеродным атомом (первичным, вторичным, третичным, четвертичным) является углеродный атом, обозначенный звездочкой (*). С– С* – С ≡ С – С │ С 31. Осуществите предложенную схему превращений, назовите полученные углеводороды: С – С – С ─+Вr2(1 моль), hν→ А ─+2Na, t→ В ─+Вr2(2 моль), hν→ С ─+2КОН (спирт.)→ D 32. Определите массу вещества, полученного в результате реакции гидратации пропина массой 33 г. 33. Осуществите предложенную схему превращений, назовите полученные углеводороды, рассмотрите подробно механизм 1-ой реакции: С – С – С ═ С ─+НВr→А ─+КОН (сп.)→В ─+Вr2→ С ─+КОН (сп.)→D ─+Н2О (Нg2+, Н+)→ Е 34. Определите массу вещества, полученного при взаимодействии ацетилена с аммиачным раствором хлорида меди (I) ([Cu(NH3)2]Cl) массой 20 г. 35. Осуществите предложенную схему превращений, назовите полученные углеводороды, рассмотрите подробно механизм 3-ей реакции: С – С – С─+Вr2,hν→ А ─+ КОН (сп.), t→ В ─+ Вr2→ С ─+2КОН(сп.),t→ D ─[Ag(NH3)2]OH → Е
§ 2.3. Ароматические углеводороды (арены) Ароматические углеводороды – это углеводороды, в молекулах которых имеется одно или несколько бензольных колец с насыщенными или ненасыщенными радикалами в боковой цепи. · Общая формула аренов, содержащих одно бензольное кольцо и алифатические радикалы в боковой цепи: СnН2n-6, где n≥6. · Молярная масса: М = 14n – 6. · Особенности строения молекул аренов: * атомы углерода в бензольном ядре находятся в состоянии sp2-гибридизации; * негибридизованные р-орбитали атомов углерода располагаются перпендикулярно плоскости кольца и перекрываются, образуя единое кольцевое шестиэлектронное облако, называемое ароматической электронной системой; * длина связи между атомами углерода, образующими бензольное кольцо, равна 0,139 нм; * валентный угол между связями атомов углерода, образующих кольцо, равен 1200. · Общая формула одновалентных ароматических радикалов (арилов, Ar): – СnН2n-7, где n≥6. · Характерное окончание в названиях одновалентных радикалов «ил». · Формулы и названия некоторых ароматических одновалентных радикалов приведены в табл. 6: Таблица 6. Формулы ароматических одновалентных радикалов
· Характерны реакции замещения атомов водорода в бензольном кольце (S Е -механизм) и боковой цепи (SR -механизм), присоединения (в жёстких условиях), окисления (для гомологов бензола).
Задания для самостоятельной работы 36. Определите массовую долю углерода в гексане, гексене-1, 37. Напишите структурные формулы гомологов бензола состава С8Н10. Назовите их. 38. Как получить бензол, исходя из метана? Составьте уравнения реакций и укажите условия их осуществления. 39. Как распознать на основе химических свойств три жидкости: бензол, гексан и гексен? 40. Какое вещество образуется в результате следующих превращений: Бензол ─+ CH3Br (AlBr3)→ А ─+ HNO3, H2SO4→ В ─+Fe (HCl)→ С 41. Как применяется вещество, образующееся в результате следующих превращений: Бензол ─ этилен (Н+)→ А ─Br2 (hυ)→ Б ─ КOH(спирт. р-р)→ В 42. Как применяется вещество, образующееся в результате следующих превращений: Бензол ─Пропилен (Н+)→ А ─О2→ Б ─H2SO4, t→ В ─р-р NaOH→ Г 43. В соответствии с предложенной схемой осуществите превращения и напишите уравнения реакций:
Лабораторная работа № 1
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-02-07; просмотров: 310; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.009 с.) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||




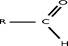
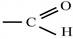
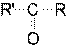

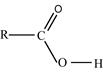
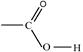
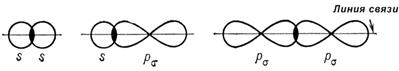
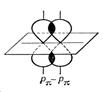
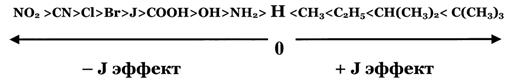
 ). В зависимости от направления смещения электронной плотности к заместителю, или от него, выделяют, соответственно, отрицательный (– Мэф) или положительный (+ Мэф) мезомерный эффект.
). В зависимости от направления смещения электронной плотности к заместителю, или от него, выделяют, соответственно, отрицательный (– Мэф) или положительный (+ Мэф) мезомерный эффект.
 и могут образовывать только σ-связи.
и могут образовывать только σ-связи.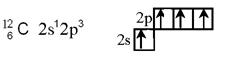
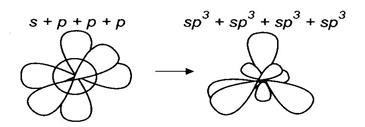



 Непредельные углеводороды <=> предельные углеводороды → арены
Непредельные углеводороды <=> предельные углеводороды → арены



