
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Углерод - керамические композиционные материалы.
Современные углерод-керамические композиционные материалы имеют в своей основе углерод-углеродный композиционный материал, насыщенный тем или иным способом карбидом кремния или карбидами тугоплавких металлов, либо имеющий покрытие из карбида кремния, карбидов и силицидов металлов. Рассмотрим механизмы разрушения материалов, содержащих карбид кремния как один из перспективных материалов, позволяющих повысить окислительную стойкость углеродных материалов. Карбид кремния, содержащийся в материале, при взаимодействии с продуктами сгорания окислитcя компонентами типа Н2О, СО2, О2, О с образованием на поверхности пленки из SiO2. Наиболее термодинамически вероятными являются реакции [5.19, 5.20]: SiC+2O2 ® SiO2 + CO2; SiC+3CO2 ® SiO2 +4CO; SiC+3H2O ® SiO2 + CO+3H2. Как только образуется пленка SiO2, она становится диффузионным барьером для окисляющих компонентов газового потока и оттока продуктов реакций. Процесс окисления замедляется. Образовавшаяся пленка двуокиси кремния при нагревание до температуры плавления может плавиться и испаряется. Толщина расплава в этом случае определяется не только скоростью его образования, но и течением вдоль поверхности материала из-за сноса потоком продуктов сгорания и испарением. При наличии в поверхностных слоях материала частиц углерода пленка SiO2 также будет содержать углерод, который влияет на ее вязкость и способен взаимодействовать по реакции: C+SiO2 ® CO+SiO, что приведет к уменьшению толщины пленки. Режим взаимодействия с образованием на поверхности карбида кремния пленки SiO2 в литературе часто называется пассивным, в отличие от активного, когда взаимодействие идет с образованием газообразного SiO и защитная пленка отсутствует. Границей между этими режимами в работе [5.21] названа температура 1967 К, в работе [5.22] даны линии перехода в зависимости от температуры и давления для атомарного и молекулярного кислорода (рис.5.13). рис.5.13.
Процесс удаления пленки после достижения температуры перехода в рассматриваемых условиях является быстротечным, и, по-видимому, определяется взаимодействием двуокиси кремния и карбида кремния между собой с образованием газообразного SiO (монооксид кремния) и СО по реакции SiC+2SiO2 ® 3SiO + COи, вероятно, механическим разрушением при фильтрации газообразных продуктов реакции с поверхности раздела SiC – SiO2.
Рис. 5.14. В результате защитная пленка исчезает, а приведенные выше реакции окисления SiС компонентами продуктов сгорания идут с образованием газообразного SiO. В этом случае диффузионный слой отсутствует, и скорость окисления материала существенно возрастает (см. данные работы [5.21] на рис 5.14 при T >1967 К). При наличии частиц углерода эти частицы будут также взаимодействовать с окислительными компонентами потока продуктов сгорания по известным закономерностям [5.23]. Общая скорость разрушения материала будет зависеть от количества каждого из компонентов и скорости их разрушения. Для построения математической модели разрушения осесимметричных стенок сопла из КМ типа С/SiC при взаимодействии с продуктами сгорания рассмотрим следующую схему материала и протекающих в нем процессов (рис. 5.15). Наиболее эффективным с точки зрения эрозионной стойкости будет случай, когда на поверхности материал имеется слой чистого SiC. В идеальном случае в процессе взаимодействия слой SiC толщиной d1 переходит в слой SiO2 толщиной d2, радиус внутренней поверхности материала изменяется от r 0 до r. Исходя из стехиометрических соотношений в реакциях из одного моля SiC образуется один моль SiO2. Следовательно, масса образовавшегося материала изменяется пропорционально соотношению молекулярных весов этих веществ, то есть
Рис. 5.15.
Изменение толщины материала r–r0 =d1 – d2 в наших обозначениях будет иметь отрицательное значение при увеличении и положительное при уменьшении толщины материала в процессе взаимодействия. Поверхность реагирования перемешается со временем и определяется соотношением r p= r +d2= r 0+d1. К этой поверхности через слой пленки SiO2 толщиной d2 из потока продуктов сгорания происходит диффузия окисляющих компонентов, в обратном направлении – диффузия газообразных продуктов реакции. Толщина образующегося слоя SiO2 описывается параболическим законом, дополненным учетом испарения и течения пленки SiO2:
В работе [5.23] показано, что скорости окисления SiC парами воды и кислородом одинаковы. На основании данных работ [5.24, 5.25] можно определить константы окисления как:
Температура плавления и плотность различных модификаций SiO2 по данным [5.19] приведены в табл. 5.1.
Таблица 5.1
Унос материала за счет течение тонкой несжимаемой пленки расплава и ее испарение рассмотрен в работе [5.16]. В качестве примера сделаем оценки процесса нарастания пленки SiO2 (без учета течения и испарения) для сверхзвуковой части сопла при давлении порядка p = 0,15 МПа и объемных долях окислительных компонентов r H2O=0,133, r CO2=0,084, проварьировав температуру от 1600 до 2100 К. Предполагается, что поверхностный слой композиционного материала состоит полностью из SiC с плотностью 1900 кг/м3; плотность SiO2 принята равной 2200 кг/м3. Результаты расчетов толщины образующейся пленки SiO2 и израсходованного при этом слоя SiC представлены на рис. 5.16 и рис. 5.17.
Рис. 5.16. Рис 5.17. Расчеты показывают, что если материал будет прогрет до 1800 К, то за 430 с работы израсходуется 40 мкм слой покрытия из SiC, при этом на материале образуется 52 мкм слой защитной пленки из SiO2. В результате, толщина и вес образца увеличатся. Таким образом, наличие слоя SiC может значительно повысить окислительную стойкость углеродных материалов при температурах, ниже 1900 К при пассивном режиме окисления [5.26].
|
|||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-01-08; просмотров: 507; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.219.189.247 (0.008 с.) |
 , откуда, рассматривая толщины слоев материалов, получим
, откуда, рассматривая толщины слоев материалов, получим 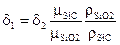 . Если принять плотности материалов равными
. Если принять плотности материалов равными 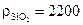 кг/м3 и
кг/м3 и  кг/м3, то получим следующее соотношение толщин:
кг/м3, то получим следующее соотношение толщин: 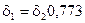 .
.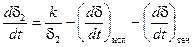 . (5.32)
. (5.32)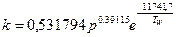 , см2/час – для аморфной модификации SiO2; (5.33)
, см2/час – для аморфной модификации SiO2; (5.33)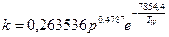 , см2/час – для кристобалита.
, см2/час – для кристобалита.


