Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
IV. Правило алфавитного порядка.Содержание книги
Поиск на нашем сайте
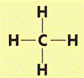
Название соединения начинают с перечисления заместителей, указывая их названия в алфавитном порядке. Названию каждого заместителя предшествует его номер в главной цепи. Наличие нескольких заместителей обозначают префиксами-числителями: ди-, три-, тетра- и т. д. После этого называют углеводород, соответствующий главной цепи. Строение молекулы метана. Простейший представитель алканов – метан Его структурная и электронная формулы:
Однако эти формулы не отражают пространственного строения молекулы.
Изомерия алканов. Изомерия алканов. Изомерия – явление существования соединений, которые имеют одинаковый состав (одинаковую молекулярную формулу), но разное строение. Такие соединения называются изомерами. Характерна структурная изомерия. 1) В формуле молекулы алкана выбирают главную цепь — самую длинную. H3C—CH—CH2—CH—CH2—CH3 -------- | ----------- | CH3 ¦ CH2—CH2—CH3 --------------------- 2) Затем эту цепь нумеруют с того конца, к которому ближе расположен заместитель (радикал). Если заместителей несколько, то поступают так, чтобы цифры, указывающие их положение, были наименьшими. Заместители перечисляют по алфавиту. 1 2 3 4 H3C—CH—CH2—CH—CH2—CH3 | 5 | 6 7 CH3 CH2—CH2—CH3 3) Углеводород называют в таком порядке: вначале указывают (цифрой) место расположения заместителя, затем называют этот заместитель (радикал), а в конце добавляют название главной (самой длинной) цепи. Таким образом, углеводород может быть назван: 2-метил-4-этилгептан (но не 6-метил-4-этилгептан).
Вопос 2.Физические и химические свойства
Температура кипения и плавления постепенно увеличивается с возрастанием длины углеродной цепи.
Химические свойства Углеводороды ряда метана (алканы) при обычных условиях не взаимодействуют ни с кислотами, в том числе с концентрированной серной и азотной, ни с щелочами, в том числе при нагревании с расплавленными щелочами, не окисляются даже такими окислителями, как перманганаты и бихроматы в кислой среде и др. Это говорит о том, что связи C-C и C-H достаточно прочные. Для алканов наиболее характерны реакции замещения, идущие с разрывом связи С-Н.
1) Хлорирование. Наиболее исследован механизм реакции взаимодействия метана с хлором при высокой температуре и при интенсивном освещении. Реакция хлорирования протекает по цепному радикальному механизму. Теорию цепных реакций разработал академик Н.Н.Семенов (1896 – 1986) и был удостоен Нобелевской премии. Механизм реакции: Вначале молекулы хлора под действием квантов света диссоциируют на атомы. При взаимодействии атомарного хлора с молекулой метана образуются HCl и радикал CH3-, который сталкиваясь с молекулой хлора дает CH3Cl и Cl-.
радикалы реагируют друг с другом.
2) Горение. При поджигании (t = 600ºС) алканы вступают в реакцию с кислородом, при этом происходит их окисление до углекислого газа и воды. СnН2n+2 + O2 ––>CO2 + H2O + Q например: СН4 + 2O2 ––>CO2 + 2H2O + Q Смесь метана с кислородом или воздухом при поджигании может взрываться. Наиболее сильный взрыв получается при объёмных отношениях 1: 2 (с кислородом) или 1: 10 (с воздухом), т.к. метан и кислород вступают в реакцию полностью. Подобные смеси опасны в каменноугольных шахтах. Чтобы обеспечить безопасность работы в шахтах, там устанавливают анализаторы, сигнализирующие о появлении газа, и мощные вентиляционные устройства. С3Н8 + 5O2 ––>3CO2 + 4H2O + Q Горение пропан - бутановой смеси можно продемонстрировать на примере газовой зажигалки. При горении алканов выделяется много теплоты, что позволяет использовать их в качестве источника энергии. Но большая часть их используется в качестве сырья для получения других продуктов. 3) Нитрование. При действии разбавленной (10%) азотной кислоты на алканы под давлением при температуре 140o C идет реакция нитрования (реакция Коновалова).
CH3-CH2-CH3 + HO-NO2 → CH3-CH2-CH2-NO2 + H2O 1-нитропропан 4) При температурах 1400 - 1500o C происходит дегидрирование метана и образуются этилен и ацетилен: 2CH4 → C2H2 + 3H2 5) Большое практическое значение в химии алканов играют реакции крекинга. При нагревании алканов до температуры более 4500 происходит разрыв С-С и С-Н связей и последующие превращения образующихся частиц.
6) При каталитическом окислении низших алканов получается смесь разнообразных кислородосодержащих веществ: спиртов, альдегидов, кислот.
2CH4 +O2=2CH3OH 7 ) Реакции изомеризации характерны не для всех алканов. Обращается внимание на возможность превращения одних изомеров в другие, наличие катализаторов.
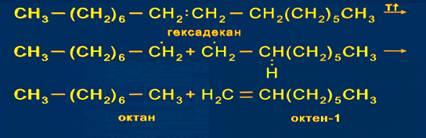
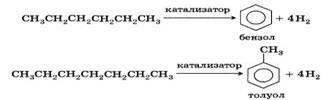
8) Ароматизация:
Следует указать, что метан и его гомологи не взаимодействуют в обычных условиях с кислотами и щелочами, окислителями и восстановителями.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-01-08; просмотров: 131; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.15.34 (0.006 с.) |

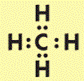
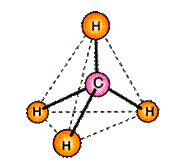
 Атомы углерода в алканах находятся в состоянии sp3 – гибридизации. Это означает, что все 4 гибридные орбитали атома углерода одинаковые по форме и энергии направлены в углы равносторонней треугольной пирамиды – тэтраэдра.
Атомы углерода в алканах находятся в состоянии sp3 – гибридизации. Это означает, что все 4 гибридные орбитали атома углерода одинаковые по форме и энергии направлены в углы равносторонней треугольной пирамиды – тэтраэдра.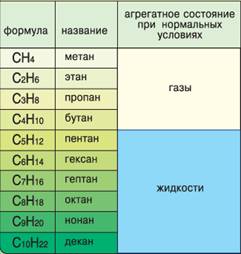
 Физические свойства
Физические свойства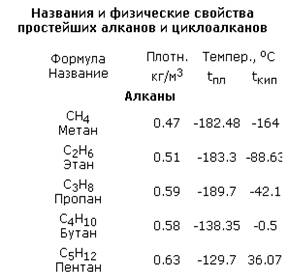
 Все углеводороды плохо растворяются в воде, легче воды.
Все углеводороды плохо растворяются в воде, легче воды.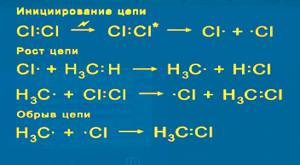 Через несколько тысяч циклов радикальных реакций происходит обрыв цепи -
Через несколько тысяч циклов радикальных реакций происходит обрыв цепи -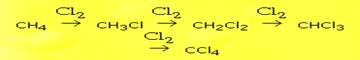 Конечным продуктом взаимодействия хлора с метаном может быть четыреххлористый углерод:
Конечным продуктом взаимодействия хлора с метаном может быть четыреххлористый углерод: