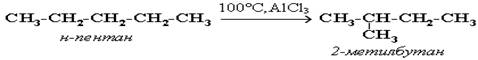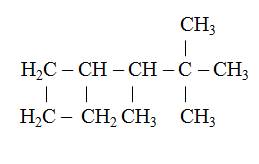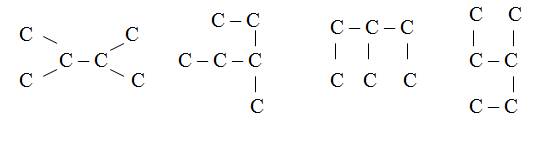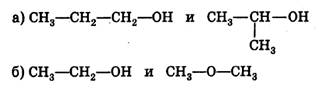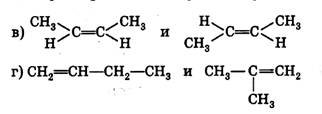Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
II . Актуализация опорных знанийСтр 1 из 4Следующая ⇒
КАРТА ЗАНЯТИЯ № 20 Учебный предмет: Химия Тема Алканы. Цели занятия: образовательные: сформировать представление о нахождении в природе, физических свойствах, химических свойствах, применении и получении алканов. в оспитательные: продолжить формирование познавательного интереса к предмету через создание ситуации успеха, воспитывать настойчивость, упорство в достижении цели. развивающие: развивать учебно-интеллектуальные умения выделять главное и существенное, продолжить развитие учебно-организационных умений, направленных на выполнение поставленной задачи, формирование навыков коммуникативной культуры. Норма времени: 2 часа Тип занятия: комбинированный Вид занятия: лекция с элементами беседы Форма организации учебной деятельности: групповая План занятия: 1. Строение, номенклатура. 2.Физические и химические свойства. 3.Получение и применение алканов. Оснащение: таблицы, презентация, проектор, экран Литература: Основные источники:
Дополнительные источники: 1. Рудзитис Г.Е., Фельдман Ф.Г., Химия. 11 класс. – М.: Просвещение, 2014 2. Рудзитис Г.Е., Фельдман Ф.Г., Химия. 10 класс. – М.: Просвещение, 2014 3. Габриелян О. С., Остроумов И. Г. Химия для профессий и специальностей технического профиля: учебник для студ. учреждений сред. проф. образования. — М., 2014. 4. Габриелян О. С., Остроумов И. Г., Остроумова Е. Е. и др. Химия для профессий и специальностей естественно-научного профиля: учебник для студ. учреждений сред. проф. образования. — М., 2014. 5. Габриелян О. С., Остроумов И. Г. Химия для профессий и специальностей социально-экономического и гуманитарного профилей: учебник для студ. учреждений сред. проф. образования. — М., 2014. 6. Габриелян О. С., Остроумов И. Г., Сладков С. А., Дорофеева Н.М. Практикум: учеб. Пособие для студ. учреждений сред. проф. образования. — М., 2014. Интернет ресурсы:
Преподаватель: Корниенко Т.В.
Тема: Алканы.
Ход урока I. Организационный момент. II. Актуализация опорных знаний Тестовая работа по теме «Теория химического строения А.М.Бутлерова »(Приложение 1) III. Мотив ация и целепологания «Не так давно случилась на Кольском полуострове небывалая история. Горный инженер, работавший в апатитовом руднике близ города Кировска, услышал какой-то странный свист и шум, идущий из-под земли. Кто-то из рабочих неосторожно предложил: «Попробуем – подожжем?..» И попробовали... Вспыхнувшая спичка вызвала взрыв. К счастью, инженер и рабочие отделались только ожогами. Позднее выбросы газа повторились. Химики определили, что в состав газа входит 75 % углерода и 25 % водород, относительная плотность газа по воздуху равна 0,55. Что за газ чуть не унес жизни людей?» После получения ответа учитель объявляет тему урока. и совместно с обучающимися определяют план изучения класса органического соединения. IV. Объяснение нового материала Вопрос 1.Строение, номенклатура. Правила составления номенклатуры алканов. I. Правило главной цепи. Главную цепь выбирают, руководствуясь последовательно следующими критериями: 1. Максимальное число функциональных заместителей. 2. Максимальное число кратных связей. 3. Максимальная протяженность. 4. Максимальное число боковых углеводородных групп. II. Правило наименьших номеров (локантов). Главную цепь нумеруют от одного конца до другого арабскими цифрами. Каждый заместитель получает номер того атома углерода главной цепи, к которому он присоединен. Последовательность нумерации выбирают таким образом, чтобы сумма номеров заместителей (локантов) была наименьшей. Это правило применяется и при нумерации моноциклических соединений. III. Правило радикалов. Все углеводородные боковые группы рассматривают как одновалентные (односвязные) радикалы. Если боковой радикал сам содержит боковые цепи, то в нем по приведенным выше правилам выбирается дополнительная главная цепь, которая нумеруется, начиная с атома углерода, присоединенного к главной цепи.
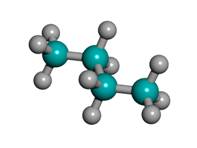
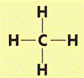
Строение молекулы метана. Простейший представитель алканов – метан Его структурная и электронная формулы:
Однако эти формулы не отражают пространственного строения молекулы.
Изомерия алканов. Изомерия алканов. Изомерия – явление существования соединений, которые имеют одинаковый состав (одинаковую молекулярную формулу), но разное строение. Такие соединения называются изомерами. Характерна структурная изомерия. 1) В формуле молекулы алкана выбирают главную цепь — самую длинную. H3C—CH—CH2—CH—CH2—CH3 -------- | ----------- | CH3 ¦ CH2—CH2—CH3 --------------------- 2) Затем эту цепь нумеруют с того конца, к которому ближе расположен заместитель (радикал). Если заместителей несколько, то поступают так, чтобы цифры, указывающие их положение, были наименьшими. Заместители перечисляют по алфавиту. 1 2 3 4 H3C—CH—CH2—CH—CH2—CH3 | 5 | 6 7 CH3 CH2—CH2—CH3 3) Углеводород называют в таком порядке: вначале указывают (цифрой) место расположения заместителя, затем называют этот заместитель (радикал), а в конце добавляют название главной (самой длинной) цепи. Таким образом, углеводород может быть назван: 2-метил-4-этилгептан (но не 6-метил-4-этилгептан).
Вопос 2.Физические и химические свойства
Температура кипения и плавления постепенно увеличивается с возрастанием длины углеродной цепи.
Химические свойства Углеводороды ряда метана (алканы) при обычных условиях не взаимодействуют ни с кислотами, в том числе с концентрированной серной и азотной, ни с щелочами, в том числе при нагревании с расплавленными щелочами, не окисляются даже такими окислителями, как перманганаты и бихроматы в кислой среде и др. Это говорит о том, что связи C-C и C-H достаточно прочные. Для алканов наиболее характерны реакции замещения, идущие с разрывом связи С-Н.
1) Хлорирование. Наиболее исследован механизм реакции взаимодействия метана с хлором при высокой температуре и при интенсивном освещении. Реакция хлорирования протекает по цепному радикальному механизму. Теорию цепных реакций разработал академик Н.Н.Семенов (1896 – 1986) и был удостоен Нобелевской премии.
Механизм реакции: Вначале молекулы хлора под действием квантов света диссоциируют на атомы. При взаимодействии атомарного хлора с молекулой метана образуются HCl и радикал CH3-, который сталкиваясь с молекулой хлора дает CH3Cl и Cl-.
радикалы реагируют друг с другом.
2) Горение. При поджигании (t = 600ºС) алканы вступают в реакцию с кислородом, при этом происходит их окисление до углекислого газа и воды. СnН2n+2 + O2 ––>CO2 + H2O + Q например: СН4 + 2O2 ––>CO2 + 2H2O + Q Смесь метана с кислородом или воздухом при поджигании может взрываться. Наиболее сильный взрыв получается при объёмных отношениях 1: 2 (с кислородом) или 1: 10 (с воздухом), т.к. метан и кислород вступают в реакцию полностью. Подобные смеси опасны в каменноугольных шахтах. Чтобы обеспечить безопасность работы в шахтах, там устанавливают анализаторы, сигнализирующие о появлении газа, и мощные вентиляционные устройства. С3Н8 + 5O2 ––>3CO2 + 4H2O + Q Горение пропан - бутановой смеси можно продемонстрировать на примере газовой зажигалки. При горении алканов выделяется много теплоты, что позволяет использовать их в качестве источника энергии. Но большая часть их используется в качестве сырья для получения других продуктов. 3) Нитрование. При действии разбавленной (10%) азотной кислоты на алканы под давлением при температуре 140o C идет реакция нитрования (реакция Коновалова).
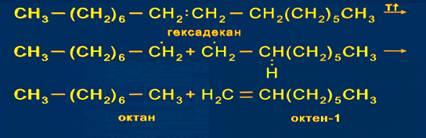
CH3-CH2-CH3 + HO-NO2 → CH3-CH2-CH2-NO2 + H2O 1-нитропропан 4) При температурах 1400 - 1500o C происходит дегидрирование метана и образуются этилен и ацетилен: 2CH4 → C2H2 + 3H2 5) Большое практическое значение в химии алканов играют реакции крекинга. При нагревании алканов до температуры более 4500 происходит разрыв С-С и С-Н связей и последующие превращения образующихся частиц.
6) При каталитическом окислении низших алканов получается смесь разнообразных кислородосодержащих веществ: спиртов, альдегидов, кислот.
2CH4 +O2=2CH3OH 7 ) Реакции изомеризации характерны не для всех алканов. Обращается внимание на возможность превращения одних изомеров в другие, наличие катализаторов.
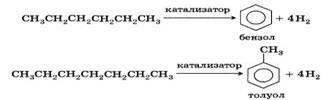
8) Ароматизация:
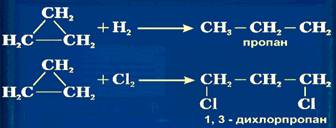
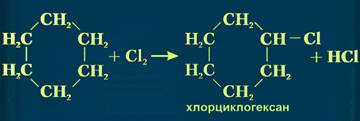
Следует указать, что метан и его гомологи не взаимодействуют в обычных условиях с кислотами и щелочами, окислителями и восстановителями. Свойства У циклопропана и циклобутана достаточно отчетливо выражена способность вступать в реакции присоединения:
Для циклогексана реакции присоединения не характерны, а, как и для алканов, наблюдаются реакции замещения, окисления и дегидрирования.
Вопрос 3.Получение и применение алканов. Получение В промышленности углеводороды можно получать перегонкой нефти. При этом получают обычно нефтяные фракции, кипящие в определенном интервале температур (бензин - температура кипения от 40 до 200o C, керосин - температура кипения от 200 до 275o C, дизельное топливо - температура кипения от 200 до 400o C, смазочные масла - температура кипения выше 300o C, в остатке мазут). В лабораторной практике насыщенные углеводороды можно получать: 1) Гидрированием ненасыщенных и циклических углеводородов с никелевым катализатором:
R-CH=CH2 + H2 → R-CH2-CH3
2) Синтезом Вюрца из галогенпроизводных углеводородов: 2R-Br + 2Na → 2NaBr + R-R,
3) При сплавлении солей карбоновых кислот с щелочами (декарбоксилирование, реакция Дюма): R-COONa + NaOH → R-H + Na2CO3.
4) Метан получается при гидролизе карбида алюминия: Al4C3 + 12H2O = 4Al(OH)3 + 3CH4 5) Изомеризация:
VII. Рефлексия Своей работой на занятии я
VIII. Домашнее задание О.1читать §7.1,,сделать в тетради упр.2,с.139 Д.1читать §7-10,сделать в тетради упр. 4,стр.33, упр.5,стр.41
Приложение 1 Вопрос 1 Укажите справедливые утверждения. В углеводороде со структурной формулой
а)число первичных атомов С равно сумме вторичных и четвертичных б)число вторичных атомов С равно числу третичных в)число третичных атомов С в 2 раза больше числа четвертичных г)число первичных атомов С в 2 раза больше числа третичных Вопрос 2 В органических веществах валентность атома углерода, как правило, равна: а)I б) II в) III г) IV Вопрос 3 Укажите число атомов водорода, которое входит в состав молекулы, скелет которой имеет строение
Вопрос 4 Запишите, сколько углеводородов изображено с помощью следующих структур углеродного скелета?
Вопрос 5 В число положений теории химического строения органических соединений не входит утверждение:
а)органические вещества не могут быть получены из неорганических б)атомы и группы атомов в молекулах взаимно влияют друг на друга в)одной и той же молекулярной формулой можно описать состав различных веществ г)атомы в молекулах связаны в определённой последовательности согласно их валентности Вопрос 6 4 Какое вещество не является гомологом бутена-2: СН3- СН= СН-СН3?
Вопрос 7 Изомеры – это вещества: а) схожие по строению, имеющие одинаковый качественный состав, количественно отличающиеся на одну или несколько ─СН2─ групп
б) одинакового качественного, но разного количественного состава, обладающие схожими свойствами в) с одинаковым качественным и количественным составом, но разным химическим строением и разными свойствами г) различного качественного и количественного состава, но схожего строения Вопрос 8 Для изомеров одинаковы:
а)молярная масса б)физические свойства в)количественный и качественный состав г)строение молекулы Вопрос 9 Примером изомерии углеродного скелета является пара веществ:
Вопрос 10 Сколько веществ изображено с помощью формул Молекулярная формула отображает: а) последовательность соединения атомов в молекуле б) последовательность соединения атомов углерода в молекуле в) пространственное расположение атомов в молекуле г) состав молекулы (качественный и количественный)
КАРТА ЗАНЯТИЯ № 20 Учебный предмет: Химия Тема Алканы. Цели занятия: образовательные: сформировать представление о нахождении в природе, физических свойствах, химических свойствах, применении и получении алканов. в оспитательные: продолжить формирование познавательного интереса к предмету через создание ситуации успеха, воспитывать настойчивость, упорство в достижении цели. развивающие: развивать учебно-интеллектуальные умения выделять главное и существенное, продолжить развитие учебно-организационных умений, направленных на выполнение поставленной задачи, формирование навыков коммуникативной культуры. Норма времени: 2 часа Тип занятия: комбинированный Вид занятия: лекция с элементами беседы Форма организации учебной деятельности: групповая План занятия: 1. Строение, номенклатура. 2.Физические и химические свойства. 3.Получение и применение алканов. Оснащение: таблицы, презентация, проектор, экран Литература: Основные источники:
Дополнительные источники: 1. Рудзитис Г.Е., Фельдман Ф.Г., Химия. 11 класс. – М.: Просвещение, 2014 2. Рудзитис Г.Е., Фельдман Ф.Г., Химия. 10 класс. – М.: Просвещение, 2014 3. Габриелян О. С., Остроумов И. Г. Химия для профессий и специальностей технического профиля: учебник для студ. учреждений сред. проф. образования. — М., 2014. 4. Габриелян О. С., Остроумов И. Г., Остроумова Е. Е. и др. Химия для профессий и специальностей естественно-научного профиля: учебник для студ. учреждений сред. проф. образования. — М., 2014. 5. Габриелян О. С., Остроумов И. Г. Химия для профессий и специальностей социально-экономического и гуманитарного профилей: учебник для студ. учреждений сред. проф. образования. — М., 2014. 6. Габриелян О. С., Остроумов И. Г., Сладков С. А., Дорофеева Н.М. Практикум: учеб. Пособие для студ. учреждений сред. проф. образования. — М., 2014. Интернет ресурсы:
Преподаватель: Корниенко Т.В.
Тема: Алканы.
Ход урока I. Организационный момент. II. Актуализация опорных знаний Тестовая работа по теме «Теория химического строения А.М.Бутлерова »(Приложение 1)
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-01-08; просмотров: 189; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.139.50 (0.119 с.) |
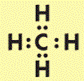
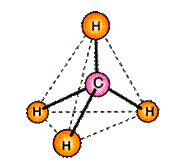
 Атомы углерода в алканах находятся в состоянии sp3 – гибридизации. Это означает, что все 4 гибридные орбитали атома углерода одинаковые по форме и энергии направлены в углы равносторонней треугольной пирамиды – тэтраэдра.
Атомы углерода в алканах находятся в состоянии sp3 – гибридизации. Это означает, что все 4 гибридные орбитали атома углерода одинаковые по форме и энергии направлены в углы равносторонней треугольной пирамиды – тэтраэдра.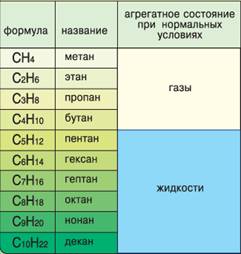
 Физические свойства
Физические свойства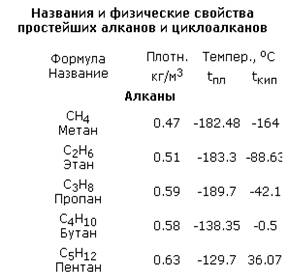
 Все углеводороды плохо растворяются в воде, легче воды.
Все углеводороды плохо растворяются в воде, легче воды.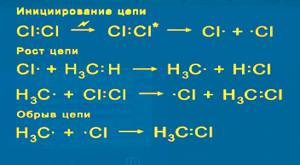 Через несколько тысяч циклов радикальных реакций происходит обрыв цепи -
Через несколько тысяч циклов радикальных реакций происходит обрыв цепи -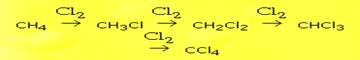 Конечным продуктом взаимодействия хлора с метаном может быть четыреххлористый углерод:
Конечным продуктом взаимодействия хлора с метаном может быть четыреххлористый углерод: