
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кристаллическая решетка и металлическая связьСодержание книги
Поиск на нашем сайте
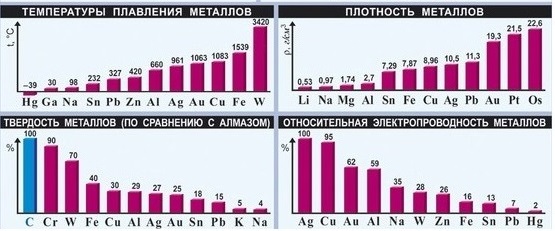
Металлы имеют металлическую кристаллическую решетку, в узлах которой расположены отдельные атомы. Они слабо удерживают валентные электроны, которые по этой причине свободно перемещаются по всему объему металла, формируя единое электронное облако и в равной степени притягиваются всеми атомами. Такая связь называется металлической. Общие свойства металлов – пластичность, способность отражать свет, тепло- и электропроводность – объясняются особенностями их строения. При сильном надавливании кусок металла изменяет форму – часть атомов смещается, но не рассыпается: общее электронное облако прочно удерживает все атомы вместе. В электрическом поле свободные электроны начинают двигаться в определенном направлении, такое упорядоченное движение электронов называют электрическим током. Чем больше в металле свободных электронов и чем сильнее колебания атомов, находящихся в узлах решетки, тем быстрее происходит выравнивание температуры во всем куске металла, то есть тем больше его теплопроводность. Поэтому относительные значения тепло- и электропроводности для многих металлов близки. Вопрос 2. Физические свойства металлов Агрегатное состояние и температуры плавления. Температуры плавления металлов меняются в очень широких пределах. Самый легкоплавкий из металлов – ртуть – при комнатной температуре является жидкостью. Металл галлий плавится от теплоты человеческого тела. Из металлов широко применяемых в технике, наиболее легкоплавкие – олово и свинец. Наибольшую температуру плавления имеет вольфрам, из которого изготавливают нити накаливания лампочек. Металлы с температурой плавления выше 1000oC принято называть тугоплавкими.
ртуть галлий
вольфрам Окраска. Среди металлов немногие обладают характерной окраской. «Золото через свой изрядно желтый цвет и блещущую светлость от прочих металлов отлично», – писал Михаил Васильевич Ломоносов. Медь имеет розово-красный цвет, серебро и платина – белый, щелочной металл цезий – бледно-желтый. Для описания цвета других металлов трудно подобрать слова. Все они кажутся нам серыми с тем или иным едва заметным оттенком.
медь литий Плотность. Металлы сильно различаются по плотности. Наиболее легкими являются щелочные металлы литий, натрий и калий. Литий плавает даже на поверхности керосина – жидкости с плотностью меньшей плотности воды. Металлы с плотностью ниже 5 г/см3 называют легкими. К ним, помимо щелочных и щелочно-земельных металлов, принадлежат магний, алюминий и другие. В число наиболее тяжелых входят переходные металлы, расположенные в шестом периоде, а также актиноиды. Ртуть, например, имеет плотность 13,6 г/см3, то есть литровая банка, заполненная ртутью, весит 13,6 кг!
Твердость вещества оценивают по его способности оставлять царапину на другом веществе. Наиболее твердым веществом является алмаз – он оставляет след на любых поверхностях. Из металлов по твердости к алмазу приближается хром – он царапает стекло. Наиболее мягкие металлы – щелочные. Они легко режутся ножом. Мягкими являются также свинец, олово, цинк, серебро.
Электро - и теплопроводность. Все без исключения металлы хорошо проводят электрический ток. Наибольшей электропроводностью обладает серебро, немного уступают ему медь и золото. Серебро – очень дорогой металл. Его используют в электротехнике при изготовлении высокоточных дорогостоящих приборов. Самые хорошие провода, применяемые в быту, медные. Они во много раз превосходят по самим характеристикам провода, изготовленные из алюминия. При прохождении через металл электрического тока часть электрической энергии преобразуется в тепловую – металл нагревается. Использование алюминиевых проводов при больших нагрузках на электрическую сеть может привести к их плавлению. Особенно опасны места стыка алюминиевых и медных проводов – они нагреваются намного быстрее. Неисправная электропроводка является причиной многих пожаров. Пластичность. Многие металлы пластичны, то есть обладают способностью изменять форму, например, расплющиваться при ударе молотком. Наибольшей пластичностью обладают золото, серебро, медь, олово. Их можно раскатывать в фольгу.
Фольга из меди
Фольга из золота Вопрос 3. Коррозии Мы видим мрачную картину: Вот ржавый гвоздь и ржавая труба, И даже новую машину За год буквально съела ржа. Ползет она как змей ужасный И вглубь, и вширь, и поперек. Корабль, краскою блиставший, С дырой в боку ко дну идет.
Ржавеет всё – трос, лебедка, Опоры зданий и мостов, И даже руль подводной лодки Всегда к ржавлению готов. И где же выход из проблемы, И в чем причина бедствий тех? Найдем ответ мы непременно, Пусть нам сопутствует успех!
Это коррозия. «Рыжий дьявол», «Ржа ест железо» - так гласит русская пословица о коррозии. Коррозия наносит прямой ущерб, ежегодно от неё теряется около1/3 произведённого за год во всём мире металла, но и косвенно разрушает конструкции, на которые был затрачен труд (машины, крыши, памятники архитектуры, мосты…) Тратятся ежегодно огромные средства на борьбу с этим явлением. Коррозия нещадит памятники архитектуры: Царь-пушку (1586г), Царь – колокол (1735 г), Медный всадник в
Санкт- Башню красили 18 раз, отчего её масса(9000тонн) каждый раз увеличивается на 70 тонн. В результате коррозии уменьшается прочность, блеск, снижается электропроводность, возрастает трение между деталями.
Чтобы искать методы защиты от коррозии, необходимо исследовать это явление. К лас с ификация коррозии. Различают два вида: · химическую коррозию; · электрохимическую коррозию. Химическая коррозия металлов — это разрушение металла окислением его в окружающей среде при контакте с газами и электролитами без возникновения электрического тока в системе. Наиболее распространенным видом химической коррозии является газовая коррозия, проистекающая в сухих газах при полном отсутствии влаги. Газообразное вещество окружающей среды реагирует с метал-лом на поверхности металлического изделия и образует с ним соединения. Железо под воздействием O2, H2О и ионов водорода постепенно окисляется. Этот процесс является окислительно-восстановительным, где металл является восстановителем. Коррозия железа может быть описана упрощенным уравнением 4Fe + 3O2 + 6H2О = 4 Fe(OH) 3 Fe0-3е= Fe3+ O02+4 е=2O2- Fe(OH) 3 и является ржавчиной. Содержащиеся в воздухе CO2 и SO2 могут взаимодействовать с водой, с образованием кислот, при диссоциации которых образуются ионы Н+, также окисляющие атомы металлов: Fe0 + 2H+ à Fe2+ + H20
Электрохимическая коррозия — это разрушение металла в среде электролита с возникновением внутри системы электрического тока. Опытным путём установили, что металл быстрее окисляется ионами водорода, если он находится в контакте с менее активным металлом
Большие неприятности связаны с хлоридом натрия (в некоторых странах используют отход производства – хлорид кальция), разбрасываемым в зимнее время на дорогах и тротуарах для удаления снега и льда. В присутствии солей они плавятся, и образующиеся растворы стекают в канализационные трубопроводы. Соли и особенно хлориды являются активаторами коррозии и приводят к ускоренному разрушению металлов, в частности транспортных средств и подземных коммуникаций.
«Методы борьбы с коррозией» Неметаллическое покрытие (лаки, масла, краски и т.д.). Эти вещества изолируют металл от внешней среды. Например, Эйфелева башня в Париже изготовлена из стали и требует покрытия краской для защиты от коррозии и стала весить вместо 9 тонн на 70 тонн больше. Металлическое покрытие – некорродирующими металлами (Zn, Cr, Ag, Ni, Sn и т.д.). Кровельное железо покрывают цинком, который охраняет железо от коррозии, хотя цинк и является более активным металлом. Он сам покрыт оксидной пленкой. Нержавеющие стали (введение легирующих металлов: Cr, Ni, Co, Cu и т.д.). Основано на создании сплавов с антикоррозионными свойствами. Введение в сталь 12% хрома получают сталь устойчивую к коррозии. А введением никеля, кобальта и меди - усиливают антикоррозионные свойства, так как повышают склонность сплавов к пассивации (образование на поверхности металла устойчивой оксидной пленки). Введение ингибитора. Ингибитор – это вещество, способное в малых количествах замедлять протекание химических процессов или останавливать их. Дамасские мастера для снятия окалины использовали растворы сульфатной кислоты с добавками пивных дрожжей, муки, крахмала. Эти примеси были первыми ингибиторами. В результате растворялись лишь окалина и ржавчина. Например, гвоздь в воде с маслом не корродирует – масло является ингибитором. Ингибиторы широко применяются при очистке от накипи паровых котлов, снятия окалины с обработанных изделий, при хранении и перевозке хлоридной кислоты в стальной таре. Протекторная (более активный металл, стоящий левее в ряду электрохимического напряжения металлов) – легко разрушается. Протекторная защита применяется в тех случаях, когда защищается конструкция (подземный трубопровод, корпус корабля), находящаяся в среде электролита (морская вода, подземные почвенные воды и т.д.). Сущность такой защиты заключается в том, что конструкцию соединяют с протектором – более активным металлом, чем металл защищаемой конструкции. Например, дно корабля защищают кусочками из металла Zn, защищая железное дно от разрушения. В роли протекторов выступают и другие металлы: Mg, Al, Zn и сплавы из них. - Ещё одним из способов защиты металлов от коррозии является изготовление сверхчистых металлов. Замечено, что сверхчистые металлы устойчивы к коррозии. Например, сверхчистое железо намного меньше корродирует, чем обычное железо. Знаменитая Кутубская колонна в Индии близ Дели уже полторы тысячи лет стоит и не разрушается, несмотря на жаркий и влажный климат. (сл 34) Сделана она из чистого железа (99,72 %) и весом 6,5 тонн, высотой 7,2 метра и в диаметре от 42 см у основания и до 30 см у верха. Колонна была воздвигнута в честь царя Чандрагупты II. По народному поверью у того, кто прислонится к колонне спиной и сведет за ней руки исполнится заветное желание. Ученые предполагают, что эта колонна изготовлена из метеоритного железа.
|
||||||||
|
Последнее изменение этой страницы: 2021-01-08; просмотров: 122; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.15.138.13 (0.008 с.) |

















 Петербурге, памятник Минину и Пожарскому в Москве, только в этом случае налёт тёмно-зелёный, его называют патиной. Неизлечимо больна Эйфелева башня – символ Парижа, она изготовлена из обычной стали и необратимо ржавеет и разрушается.
Петербурге, памятник Минину и Пожарскому в Москве, только в этом случае налёт тёмно-зелёный, его называют патиной. Неизлечимо больна Эйфелева башня – символ Парижа, она изготовлена из обычной стали и необратимо ржавеет и разрушается.


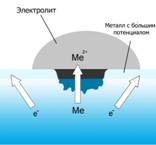 При соприкосновении двух металлов с различными окислительно-восстановительными потенциалами и погружении их в раствор электролита, например, дождевой воды с растворенным углекислым газом CO2, образуется гальванический элемент, так называемый, коррозионный элемент. В ней происходит медленное растворение металлического материала с отрицательным окислительно-восстановительным потенциалом.
При соприкосновении двух металлов с различными окислительно-восстановительными потенциалами и погружении их в раствор электролита, например, дождевой воды с растворенным углекислым газом CO2, образуется гальванический элемент, так называемый, коррозионный элемент. В ней происходит медленное растворение металлического материала с отрицательным окислительно-восстановительным потенциалом.


