
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Электролитный состав плазмы крови. ⇐ ПредыдущаяСтр 9 из 9
Минеральные компоненты плазмы крови. Важнейшими катионами являются ионы натрия, калия, кальция и магния. Им соответствуют анионы: хлориды, бикарбонаты, фосфаты, сульфаты. Часть катионов в плазме крови связаны с органическими анионами и белками. Сумма всех катионов равна сумме анионов, так как плазма крови электронейтральна. Характеристика основных минеральных компонентов плазмы крови приведена в таблице 1. Таблица 1. Основные минеральные компоненты плазмы крови.
Небелковые азотистые компоненты крови (остаточный азот). К этой группе веществ относятся: мочевина, мочевая кислота, аминокислоты, креатин, креатинин, аммиак, индикан, билирубин и другие соединения. Содержание остаточного азота в плазме крови здоровых людей - 15-25 ммоль/л. Повышение содержания остаточного азота в крови называется азотемией.
Безазотистые органические компоненты крови (рис 2). В эту группу веществ входят питательные вещества (углеводы, липиды) и продукты их метаболизма (органические кислоты).
Рисунок 2. Безазотистые органические вещества плазмы крови.
Белки плазмы крови Плазма крови содержит альбумин, α-, β- и γ-глобулины. Альбумины составляют более половины белковых компонентов плазмы крови и служат богатым и быстро реализуемым резервом аминокислот. Обладает большим сродством к воде и больше остальных белков участвует в поддержании коллоидно-онкотического давления. Молекула альбумина содержит много отрицательно заряженных дикарбоновых аминокислот, поэтому может удерживать в крови катионы Na+, Са2+, Сu2+, Zn2+. Из-за относительно небольшого размера молекул, высокой концентрации в плазме и гидрофильных свойств белки альбуминовой группы играют важную роль в поддержании онкотического давления. Альбумины выполняют транспортную функцию, перенося органические соединения — холестерин, свободные жирные кислоты, тироксин, трийодтиронин, жёлчные пигменты, являются источником азота для построения белков. Свободная сульфгидрильная (—SH) группа альбумина связывает тяжёлые металлы, например соединения ртути, которые отлагаются в почках до удаления из организма. Альбумины способны соединяться с некоторыми лекарственными средствами — пенициллином, салицилатами. При недостатке альбумина, который должен удержать Nа+, другие катионы и воду, вода уходит в межклеточное пространство, усиливая отёки. Гипоальбуминемия может наблюдаться при заболевании печени, при повышении проницаемости капилляров, при потерях белка из-за обширных ожогов или злокачественных образований.
α-, β- глобулины это белки принимающие участие в свертывании крови(антигемофильный глобулин, протромбин); белки, связывающие металлы и белки, связанные с липидами. γ-глобулины содержат меньше липидов. В эту группу относят разнообразные антитела и иммуноглобулины: IgG, IgM, IgA, IgD, IgE. Характеристика отельных глобулинов плазмы крови приведена в таблице. Таблица 2. Характеристика отельных глобулинов плазмы крови.
Ферменты плазмы крови. Все ферменты, содержащиеся в плазме крови, можно разделить на три группы: 1.секреторные ферменты - синтезируются в печени, выделяются в кровь, где выполняют свою функцию (например, факторы свёртывания крови); 2.экскреторные ферменты - синтезируются в печени, в норме выделяются с желчью (например, щелочная фосфатаза), их содержание и активность в плазме крови возрастает при нарушении оттока желчи; 3.индикаторные ферменты - синтезируются в различных тканях и попадают в кровь при разрушении клеток этих тканей. В разных клетках преобладают различные ферменты, поэтому при повреждении того или иного органа в крови появляются характерные для него ферменты. Это может быть использовано в диагностике заболеваний. Например, при повреждении клеток печени (гепатит) в крови возрастает активность аланинаминотраноферазы (АЛТ), аспартатаминотрансферазы (ACT), изофермента лактатдегидрогеназы ЛДГ5, глутаматдегидрогеназы, орнитинкарбамоилтрансферазы.
При повреждении клеток миокарда (инфаркт) в крови возрастает активность аспартатаминотрансферазы (ACT), иэофермента лактатдегидрогеназы ЛДГ1, изофермента креатинкиназы MB. При повреждении клеток поджелудочной железы (панкреатит) в крови возрастает активность трипсина, α-амилазы, липазы. Буферные системы крови. рН крови – от 7,37 до 7,44; ее кислотно-основное равновесие поддерживается совместным участием буферных систем плазмы и клеток крови. Буферные системы организма состоят из слабых кислот и их солей с сильными основаниями. Каждая буферная система характеризуется двумя показателями: • рН буфера (зависит от соотношения компонентов буфера); • буферная ёмкость, то есть количество сильного основания или кислоты, которое нужно прибавить к буферному раствору для изменения рН на единицу (зависит от абсолютных концентраций компонентов буфера). Различают следующие буферные системы крови: • бикарбонатная (H2CO3/NaHCO3); • фосфатная (NaH2PO4/Na2HPO4); • гемоглобиновая (дезоксигемоглобин в качестве слабой кислоты/ калиевая соль оксигемоглобина); • белковая (действие её обусловлено амфотерностью белков). Бикарбонатная буферная система – самая управляемая система внеклеточной жидкости и крови. На долю бикарбонатного буфера приходится около 10% всей буферной емкости крови. Бикарбонатная система представляет собой сопряженную кислотно-основную пару, состоящую из молекулы угольной кислоты Н2СО3, выполняющую роль донора протона, и бикарбонат-иона НСО3–, выполняющего роль акцептора протона:
Для данной буферной системы величину рН в растворе можно выразить через константу диссоциации угольной кислоты (рКН2СО3) и логарифм концентрации недиссоциированных молекул Н2СО3 и ионов HCO3–:
Истинная концентрация недиссоциированных молекул Н2СО3 в крови незначительна и находится в прямой зависимости от концентрации растворенного углекислого газа СО2 + Н2О <=> Н2СО3 При нормальном значении рН крови (7,4) концентрация ионов бикарбоната НСО3 в плазме крови превышает концентрацию СО2 примерно в 20 раз. Бикарбонатная буферная система функционирует как эффективный регулятор в области рН 7,4. Механизм действия данной системы заключается в том, что при выделении в кровь относительно больших количеств кислых продуктов водородные ионы Н+ взаимодействуют с ионами бикарбоната НСО3–, что приводит к образованию слабодиссоциирующей угольной кислоты Н2СО3. Последующее снижение концентрации Н2СО3 достигается в результате ускоренного выделения СО2 через легкие в результате их гипервентиляции (напомним, что концентрация Н2СО3 в плазме крови определяется давлением СО2 в альвеолярной газовой смеси). Если в крови увеличивается количество оснований, то они, взаимодействуя со слабой угольной кислотой, образуют ионы бикарбоната и воду. При этом не происходит заметных сдвигов в величине рН. Кроме того, для сохранения нормального соотношения между компонентами буферной системы в этом случае подключаются физиологические механизмы регуляции кислотно-основного равновесия: происходит задержка в плазме крови некоторого количества СО2 в результате гиповентиляции легких. Данная буферная система тесно связана с гемоглобиновой системой.
Гемоглобиновая буферная система – самая мощная буферная система крови. Она в 9 раз мощнее бикарбонатного буфера; на ее долю приходится 75% от всей буферной емкости крови. Участие гемоглобина в регуляции рН крови связано с его ролью в транспорте кислорода и углекислого газа. Константа диссоциации кислотных групп гемоглобина меняется в зависимости от его насыщения кислородом. При насыщении кислородом гемоглобин становится более сильной кислотой (ННbО2), отдавая кислород, превращается в очень слабую органическую кислоту (ННb). Гемоглобиновая буферная система состоит из неионизированного гемоглобина ННb (слабая органическая кислота, донор протонов) и калиевой соли гемоглобина КНb (сопряженное основание, акцептор протонов). Система гемоглобина и система оксигемоглобина являются взаимопревращающимися системами и существуют как единое целое. Буферные свойства гемоглобина прежде всего обусловлены возможностью взаимодействия кисло реагирующих соединений с калиевой солью гемоглобина с образованием эквивалентного количества соответствующей калийной соли кислоты и свободного гемоглобина: КНb + Н2СO3—> КНСO3 + ННb. Именно таким образом превращение калийной соли гемоглобина эритроцитов в свободный ННb с образованием эквивалентного количества бикарбоната обеспечивает поддержание рН крови в пределах физиологически допустимых величин, несмотря на поступление в венозную кровь огромного количества углекислого газа и других кислореагирующих продуктов обмена. Гемоглобин (ННb), попадая в капилляры легких, превращается в оксигемоглобин (ННbО2), что приводит к некоторому подкислению крови, вытеснению части Н2СО3 из бикарбонатов и понижению щелочного резерва крови. Фосфатная буферная система представляет собой сопряженную кислотно-основную пару, состоящую из иона Н2РО4– (донор протонов) и иона НРО42– (акцептор протонов):
Роль кислоты в этой системе выполняет однозамещенный фосфат NaH2PO4, а роль соли двузамещенный фосфат – Na2HPO4. Фосфатная буферная система составляет всего лишь 1% от буферной емкости крови. В других тканях эта система является одной из основных. Для фосфатной буферной системы справедливо следующее уравнение:
Во внеклеточной жидкости, в том числе в крови, соотношение [НРО42–]: [Н2РО4–] составляет 4:1. Величина рКН2РО4– равна 6,86. Буферное действие фосфатной системы основано на возможности связывания водородных ионов с ионами НРО42– с образованием Н2РО4– (Н+ + НРО42– —> Н2РО4–), а также ионов ОН– с ионами Н2РО4– (ОН– + Н2 Р О4– —> HPO42–+ H2O). Буферная пара (Н2РО4––НРО42–) способна оказывать влияние при изменениях рН в интервале от 6,1 до 7,7 и может обеспечивать определенную буферную емкость внутриклеточной жидкости, величина рН которой в пределах 6,9–7,4. В крови максимальная емкость фосфатного буфера проявляется вблизи значения рН - 7,2. Фосфатный буфер в крови находится в тесном взаимодействии с бикарбонатной буферной системой. Органические фосфаты также обладают буферными свойствами, но мощность их слабее, чем неорганического фосфатного буфера. Белковая буферная система имеет меньшее значение для поддержания КОР в плазме крови, чем другие буферные системы. Белки образуют буферную систему благодаря наличию кислотно-основных групп в молекуле белков: белок–Н+ (кислота, донор протонов) и белок (сопряженное основание, акцептор протонов). Белковая буферная система плазмы крови эффективна в области значений рН 7,2–7,4. Перечисленные буферные системы крови играют важную роль в регуляции кислотно-основного равновесия. В этом процессе, помимо буферных систем крови, активное участие принимают также система дыхания и мочевыделительная система. Дыхательная регуляция КОС осуществляется путём изменения интенсивности внешнего дыхания. При накоплении в крови СО2 и Н+ усиливается лёгочная вентиляция, что приводит к нормализации газового состава крови. Снижение концентрации углекислоты и Н+ вызывает уменьшение лёгочной вентиляции и нормализацию данных показателей. Почечная регуляция КОС осуществляется главным образом за счёт трёх механизмов: • реабсорбции бикарбонатов (в клетках почечных канальцев из Н2О и СО2 образуется угольная кислота Н2СО3; она диссоциирует, Н+ выделяется в мочу, НСО3-— реабсорбируетоя в кровь); • реабсорбции Na+ из клубочкового фильтрата в обмен на Н+ (при этом Na2HPO4 в фильтрате переходит в NaH2PO4 и увеличивается кислотность мочи); • секреции NH4+ (при гидролизе глутамина в клетках канальцев образуется NH3; он взаимодействует с H+, образуются ионы NH4+, которые выводятся с мочой. Известны четыре главные формы нарушений кислотно-основного состояния: Ацидоз - форма нарушения кислотно-щелочного равновесия в организме, характеризующаяся сдвигом отношений между анионами кислот и катионами оснований в сторону увеличения анионов. (Снижение величины рН крови ниже 6,8 несовместимо с жизнью). Выделяют дыхательный и метаболический ацидоз. Дыхательный ацидоз - состояние, при котором кровь имеет кислую реакцию. Количество углекислого газа в крови определяется частотой и глубиной дыхания. В норме, если растет содержание углекислого газа, pH крови снижается и реакция крови становится кислой. Высокое содержание углекислого газа в крови стимулирует отделы мозга, регулирующие дыхание, которые в свою очередь стимулируют более быстрое и глубокое дыхание. Метаболический ацидоз - нарушение кислотно-основного состояния, проявляющееся низкими значениями рН крови и низкой концентрацией бикарбоната в крови. Алкалоз - характеризуется сдвигом отношений между анионами кислот и катионами оснований крови в сторону увеличения катионов, рН крови при этом увеличивается (значение рН более 7,7 несовместимо с жизнью). Дыхательный алкалоз - состояние, при котором кровь имеет основную (щелочную) реакцию, вызванную снижением в ней концентрации углекислого газа вследствие быстрого или глубокого дыхания. Метаболический алкалоз - состояние, при котором кровь имеет основную реакцию, вызванную повышением в ней концентрации бикарбоната.
Характеристика системы свертывания крови Гемостаз – это физиологическая реакция, основной целью, которой является остановка кровотечения, сохранение жидкого состояния крови в сосудах и восстановление поврежденного сосуда и ткани. В процессе свертывания крови принимают участие много факторов, из них 13 находятся в плазме крови и называются плазменными факторами. Они обозначаются римскими цифрами (I-XIII). Другие 12 факторов находятся в форменных элементах крови (особенно, тромбоцитах, поэтому их называют тромбоцитарными) и в тканях. Их обозначают арабскими цифрами (1-12). Так, в тромбоцитах находятся фактор 3 кровяных пластинок (предшественник тромбопластина), аналоги факторов V и XIII, фибриногена и др.
Плазменные факторы свертывания крови: Фактор I — фибриноген — гликопротеин, представляет собой димер, в каждой единице которого содержатся три полипептидные цепи, соединенные дисульфидными мостиками. Фактор II— протромбин — относится к эуглобулинам. Фактор II cинтезируется в печени при участии витамина К. Если нарушается функция печени, концентрация протромбина в крови снижается. Скорость свертывания крови нарушается лишь при уменьшении концентрации протромбина ниже 40 %. Существенной особенностью факторов протромбинового комплекса является зависимость их активности от участия в их синтезе витамина К:
Фактор III — тканевый тромбопластин, апопротеин С — его много в легких, тканях мозга, сердца, кишечника, матки, в эндотелии. Он участвует в локальном гемостазе. При контакте с плазменными факторами (VIIa, IV) способен активировать фактор Х (это внешний путь формирования протромбиназы). Из форменных элементов тканевый тромбопластин могут синтезировать только моноциты. Фактор IV — ионы кальция. Необходим для активации протромбиназы и превращения протромбина в тромбин. Кальций способен связывать гепарин, благодаря чему свертывание крови ускоряется. Без кальция нарушается агрегация тромбоцитов и ретракция кровяного сгустка. Ионы кальция ингибируют фибринолиз. Фактор V — проакселерин, или Ас-глобулин. Он необходим для образования внутренней (кровяной) протромбиназы, при этом заметно активирует фактор X, и для превращения протромбина в тромбин, когда в комплекс включаются фактор Ха, Са2+и фосфолипид. В случаях дефицита фактора V в различной степени нарушаются внешний и внутренний пути образования протромбиназы. Фактор VI — акселерин, или сывороточный Ас-глобулин,—активная форма фактора V. В связи с тем что отдельным фактором признается только неактивная, профакторная, форма коагулянта, акселерин исключен из употребления и номенклатуры факторов свертывания. Фактор VII — проконвертин, или конвертин,—синтезируется в печени при участии витамина К. Факторы ХII, Ха, калликреин могут превращать фактор VII в VIIa. В основном способствуют образованию тканевой протромбиназы и превращению протромбина в тромбин. Фактор VII в циркулирующей крови активирует фактор X. Это действие усиливается после активации проконвертина тканевым тромбопластином. У больных с поражением печени и у подвергаемых лечению антикоагулянтами непрямого действия активность фактора VII снижается. Фактор VIII — антигемофильный глобулин А, или плазменный тромбопластический фактор А,— относится к сложным гликопротеидам. В крови этот фактор циркулирует в виде комплекса из трех субъединиц, обозначаемых VIIIK(коагулирующая единица), VIII-АГ (основной антигенный маркер) и VIII-фВ (фактор Виллебранда, связанный с VIII-АГ). VIII-фВ регулирует синтез коагулянтной части антигемофильного глобулина—VIIIK. Фактор IX — Кристмас-фактор, плазменный тромбопластиновый компонент. Фактор IX образуется в печени. В крови больных гепатитами, циррозами печени, а также у принимающих производные дикумарина его содержание уменьшено. Фактор Х — фактор Стюарта — Прауэра — гликопротеин. Вырабатывается в печени в неактивном состоянии при участии витамина К и состоит из двух полипептидных цепей: тяжелой, на которой находится активный центр, и легкой — с остатком карбоксиглутаминовой кислоты, необходимой для присоединения к фосфолипидам. Фактор XI— плазменный предшественник тромбопластина - гликопротеин. Активная форма этого фактора (ХIа) образуется при участии факторов ХIIа, Флетчера и Фитцжеральда — Фложе. Форма ХIа активирует фактор IX, который превращается в фактор IХа. Эта реакция осуществляется ионами кальция. Фактор XIII — фибринстабилизирующий фактор, фибриназа — a2-гликопротеид. В плазме находится в виде профермента, соединенного с фибриногеном. Фактор XIII под влиянием тромбина превращается в активную форму (XIIIa). 10% фибриназы обеспечивают полноценный гемостаз, 2% этого фактора достаточны для остановки кровотечения. Фактор Флетчера — плазменный прекалликреин, участвующий в реакциях коагуляции в контактной фазе. Три звена гемостаза: 1. Клетки и компоненты стенки сосуда; 2. Клетки крови; 3. Белки плазмы крови (факторы свертывания крови, активаторы, ингибиторы системы свертывания крови и фибринолиза, белки антикоагулянтной системы протеинаС). Белки свертывания крови образуют 2 ферментативные системы, имеющие своей целью поддержание гемостатического баланса: 1.Система свертывания плазмы - состоит из ферментов, неферментативных белковых кофакторов и ингибиторов свертывания. Конечной целью этой системы является образование фермента тромбина, а в конечном итоге - фибринового сгустка, составляющего основу гемостатического тромба. 2. Система фибринолиза - в неё входят плазминоген, его активаторы и ингибиторы. Целью этой системы является образование главного фермента фибринолиза плазмина и лизис фибринового сгустка. В обеих системах происходит многоэтапный ферментативный процесс активации, в котором участвует ряд белков - протеаз. Серию реакций протеолиза профермента в фермент, идущих с ускорением, называют каскадом свертывания крови. Процесс свертывания крови реализуется многоэтапным взаимодействием на фосфолипидных мембранах («матрицах»). Многие реакции нуждаются в наличии специфической поверхности и ионов кальция. Большинство белков гемостаза имеют сайты связывания кальция. Наиболее важные из известных функций кальция в гемостазе: участие в образовании связей витамин-К-зависимых факторов (II, VII, IX, X, протеин С, протеин S) с фосфолипидной поверхностью; участие в активации фактора XIII; участие в образовании связи ф.VII и тканевого фактора; ускорение процесса роста фибринового сгустка, участие в стабилизации фибринового сгустка, ограничение протеолиза фибрина и фибриногена плазмином, защита фибриногена и фибрина от температурной и щелочной денатурации. В системе свертывания крови различают два звена: клеточный (сосудисто-тромбоцитарный или микроциркуляторный) и плазменный (коагуляционный). Сосудисто-тромбоцитарный механизм гемостаза. Это адгезия (прилипание тромбоцитов к поврежденной поверхности сосуда), агрегация (склеивание одноименных клеток между собой), а также высвобождение из форменных элементов веществ, активирующих гемостаз. Сосудисто-тромбоцитарный механизм состоит из ряда последовательных этапов: 1. Кратковременный спазм поврежденных сосудов, возникающий под влиянием сосудосуживающих веществ, высвобождающихся из тромбоцитов (адреналин, норадреналин, серотонин). 2. Адгезия тромбоцитов к раневой поверхности, происходящая в результате изменения в месте повреждения отрицательного электрического заряда внутренней стенки сосуда на положительный. Тромбоциты, несущие на своей поверхности отрицательный заряд, прилипают к травмированному участку. Адгезия тромбоцитов завершается за 3-10 секунд. 3. Обратимая агрегация тромбоцитов у места повреждения. Она начинается почти одновременно с адгезией и обусловлена выделением поврежденной стенкой сосуда, из тромбоцитов и эритроцитов биологически активных веществ (АТФ, АДФ). В результате образуется рыхлая тромбоцитарная пробка, через которую проходит плазма крови. 4. Необратимая агрегация тромбоцитов, при которой тромбоциты теряют свою структурность и сливаются в гомогенную массу, образуя пробку, непроницаемую для плазмы крови. Эта реакция: происходит под действием тромбина, разрушающего мембрану тромбоцитов, что ведет к выходу из них физиологически активных веществ: серотонина, гистамина, ферментов и факторов свертывания крови. Их выделение способствует вторичному спазму сосудов. Освобождение фактора 3 дает начало образованию тромбоцитарной протромбиназы, т. е. включению механизма коагуляционного гемостаза. На агрегатах тромбоцитов образуется небольшое количество нитей фибрина, в сетях которого задерживаются форменные элементы крови. 5. Ретракция тромбоцитарного тромба, т. е. уплотнение и закрепление тромбоцитарной пробки в поврежденном сосуде за счет фибриновых нитей и гемостаз на этом заканчивается. Но в крупных сосудах тромбоцитарный тромб, будучи непрочным, не выдерживает высокого кровяного давления и вымывается. Поэтому в крупных сосудах на основе тромбоцитарного тромба образуется более прочный фибриновый тромб, для формирования которого включается ферментативный коагуляционный механизм. Коагуляционный механизм гемостаза. Этот механизм имеет место при травме крупных сосудов и протекает через ряд последовательных фаз. Первая фаза. Самой сложной и продолжительной фазой является формирование протромбиназы. Формируются тканевая и кровяная протромбиназы. Образование тканевой протромбиназы запускается тканевым тромбопластином, представляющий собой фрагменты клеточных мембран и образующегося при повреждении стенок сосуда и окружающих тканей. В формировании тканевой протромбиназы участвуют плазменные факторы IV, V, VII, X. Эта фаза длится 5-10 с. Кровяная протромбиназа образуется медленнее, чем тканевая. Тромбоцитарный и эритроцитарный тромбопластин высвобождаются при разрушении тромбоцитов и эритроцитов. Начальной реакцией является активация XII фактора, которая осуществляется при его контакте с обнажающимися при повреждении сосуда волокнами коллагена. Затем фактор XII с помощью активированного им калликреина и кинина активирует фактор XI, образуя с ним комплекс. На фосфолипидах разрушенных тромбоцитов и эритроцитов завершается образование комплекса фактор XII + фактор XI. В дальнейшем реакции образования кровяной протромбиназы протекают на матрице фосфолипидов. Под влиянием фактора XI активируется фактор IX, который реагирует с фактором IV (ионы кальция) и VIII, образуя кальциевый комплекс. Он адсорбируется на фосфолипидах и затем активирует фактор X. Этот фактор на фосфолипидах же образует комплекс фактор Х + фактор V + фактор IV и завершает образование кровяной протромбиназы. Образование кровяной протромбиназы длится 5-10 минут. Вторая фаза. Образование тромбина из протромбина. Протромбиназа адсорбирует протромбин и на своей поверхности превращает его в тромбин. Процесс протекает с участием факторов IV, V, X, и факторов 1 и 2 тромбоцитов. Вторая фаза длится 2-5 с. Третья фаза. В третьей фазе происходит образование (превращение) нерастворимого фибрина из фибриногена. Эта фаза протекает в три этапа. На первом этапе под влиянием тромбина происходит отщепление пептидов, что приводит к образованию фибрин-мономера. Затем с участием ионов кальция из него образуется растворимый фибрин-полимер. На третьем этапе при участии фактора XIII и фибриназы тканей, тромбоцитов и эритроцитов происходит образование окончательного (нерастворимого) фибрина-полимера. Фибриназа при этом образует прочные пептидные связи между соседними молекулами фибрина-полимера, что в целом увеличивает его прочность и устойчивость к фибринолизу. В этой фибриновой сети задерживаются форменные элементы крови, формируется кровяной сгусток (тромб), который уменьшает или полностью прекращает кровопотерю.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-01-14; просмотров: 226; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.166.7 (0.082 с.) |

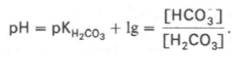
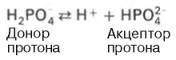
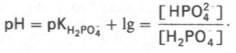

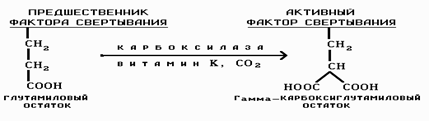 При его участии вырабатываемые в печени факторы имеют гамма-карбоксигруппировки, которые осуществляют реакцию с отрицательными группами тромбопластина через кальциевые мостики. Такая реконфигурация неактивного фактора обеспечивает ему раскрытие собственного активного центра и таким образом происходит превращение их в активную форму.
При его участии вырабатываемые в печени факторы имеют гамма-карбоксигруппировки, которые осуществляют реакцию с отрицательными группами тромбопластина через кальциевые мостики. Такая реконфигурация неактивного фактора обеспечивает ему раскрытие собственного активного центра и таким образом происходит превращение их в активную форму.


