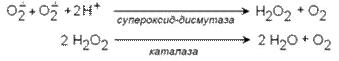Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
К.Г. Матьков, Е.Н. Шамитова., Н.Н.ВикторовичСтр 1 из 9Следующая ⇒
УДК ББК Рецензенты: О.В. Каюкова - кад. хим. наук, доцент, декан факультета биотехнологий и агрохимии, зав.каф. агрохимии и экологии ФГБОУ ВПО «Чувашская государственная сельскохозяйственная академия»; Л.В. Борисова - кад. мед. наук, зав. клинико-диагностической лабораторией БУ «Республиканский эндокринологический диспансер»
К.Г. Матьков, Е.Н. Шамитова., Н.Н.Викторович М
Биохимия полости рта: учебное пособие /К.Г. Матьков, Е.Н. Шамитова., Н.Н.Викторович. Чебоксары: Изд-во Чуваш. Ун-та, 2016. 82 стр.
Учебное пособие предназначено для студентов специальности стоматология медицинских вузов и факультетов. Соответствует программе по биохимии. В учебном пособии необходимые для усвоения раздела биохимии (биохимии полости рта).
Ответственный редактор д-р мед.наук. зав. кафедрой фармакологии, клинической фармакологии и биохимии С.И. Павлова
Утверждено Учебно-методическим советом университета.
ISBN 978-5-7677-2085-9
Учебное пособие предназначено для студентов специальности стоматология медицинских вузов и факультетов. Соответствует программе по биохимии. В учебном пособии необходимые для усвоения раздела биохимии (биохимии полости рта). Предисловие. Биохимия полости рта - один из разделов общей биохимии с акцентацией материала для студентов, обучающихся по специальности «Стоматология». Она содержит материалы, связанные с метаболизмом структур с которыми имеют дело стоматологи в их практической деятельности. Учебное пособие содержит одну из тем, изучаемую студентами обучающиеся по специальности «Лечебное дело» - биохимия крови. Для студентов, обучающихся по специальности «Стоматология» содержится материал по биохимии соединительной, нервной, костной ткани, зубов и слюны. Материал рассчитан на 4 занятия и необходим студентам обучающиеся по специальности «Стоматология» для понимания молекулярных основ структур ротовой полости и происходящих в них изменениях при патологии и внешнем вмешательстве. Для лучшего усвоения материала в конце пособия приведены ситуационные задачи. БИОХИМИЯ ПОЛОСТИ РТА
Ротовая полость является входными воротами для компонентов необходимых для поддержания жизнедеятельности организма. Через ротовую полость в организм поступают пища, вода и воздух необходимые для поддержания основного обмена.
Зубочелюстной аппарат способствует механическому измельчению пищи, что делает её впоследствии более доступной для гидролиза ферментами желудочно-кишечного тракта. Слюна, поступающая в ротовую полость, смачивает пищевой комок, способствует продвижению его по пищеводу, а содержащиеся в ней ферменты участвуют в процессах гидролиза полисахаридов и обезвреживании микроорганизмов. Слюна активно участвует в процессах минерализации, деминерализации и реминерализации эмали. Химиорецепторы языка сигнализируют о вкусовых качествах пищи и воды, что, отчасти, предотвращает поступление в организм несъедобных и токсических соединений. Специализированные клетки языка вырабатывают лингвальную липазу. Этот фермент гидролизует жиры молока и особенно активен в период вскармливания у детей грудного возраста. Миндалины выполняют барьерную функцию на пути поступления микроорганизмов. В поддержании перечисленных функций участвуют клетки соединительной, мышечной, нервной и других тканей. Химический состав и особенности обмена клеток этих тканей являются предметом изучения биохимии ротовой полости.
Белки эмали
Содержание белка в эмали, по данным различных исследователей, составляет от 0,5 до 4%. В основном это низкомолекулярные белки. Различают три группы белков эмали: первая – белок нерастворимый в ЭДТА и соляной кислоте; вторая – кальций-связывающий белок эмали (КСБЭ); третья – водорастворимый белок эмали. В нейтральной среде КСБЭ образует нерастворимый комплекс с ионами кальция и вместе с минеральной фазой при нейтрализации кислых растворов выпадает в осадок. Молекулярная масса КСБЭ 20000. При взаимодействии белка с ионами кальция он образует агрегаты типа ди-, три- и тетрамеров с молекулярной массой 40000 – 80000. Один моль белка связывает 8 – 10 ионов кальция. В кислой среде комплекс распадается с образованием мономерного КСБЭ. В образовании агрегатов КСБЭ важное значение отводится фосфолипидам, которые предположительно играют роль мостика между агрегатом КСБЭ и минеральной фазой.
Третья группа белков – это растворимые в воде белки с молекулярной массой 20000. Эти белки не обладают сродством к минеральной фазе, не образуют комплексов с ионами кальция и имеют более регулярную структуру. Роль данной группы белков неизвестна. Предполагается, что белки эмали участвуют в формировании свойственной эмали структуры. Согласно модели предложенной Ю.А. Петровичем, растворимый в воде КСБЭ переходит в нерастворимую форму при связывании ионов кальция. Связывание кальция способствует образованию олигомеров. Таким образом, строится трехмерная белковая сетка эмали. Длина молекулы КСБЭ 25 нм, что приблизительно совпадает с длиной кристалла гидроксиапатита. Молекулы КСБЭ через связанный ими кальций взаимодействуют с гидроксиапатитом эмали. Согласно выдвигаемой модели связь минеральной фазы и белковой матрицы в эмали через ионы кальция, главная функциональная связь этих двух фаз. Такая связь может осуществляться через карбоксильные группы остатков аспартата или глутамата, а также через остатки фосфорной кислоты связанной с гидроксиаминокислотами (серин, треонин, тирозин). Предполагается, что связанный с КСБЭ Са2+ инициирует рост кристаллов гидроксиапатита, которые ориентируются в соответствии со сформированной трехмерной сетью – матрицей эмали. Таким образом, белковая матрица обеспечивает белковый каркас эмали и зоны первичной нуклеации минеральной фазы, программирует регулярность и упорядоченность структуры эмали. В связи с этим дефекты в развитии и формировании белковой матрицы трудно восполнимы. Важное значение, в построении функциональной модели эмали придают белку нерастворимому в кислотах и ЭДТА. Данный белок при декальцинации зуба остается на его коронке в виде короны, волокна которой идут от фиссур жевательной поверхности к шейке зуба. Согласно модели Петровича белок нерастворимый в кислотах образует остов – каркас, с которым связана трехмерная сетка КСБЭ, соединенная с гидроксиапатитом. КСБЭ и, возможно, частично белок нерастворимый в кислотах, ориентируют ход кристаллизации, обеспечивая упорядоченность и регулярность вновь образуемой структуры эмали. Второй этап минерализации эмали имеющий место после прорезания зуба идет за счет слюны. Дентин составляет основную массу зуба, в нем содержится до 72% неорганических веществ и около 28% органических. Неорганические вещества представлены фосфатом, карбонатом и фторидом кальция, а органические, в основном, коллагеном. Дентин построен из основного вещества и проходящих в нем трубочек, в которых расположены отростки одонтобластов и окончания нервных волокон, проникающих из пульпы. Основное вещество состоит из склеивающего вещества и пучков коллагеновых фибрилл. В склеивающем веществе имеется большое количество минеральных солей. Образование дентина происходит в течение всего времени функционирования зуба. Дентин, образующийся после прорезания зуба, называется вторичным. Цемент зуба состоит из 68% неорганических и 32% органических веществ. Из неорганических веществ преобладают соли фосфата и карбоната кальция. Органическое вещество представлено, главным образом, коллагеном.
СОСТАВ И СВОЙСТВА СЛЮНЫ
Слюна одна из жидких сред организма, образуется в слюнных железах и выделяется в ротовую полость. В сутки образуется 1,4 – 1,5 литра, состоит из воды (99,14 – 99,42%) и растворенных в ней минеральных и органических компонентов. Минеральные компоненты представлены, в основном, фосфатами, карбонатами и хлоридами. Содержание неорганического фосфата в слюне в 2 – 10 раз выше, чем в сыворотке крови (0,06 – 0,24 г/л), а кальция в два раза ниже. У человека в слюне концентрируются йод, фосфат, роданид, а у крыс кальций. Это свидетельствует о высокой видовой селективности слюнных желез в проницаемости для различных ионов. Органические компоненты слюны представлены белками, протеогликанами, аминокислотами, глюкозой, мочевиной и рядом других низкомолекулярных соединений обнаруживаемых и в сыворотке крови. Одной из важнейших функций слюны является её участие в минерализации, деминерализации и реминерализации эмали зубов и поддержания постоянства минеральных компонентов в ней. Кроме того, слюна выполняет защитную функцию, заключающуюся в ограждении полости рта от вредного влияния факторов среды, участвует в механическом и химическом очищении полости рта от остатков пищи, микрофлоры и детрита.
Коллаген
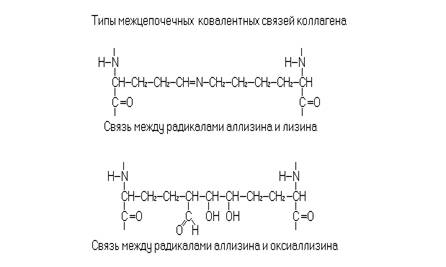
Коллаген один из основных белков соединительной ткани. Белок располагается во внеклеточном веществе, где образует нерастворимые нити, погруженные в матрикс из протеогликанов. Коллагеновые волокна построены из фибрилл. Ориентация фибрилл различается в разных тканях. Коллагеновые волокна связок, сухожилий и кожи ориентированы параллельно, а в заживающих ранах – хаотично. Структурной единицей фибрилл является молекула тропоколлагена. Тропоколлагены выделенные из разных структур отличаются по своему аминокислотному составу, но имеют одинаковую структурную организацию. Типичная молекула тропоколлагена состоит из трех полипептидных цепей с суммарной массой 300000 дальтон. Отдельная полипептидная цепь содержит около 1000 аминокислотных остатков и образует левозакрученную спираль, содержащую 3 остатка на 1 виток. В свою очередь отдельные субъединицы объединяются с образованием правозакрученной спирали, где переплетение отдельных цепей образует структуру наподобие кабеля. Отдельные цепи взаимодействуют между собой за счет водородных связей между пептидными группами соседних цепей. Кроме того, структура стабилизируется ковалентными сшивками между радикалами лизина, оксилизина, аллизина и оксиаллизина. Характерной чертой построения протомеров тропоколлагена является наличие чередующихся последовательностей – Гли - Про - Х -. Часть радикалов пролина и лизина гидроксилирована. В большинстве коллагенов присутствуют 4 – оксипролин и 5 – оксилизин, но в некоторых коллагенах встречается и 3 - оксипролин. Коллагеновые фибриллы образуются молекулами тропоколлагена соединенными конец к концу и бок о бок. Начало молекул в соседних цепях смещено на четверть длины. Боковые взаимодействия молекул тропоколлагена осуществляются за счет не ковалентных и ковалентных взаимодействий.
Синтез коллагена в фибробластах и остеобластах идет на полисомах. Синтезируются все три полипептидные цепи. Все синтезируемые цепи длиннее, чем те которые присутствуют в тропоколлагене. Так например a- цепи содержат дополнительные фрагменты на N- конце молекулярной массой 20000 и C конце 35000 дальтон. Гидроксилирование пролина и лизина осуществляется пролиноксидазой и лизиноксидазой соответственно ещё на стадии элонгации. Вновь синтезированные цепи объединяются в структуру проколлагена. Дополнительные фрагменты на N и C концах образуют глобулярные структуры. Проколлаген секретируется из клетки аппаратом Гольджи. Процессинг проколлагена осуществляется внеклеточно путем гидролиза соответствующих пептидных связей N и C концевыми проколлагеновыми пептидазами. Помимо гидроксилирования молекулы проколлагена подвергаются гликозилированию с участием нуклеотид – сахар – гликозилтрансфераз. Идет присоединение остатков галактозы или галактозилглюкозы к ОН группе 5 – гидроксилизина. При образовании молекул тропоколлагена и их объединения в фибриллы между a- цепями формируются поперечные ковалентные связи. Сначала лизилоксидаза окисляет концевую -NH2 группу лизина или гидроксилизина до альдегидной группы –СНО. При этом образуются аллизин и оксиаллизин соответственно. Остатки аллизина взаимодействуют с остатками лизина и оксилизина соседних цепей, образуя ковалентную связь.
При конденсации остатков аллизина и оксиаллизина образуется синдезин. Синдезин выделен из зубов человека. В костях, в том числе и зубах коллаген индуцирует минерализацию. Формирование минеральной кристаллической решетки начинается в зоне находящейся между коллагеновыми фибриллами. В процессе формирования кости кристаллы образуются сначала в зоне коллагеновых волокон. Затем они сами в свою очередь становятся центрами нуклеации для отложения кристаллов гидроксиапатита в пространстве между коллагеновыми волокнами. Формирование кости происходит только в непосредственной близости от остеобластов. В зоне кальцификации происходит деградация комплексов белок – полисахарид (протеогликанов) при участии лизосомальных протеиназ клеток кости. Так, по-видимому, протекает минерализация в дентине и цементе зуба.
С возрастом состав и структура коллагенов организма меняется. Эти изменения выражаются в снижении растворимости коллагена, увеличении прочности волокон, снижении эластичности и способности к набуханию, изменению содержания оксипролина, в характере гликозилирования.
БИОХИМИЯ КОСТНОЙ ТКАНИ
Кости человека состоят из органического матрикса, кристаллов фосфорно – кальциевых солей 45-50% и клеток кости – остеобластов, остеоцитов, остеокластов. Остеобласты – клетки мезенхимного происхождения, вырабатывают органические составные части остеоида и участвуют в процессах его минерализации. В период активного функционирования эти клетки называются активными остеобластами. После окружения себя минеральным матриксом клетки теряют свою метаболическую активность, меняют форму, теряют способность к размножению, такие клетки называются остеоцитами и преобладают в зрелой кости. Остеоциты окружены полостью (лакуной) и взаимодействуют между собой через многочисленные отростки проходящими в узких костных канальцах. С помощью отростков клетки обмениваются между собой низкомолекулярными метаболитами и ионами через щелевые контакты. Остеобласты оказавшиеся на поверхности кости образуют слой покоящихся остеобластов. Эти клетки образуют тонкий 0,1-0,5 мкм органический матрикс, который не минерализуется. Вырабатываемый ими органический матрикс отделяет их от кости и называется эндостальной мембраной. Такая форма остеоида останавливает рост кости в ширину и защищает её поверхность от «несанкционированной» атаки клетками разрушающими кость. Остеоциты и покоящиеся остеобласты сохраняют способность реагировать на гормональные и другие регуляторные воздействия. Остеокласты не вырабатывают костную ткань, а участвуют в её резорбции. Эти клетки образуются путем слияния клеток крови моноцитов. Остеокласты содержат десятки ядер, а их размер составляет 20 – 100 мкм. Клетки отличаются высокой активностью карбоангидразы, кислой фосфатазы. В мембранах клеток имеется Н+ - АТФаза и рецепторы к кальцитонину и витронектину (определяет адгезию к окружающему матриксу). Многочисленные лизосомы накапливают и выделяют в среду множество кислых гидролаз, участвующих в расщеплении макромолекул остеоида. Органические компоненты костной ткани представлены, в основном, белками. Протеогликанов и воды в кости гораздо меньше, чем в хряще. Волокнистые структуры костного матрикса на 90% процентов состоят из коллагена 1 типа. Из минорных компонентов присутствуют коллагены типов 5 и 12, которые входят в состав волокон или ассоциированы с ними. Коллаген типа 5 способен связываться с протеогликанами и рядом белков. Считается, что он контролирует конечный диаметр коллагеновых фибрилл. Коллаген 12 типа кроме аналогичных свойств имеет несколько RGD – центров связывания с клетками и, следовательно, участвует в единении клеточных элементов и межклеточных структур. В небольших количествах имеется и коллаген 6 типа. Это белок также имеет RGD – центры и участвует в прикреплении клеток к коллагенам 1 и 5, а также взаимодействия их с неколлагеновыми молекулами. Содержание гиалуроновой кислоты в костях невелико, равно как и количество протеогликанов (декорина и бигликана). Неколлагеновые белки представлены гликопротеинами, которые составляют около 10% органического матрикса. Среди этих белков преобладают сиалопротеины (остеопонтин и костный сиалопротеин 2), остеонектин, костный и матриксный Gla – протеины (белки, которые содержат остатки g- карбоксиглутаминовой кислоты). Остеопонтин и остеонектин содержатся также в мозге, почке, печени и плаценте. Сиалопротеин 2 и остеокальцин характерны только для кости и дентина. Кроме перечисленных белков в кости встречаются и белки плазмы. Минеральная составляющая кости представлена, главным образом, кристаллами гидроксиапатита, структурированных во внеклеточном матриксе. В целом упаковка частиц в кристалле гидроксиапатита представляет многослойную гексагональную структуру, где с каждым ионом фосфата соседствует 12 ионов кальция и ОН-, из которых 6 лежат в одном слое с фосфатом, а по 3 в соседних слоях, расположенных выше и ниже. Идеальный кристалл гидроксиапатита имеет форму гексагональной призмы, размеры которой варьируют в разных твердых тканях. Расстояние между кристаллами гидроксиапатитов составляет 2,5 нм. Каждый кристалл окружен гидратной оболочкой толщиной 1 нм. Часть ионов кристаллической решетки кристалла гидроксиапатитов может быть замещена другими ионами близкими по свойствам (изоморфное замещение). В местностях с высоким содержанием стронция, накопление его в костях может привести к патологическим переломам. Снижение концентрации кальция и фосфата в жидкостях тела приводит к усилению реакций изоморфного замещения. Напротив, повышенное поступление Са2+ в организм способствует вытеснению из ионной решетки антагонистов кальция, обеспечивая восстановление правильной кристаллической решетки. В целом скорость и масштаб изоморфного замещения зависят, в основном, от ионного радиуса, концентрации и длительности воздействия замещающего иона. Очень большое значение имеют условия микроокружения, в том числе физико-химические параметры, включая рН среды. В частности, достаточно высокий уровень бикарбонатов способствует образованию карбонапатита путем замещения фосфат-иона карбонатом.
Са10(РО4)6(ОН)2 + 3 Н+ + 3 НСО3- ® Са10(РО4)4(СО3)3(ОН)2 + 2 Н3РО4 Среди всех апатитов твердых тканей карбонапатиты могут составлять до 20%, уступая в этом отношении гидроксиапатитам. На хлорапатиты приходится около 4%. Снижение рН среды способствует замещению Са2+ в гидроксиапатите протонами или ионами гидроксония.
Са10(РО4)6(ОН)2 + 2 Н+ ® Са9(Н+)2(РО4)6(ОН)2 + Са2+
Са10(РО4)6(ОН)2 + Н3О+ ® Са9(Н3О+) (РО4)6(ОН)2 + Са2+
Высокие концентрации Н+ вызывают кислотное разрушение кристаллов гидроксиапатита.
Са10(РО4)6(ОН)2 + 8 Н+ ® 10 Са2+ + 6 НРО42- + 2 Н2О
Помимо кристаллов гидроксиапатита и его аналогов минеральная фаза содержит и аморфные соли. В основном это кальция гидрокарбонат [Са(НСО3)2], кальция гидрофосфат [СаНРО4 × 2 Н2О], пентагидрат восьми кальциевого фосфата [Са8Н2(РО4)6 × 5 Н2О]. Аморфные фосфаты преобладают в раннем возрасте и выполняют роль легко мобилизуемого резерва ионов кальция и фосфата, используемого при построении кристаллических структур.
Ремоделирование кости
Ремоделирование кости заключается в полном растворении её отдельных участков с заменой заново образуемой тканью. Разрушение кости осуществляется остеокластами, а её восстановление остеобластами. Ремоделирование костей осуществляется в течение всей жизни индивида. В детском и юношеском возрасте новообразование кости происходит значительно интенсивнее, чем её резорбция. У взрослого процессы растворения кости и её образования находятся в равновесии, а в пожилом возрасте начинают преобладать процессы резорбции. В результате избыточной потери костной ткани развивается остеопороз. Очаги ремоделирования появляются в разных участках костной ткани независимо друг от друга и регулируются, по-видимому, аутокринно или паракринно. Процесс ремоделирования начинается с привлечения клеток предшественниц остеокластов. В этом процессе участвуют белки – остепонтин и остеокальцин. Мобилизованные клетки фиксируются на поверхности кости. Мембрана остеокласта, прилегающая к кости образует многочисленные складки, что многократно увеличивает площадь её контакта с костью. Через эту мембрану клетка выделяет протоны и гидролитические ферменты в зону резорбции. Источником протонов является угольная кислота, образующаяся в реакции катализируемой карбоангидразой. Протоны через мембрану перекачиваются Н+ - АТФазой. Ионные каналы и насосы базолатеральной мембраны компенсируют потерю клеткой протонов восстанавливая ионное равновесие. Накопление протонов в зоне резорбции приводит к растворению кристаллов гидроксиапатита, а также создает благоприятную среду для действия кислых гидролаз. Кислые гидролазы выделяются лизосомами и содержат протеолитические ферменты, ферменты разрушающие протеогликаны и кислую фосфатазу. Кислая фосфатаза отщепляет остаток фосфорной кислоты от белков матрикса, тем самым, способствуя их быстрой деградации. Фаза резорбции продолжается в течение 10 дней. Кислая среда и гидролитические ферменты разрушают внеклеточный матрикс, под остеокластом образуя под ним углубление (лакуну) закрытую остеокластом. Продукты деградации кости поступают в кровь. По мере увеличения зоны разрушения остеокласт перемещается в глубь кости, закрепляется там и снова начинает свою резорбтивную деятельность. Резорбция кости сменяется фазой остеогенеза. Она начинается с апоптоза остеокластов. Далее в зону резорбции по механизму хемотаксиса поступают клетки предшественники, которые дифференцируются до остеобластов и заново строят костный матрикс.
Биохимия нервной ткани
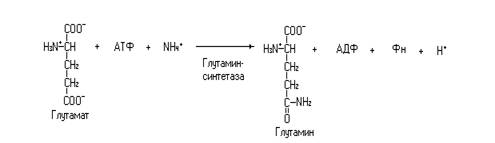
Нервная система в организме человека – это орган интеграции и коммуникации. Основной, структурной единицей нервной системы является нейрон. Он состоит из тела (сомы) и отростков. Короткие отростки – дендриты проводят сигналы к телу клетки, а длинный отросток – аксон проводит сигналы от тела клетки. Аксоны покрыты миелиновой оболочкой, образованной Шванновскими клетками, в периферической нервной системе и глиальными клетками в ЦНС. Миелиновая оболочка не сплошная, а состоит из миелинизированных участков и перехватов Ранвье, где миелиновая оболочка отсутствует. Аксон заканчивается одной или несколькими концевыми пластинками, представляющими по сути места передачи сигнала от одной клетки к другой, эти участки называются синапсами. В образовании синапсов участвуют и дендриты. Кроме нейронов в ЦНС присутствуют глиальные клетки, на долю которых приходится более 90%. Эти клетки не участвуют в проведении нервных импульсов и сохраняют способность к пролиферации. Некоторые из них подобно Шванновским клеткам участвуют в образовании миелиновой оболочки, другие образуют селективную мембрану вокруг капилляров (гематэнцефалический барьер). Предполагают, что глиальные клетки влияют на интеграцию групп нейронов, снабжают нейроны метаболитами и факторами питания. Функциональные особенности нейронов обеспечиваются особенностями их строения и метаболизма. Нервная система отличается высокой скоростью основного обмена. Головной мозг потребляет около 20% кислорода поступающего в организм. Энергетический обмен в мозге обеспечивается аэробным окислением глюкозы, в сутки на это тратится 100-120 г глюкозы. Зависимость головного мозга от аэробного гликолиза делает его чувствительным к гипогликемии и гипоксии. Жирные кислоты и кетоновые тела в норме не могут быть использованы мозгом, так как не проникают через гематэнцефалический барьер. Только при длительном голодании головной мозг начинает окислять кетоновые тела, обеспечивая их окислением 50% своих энергетических потребностей. Главным потребителем энергии в нейроне является Na+/K+ - АТФаза, на работу которой затрачивается около 40% энергии. Для нейронов характерно высокое содержание аминокислот и высокая скорость их обмена, особенно много глутамата (5-10 мМ) и аспартата (2-3 мМ). Аминокислоты в нейроне могут непосредственно выполнять функцию нейромедиаторов (глицин, аспартат, глутамат) или использоваться на их синтез. Из аминокислот синтезируются такие нейромедиаторы, как дофамин, норадреналин, адреналин, серотонин, гистамин. Аминокислоты также используются на синтез нейрональных белков и нейрогормонов. Нейроны очень чувствительны к аммиаку, последний образуется там, главным образом, при дезаминировании АМФ и в меньшей мере из аминокислот. Нейтрализация аммиака осуществляется в глутаминсинтетазной реакции. Аммиак взаимодействует с глутаминовой кислотой в следующей реакции.
Образующийся в этой реакции глутамин поступает в кровь, а с нею в печень и почки, где и происходит окончательное обезвреживание аммиака, через орнитиновый цикл (печень) или образования солей аммония (почки). Проведение нервных импульсов от одной нервной клетки к другой или от нервной клетки к эффекторной клетке одна из основных функций нейронов, выполнение этой функции обусловлено, не в последнюю очередь, особенностями состава и работы нейрональных мембран. Сравнение состава миелина и эритроцитарной мембраны показывает следующее. Миелин Эритроцитная мембрана Липид/белок 3:1 1:2 Фосфолипиды 42% 61% Цереброзиды 25% 11% Холестерин 28% 28%
Следует отметить, что содержание липидов в миелине гораздо выше, чем в эритроцитарной мембране. Для миелина характерно и более высокое содержание гликолипидов. Мембрана аксона и миелин также отличаются между собой по липидному составу.
БИОХИМИЯ КРОВИ. Кровь - особый вид подвижной, быстрообновляющейся соединительной ткани, циркулирующей в замкнутой системе кровеносных сосудов. Благодаря работе сердца находиться в состоянии непрерывного движения. Главным органом физиологической регенерация форменных элементов крови является костный мозг. Функции крови. Непрерывно циркулируя по кровеносным сосудам, кровь выполняет в организме различные функции. 1. Транспортная - одна из основных функций крови. Кровь осуществляет перенос различных веществ: кислорода, углекислого газа, электролитов, ферментов, питательных веществ, гормонов, медиаторов, протонов от периферических тканей к легким. Дыхательная (разновидность транспортной функции) – перенос кислорода от легких к тканям организма, углекислого газа - от тканей к лёгким. Важную роль в этом процессе играет гемоглобин - пигмент красного цвета, состоящий из небелковой части гема и белка глобина. Гемоглобин отличается высоким сродством к кислороду, за счет чего кровь способна переносить гораздо больше кислорода, чем обычный водный раствор. В легких, где кислорода много, он диффундирует из легочных альвеол через стенки кровеносных сосудов и водную среду плазмы и попадает в эритроциты, здесь он связывается с гемоглобином - образуется оксигемоглобин. В тканях, где концентрация кислорода невелика, молекулы кислорода отделяются от гемоглобина и проникают в ткани за счет диффузии. Пониженная концентрация эритроцитов или гемоглобина приводит к снижению транспорта кислорода и тем самым к нарушению биологических процессов в тканях. Молекула гемоглобина может связать 4 мол. кислорода, однако в тканях гемоглобин отдает только 50% кислорода. Трофическая (разновидность транспортной функции) кровь осуществляет перенос глюкозы, аминокислот, жирных кислот из ЖКТ и ряда внутренних органов и др. питательных веществ от органов пищеварения к тканям. Транспорт питательных веществ начинается от капилляров тонкого кишечника, где кровь захватывает их из пищеварительного тракта и переносит во все ткани и органы, начиная с печени. Причем клетки печени регулируют уровень питательных веществ в крови в зависимости от потребностей организма (тканевого метаболизма). С кровью переносятся также гормоны, контролирующие множество жизненно важных процессов. 2. Выделительная(разновидность транспортной функции) — кровь выносит из тканей конечные продукты обмена веществ (мочевины, мочевой кислоты, креатинина и других), избытка воды, органических и минеральных веществ к органам их выделения (почки, кишечник, потовые железы, легкие). 3.Терморегуляторная — поддерживает постоянство температуры тела. Нагреваясь в органах с высоким обменом веществ – мышцах, печени, кровь переносит тепло к другим органам и коже, через которую происходит теплоотдача. 4. Регуляторная (гуморальная) — кровь связывает между собой различные органы и системы. Осуществляет доставку гормонов, пептидов, ионов и других биологических веществ от мест их синтеза к клеткам организма, это позволяет осуществлять регуляцию многих физиологических функций. 5. Защитная— обеспечивается белыми клетками крови, иммуноглобулинами и системой комплемента. 6. Гемостатическая — определяется соотношением свертывающей и противосвертывающей систем. Эта функция предохраняет организм от потери крови путем остановки кровотечения в результате свёртывания крови. Кровь также участвует в регулировании водно-солевого обмена и кислотно-щелочного равновесия в организме.
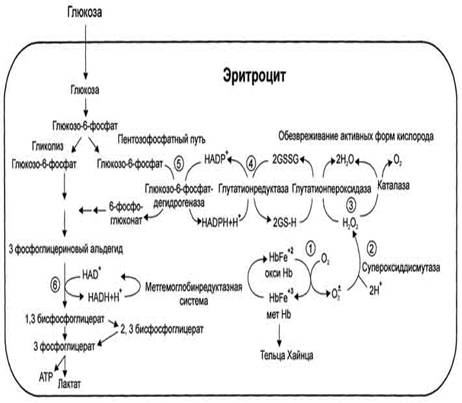
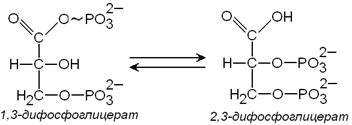
Метаболизм эритроцитов. Обмен глюкозы. Обменные процессы из-за отсутствия органелл в зрелых эритроцитах очень ограничены. 90% глюкозы в эритроцитах распадается в процессе анаэробного гликолиза и 10% окисляется в реакциях пентозофосфатного пути. Конечным продуктом анаэробного гликолиза является молочная кислота, которая выходит в плазму крови и используется другими клетками. Молекулы АТФ, которые образуются в результате анаэробного гликолиза необходимы для активного транспорта ионов через мембрану эритроцита, т.е. для поддержания внутриклеточного градиента концентрации ионов и для поддержания самого гликолиза, требующего затраты АТФ в гексокиназной и фосфофруктокиназной реакциях. Важная особенность анаэробного гликолиза в эритроцитах по сравнению с другими клетками — присутствие в них фермента бисфосфоглицератмутазы, которая катализирует образование 2,3-бисфосфоглицерата из 1,3-бисфосфоглицерата:
| 2,3-бисфосфоглицерат, образуется только в эритроцитах и служит важным аллостерическим регулятором связывания O2 с гемоглобином. В ходе пентозофосфатного цикла вырабатываются восстановленный никотинамидадениндинуклеотид (НАДН+Н+), который используется для восстановления метгемоглобина в гемоглобин, и восстановленный никотинамидадениндинуклеотидфосфат (НАДФН+Н+)- для восстановления глутатиона. Глутатион – это биологически активный трипептид (γ-глутамил-цистеинил-глицил), способный легко окисляться, защищает от окисления и инактивации ряд важных ферментов, содержащих серу, в частности, ферменты, связанные с молекулой гемоглобина и клеточной мембраной.
COOH – CH – CH2 – CH2 – CO – NH – CH – CH2 – SH | | NH2 CO | NH | CH2 Глутатион | COOH Вследствие снижения скорости синтеза АТФ падает активность Na+,K+- АТФ-азы, повышается осмотическое давление и возникает осмотический шок. Дефицит НАДН+Н+ приводит к накоплению метгемоглобина и увеличению образования активных форм кислорода, вызывающих окисление SН-групп в молекулах гемоглобина. Большое содержание кислорода в эритроцитах определяет высокую скорость образования супероксидного анион-радикала O2-, пероксида водорода Н2О2 и гидроксил-радикала ОН'. Постоянным источником активных форм кислорода в эритроцитах является неферментативное окисление железа гемоглобина:
Активные формы кислорода могут вызвать гемолиз эритроцитов. Эритроциты содержат ферментативную систему, предотвращающую токсическое действие радикалов кислорода и разрушение мембран эритроцитов. Восстановленная форма глутатиона (сокращённое обозначение Г-SH) участвует в реакциях обезвреживания пероксида водорода и органических пероксидов (R-O-OH). При этом образуются вода и окисленный глутатион (сокращённое обозначение Г-S-S-Г).
Превращение окисленного глутатиона в восстановленный катализирует фермент глутатионредуктаза.
Антиоксидантные системы имеют для эритроцитов особое значение, так как в эритроцитах не происходит обновления белков путём синтеза. Нарушение любого звена ферментативной системы обезвреживания активных форм кислорода приводит к снижению скорости этого процесса. При генетическом дефекте глюкозо-6-фосфатдегидрогеназы и приеме некоторых лекарств, являющихся сильными окислителями, потенциал глутатионовой защиты может оказаться недостаточным. В норме фермент супероксиддисмутаза катализирует образование пероксида водорода, который под действием глутатионпероксидазы превращается в Н2О. При недостаточной активности ферментов обезвреживания активных форм кислорода происходит окисление SH-групп в остатках цистеина протомеров метгемоглобина и образование дисульфидных связей. Такие структуры называются тельцами Хайнца. Они способствуют разрушению эритроцитов при попадании их в мелкие капилляры. Активные формы кислорода, вызывая перекисное окисление липидов мембран, разрушают мембраны.
Рис.2. Образование и обезвреживание активных форм кислорода в эритроците: 1 - спонтанное окисление Fe2+ в теме гемоглобина - источник супе
|
|||||||||
|
Последнее изменение этой страницы: 2021-01-14; просмотров: 496; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.156.140 (0.089 с.) |
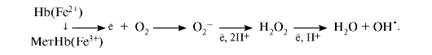

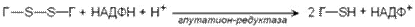 В эритроцитах имеются также ферменты супероксиддисмутаза и каталаза, осуществляющие следующие превращения:
В эритроцитах имеются также ферменты супероксиддисмутаза и каталаза, осуществляющие следующие превращения: