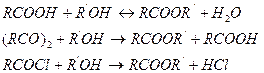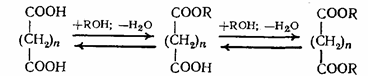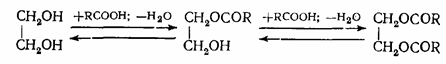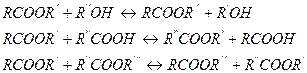Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема: получение сложных эфировСодержание книги
Поиск на нашем сайте
Теоретические основы Процессы этерификации, гидролиза, гидратации и дегидратации в промышленности основного органического и нефтехимического синтеза находят широкое применение для производства одноатомных и многоатомных спиртов, простых и сложных эфиров, одноосновных и многоосновных карбоновых кислот, ангидридов кислот, ненасыщенных соединений, фенолов, σ-оксидов и многих других ценных веществ. Кроме того, эти процессы часто являются промежуточными этапами в многостадийных синтезах других важных соединений. Сложные эфиры применяют в качестве растворителей, пластификаторов, в производстве синтетических смазочных масел, гидравлических жидкостей, поверхностно-активных веществ, в парфюмерии и т. д. Сложные эфиры образуются в результате взаимодействия спиртов с карбоновыми кислотами, ангидридами и хлорангидридами карбоновых кислот:
Если в этерификации участвует двухосновная кислота, то в зависимости от мольного соотношения спирта и кислоты может образоваться продукт как неполной, так и полной этерификации:
Полные и неполные эфиры образуются и тогда, когда взаимодействуют многоатомные спирты и одноосновные кислоты. Выход полных и неполных эфиров и в этом случае зависит от исходного мольного соотношения реагентов:
Если же кислоты и спирты содержат две и более функциональных групп, процесс протекает с образованием полиэфиров линейной или пространственной структуры. Подавляющее большинство реакций этерификации являются равновесными, причем обратная реакция представляет собой гидролиз сложных эфиров. К классу этерификации относят и реакции алкоголиза, ацидолиза, переэтерификации, которые также равновесны:
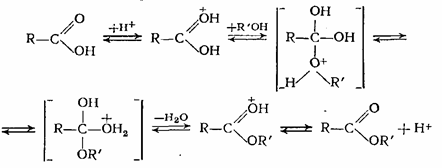
Все перечисленные реакции хорошо катализируются сильными кислотами (например, H2SO4, HC1) и только в случае алкоголиза сложных эфиров более эффективными катализаторами являются3 вещества основного характера (алкоголяты, щелочи и др.). Спирты с карбоновыми кислотами взаимодействуют практически без выделения или поглощения тепла, и поэтому константа равновесия этих реакций мало зависит от температуры. На константу равновесия влияет как строение спирта, так и строение кислоты. Существует несколько способов для смещения равновесия в сторону образования эфира. В жидкофазных процессах этерификации высокой степени конверсии исходных реагентов достигают при отгонке из реакционной массы воды или эфира, а если это невозможно, то повышают концентрацию одного из исходных компонентов. Последний способ применяют и в процессах газофазной этерификации. Механизм реакции этерификации в присутствии протонодонорных кислот можно представить следующей схемой:
В этой системе равновесных превращений самой медленной является реакция спирта с протонированной кислотой, а в обратном направлении (при гидролизе или алкоголизе) реакция воды с протонированным эфиром. Этерификация н -бутилового (пентилового) спирта уксусной кислотой
Цель работы Изучение реакции этерификации н -бутилового (пентилового) спирта уксусной кислотой в присутствии серной кислоты (или катионита КУ-2) на установке периодического действия с азеотропной отгонкой воды, выделение полученного эфира, определение его констант и составление материального баланса опыта.
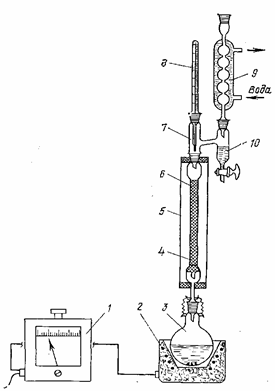
Методика выполнения работы Реактивы Уксусная кислота ледяная 30 г н -Бутиловый спирт 45 г моль Серная кислота концентрированная 0,5 мл (или катионит КУ-2 5 г) Бензол (сухой) 150 мл Карбонат натрия, 5%-ный водный раствор 100 мл Сульфат натрия безводный 10 г Бутилацетат (пентилацетат) получают на установке, схема которой приведена на рисунке 6. Установка состоит из автотрансформатора 1, электронагревателя 2, реактора 3, колонки 4, кожуха 5, головки 7, термометра 8, обратного холодильника 9 и сепаратора 10. Перед началом опыта проверяют правильность сборки и герметичность всех соединений установки. Реактор изготовлен из термостойкого стекла и представляет собой круглодонную одногорлую колбу емкостью 300 мл. Из термостойкого стекла изготовлены также колонка, головка, обратный холодильник и кожух. Головка снабжена сепаратором 10 для отделения бензола от воды. Колонка заполнена стеклянной насадкой 6 на высоту 150 мм. Наливают в реактор 30 г ледяной уксусной кислоты, 45 г н -бутилового спирта и капиллярной пипеткой на 1 мл добавляют0,5 мл концентрированной серной кислоты (или насыпают катионит КУ-2, подготовленный по методике — см. стр. 166). Для спокойного кипения реакционной массы в реактор опускают несколько небольших кусочков керамики. Реактор присоединяют к нижней части колонки с небольшим зазором в шлифовом соединении. Устанавливают в верхнюю часть обратного холодильника воронку и наливают в установку 150 мл бензола. Часть бензола остается в сепараторе головки, а основная его масса стекает через дефлегмирующую колонку в реактор.
Рисунок 6 - Установка для этерификации с азеотропной отгонкой воды; 1 — автотрансформатор; 2 — электронагреватель; 3 — реактор; 4 — колонка; 5 — кожух; 6 - стеклянная насадка; 7 — головка; 8 — термометр; 9 — обратный холодильник; 10 — сепаратор. Воронку удаляют, реактор плотно присоединяют к дефлегмирующей колонке и закрепляют шлифовое соединение металлическими пружинными скрепками. Подают воду в обратный холодильник и включают обогрев реактора. Температуру нагрева регулируют автотрансформатором таким образом, чтобы реакционная масса кипела умеренно, а скорость истечения конденсата из обратного холодильника в сепаратор составляла 1—2 капли в секунду. Пары азеотропной смеси проходят через дефлегмирующую колонку, конденсируются в обратном холодильнике и стекают в сепаратор, в котором вода отделяется от бензола. Бензол снова перетекает в реактор, а вода собирается в нижней части сепаратора. Конец реакции определяют по прекращению выделения воды из конденсата, стекающего из обратного холодильника в сепаратор, и по объему воды, скопившейся в сепараторе: он должен быть не менее 9 мл. По окончании опыта выключают обогрев реактора, реакционную массу охлаждают до комнатной температуры, переливают в делительную воронку емкостью 300 мл и промывают последовательно 100 мл 5%-ного водного раствора карбоната натрия и 100 мл воды. После каждой промывки реакционной массе дают хорошо отстояться. Органический слой отделяют от воды, сливают в сухую коническую колбу, сушат над безводным сульфатом натрия, фильтруют в предварительно взвешенный на технических весах куб ректификационной колонки, определяют массу и перегоняют. В процессе ректификации ведут запись перегонки в таблицу и выделяют головную фракцию (бензол с остатками воды), промежуточную фракцию и фракцию бутилацетата. Определяют массы всех выделенных фракций и кубового остатка. Для фракции бутилацетата дополнительно определяют показатель преломления и эфирное число. Составляют материальный баланс опыта.
Контрольные вопросы 1. Сущность процесса этерификации. 2. Применяемые при данном процессе катализаторы. Литература 4. Одабашян Г.В. Лабораторный практикум по химии ТООНХС. М., Химия, 1982, с. 171-176. 5. Воскресенский П.И. Техника лабораторных работ. 10-е изд. М.. Химия, 1973, 717 с. 6. Паушкин Я.М., Вишнякова Т.П., белов П.С. Практикум по нефтехимическому синтезу. М.. Химия, 1965. 208 с. 7. Лабораторные работы по химии и технологии полимерных материалов. Пер. с польск. / Кухарский М., Линдеман Я., Мальчевский Я. И др. М., Химия, 1965, 396 с. Лабораторная работа №7
|
||||
|
Последнее изменение этой страницы: 2020-12-09; просмотров: 190; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.148.145.219 (0.006 с.) |