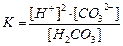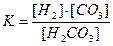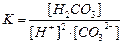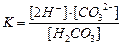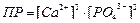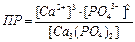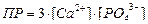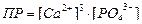Мы поможем в написании ваших работ!
ЗНАЕТЕ ЛИ ВЫ?
|
Занятие № 5 Тема: «Растворы. Законы растворимости. Растворы электролитов. Теории кислот и оснований. Коллигативные свойства растворов. Диффузия. Осмос».
1. Актуальность темы:
Учение о растворах представляет для будущих врачей особый интерес, т.к. большинство важнейших биохимических процессов в живых клетках осуществляется в растворах, т.к. многие биологические жидкости являются водными растворами, содержащими различные неорганические ионы и органические вещества. Так, растворами являются плазма крови, спинномозговая жидкость, лимфа, моча, слюна и др. Значительное количество лекарственных веществ используется в виде жидких лекарственных форм (т.е. растворов). Лекарственные вещества эффективны лишь в растворенном состоянии или должны перейти в растворенное состояние в организме.
Большое значение во многих химических и биологических системах имеет явление осмоса. Благодаря осмосу регулируется поступление воды в клетке и клеточные структуры. Упругость клеток, обеспечивающая эластичность тканей и сохранение определённой формы органов, обусловлена осмотическим давлением. Осмотическое давление крови человека при 37°С составляет 760 кПа. Такое же давление создаёт и раствор хлорида натрия с W = 0,9% - изотонический.
2. Цель обучения:
Изучить теоретические основы учения о неэлектролитах и электролитах;рассмотреть коллигативные свойства растворов: диффузию, осмос, осмотическое давление, понижение температуры замерзания, повышение температуры кипения;решать задачи по коллигативным свойствам растворов неэлектролитов и электролитов.
3. Вопросы для обсуждения:
1. Растворы. Вода как растворитель. Аномальные свойства воды.
2. Растворимость. Факторы, влияющие на растворимость. Термодинамические процессы при растворении.
3. Механизм растворения ионных и молекулярных веществ. Сольватация. Гидратация.
4. Растворимость газов в жидкостях. Законы Генри, Сеченова, Дальтона, их биологическое значение.
5. Понятие об электролитах. Электролитный баланс в организме человека. Основные положения теории электролитической диссоциации.
6. Теории кислот и оснований (Аррениуса, Брёнстеда-Лоури, Льюиса).
7. Коллигативные свойства разбавленных растворов. Диффузия.
8. Осмос, осмотическое давление. Закон Вант-Гоффа для разбавленных растворов электролитов и неэлектролитов. Изотонический коэффициент.
9. Поведение живой клетки в гипо-, гипер-, изотонических растворах (плазмолиз, гемолиз). Осмотическое давление крови, онкотическое давление.
10. Криометрия, эбулиометрия, их применение в медико-биологических исследованиях.
4. Ситуационные задачи:
| №
задачи
| Текст задания:
| | 1.
| Рассчитать осмотическое давление раствора сахарозы при 37С, в котором ёё масса составляет 25,2 г при объёме раствора 200 мл. Определить, является ли этот раствор изотоническим по отношению к крови?
| | 2.
| Осмотическое давление крови находится в пределах 740-780 кПа. Рассчитать молярную концентрацию раствора хлорида натрия с массовой долей 0,9%, плотностью 1,01г/см3, предназначенного для введения в организм человека.
| | 3.
| При 20 С осмотическое давление раствора в 100 мл которого содержится 6,33 г красящего вещества – гематина равно 243,4 кПа. Определить молярную массу вещества.
| | 4.
| Рассчитать при какой температуре должен кристаллизоваться раствор, содержащий в 250 г воды 54 г глюкозы (C6H12O6)?
| | 5.
| При какой приблизительно температуре будет кристаллизоваться 40% (по массе) раствор этилового спирта в воде?
| | 6.
| При какой приблизительно температуре будет кипеть 50% (по массе) раствор сахарозы (С12H22O11)?
| | №
задачи
| Эталоны ответов:
| | 1.
| По закону Вант-Гоффа для неэлектролитов.
 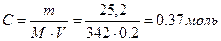 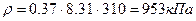 Ответ: Раствор гипертонический.
Ответ: Раствор гипертонический.
| | 2.
| По закону Вант-Гоффа для электролитов.
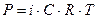 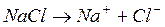 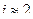
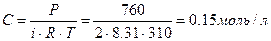
| | 3.
| 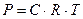
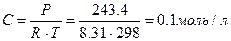 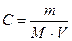 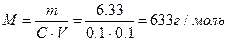
| | 4.
| По закону Рауля 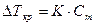 , где K – криоскопическая константа K(H2O)=1.86, Cm – моляльная концентрация (число молей растворённого вещества в 1000 г растворителя).
В пересчёте на 1000г воды масса глюкозы составляет 216г , где K – криоскопическая константа K(H2O)=1.86, Cm – моляльная концентрация (число молей растворённого вещества в 1000 г растворителя).
В пересчёте на 1000г воды масса глюкозы составляет 216г
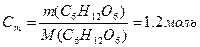 или по формуле или по формуле 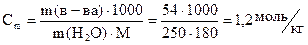
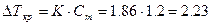
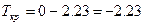 Раствор глюкозы замёрзнет при температуре –2.23 С
Раствор глюкозы замёрзнет при температуре –2.23 С
| | 5.
| 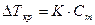 . В пересчёте на 1000г воды масса этилового спирта составляет 666,6г . В пересчёте на 1000г воды масса этилового спирта составляет 666,6г
 Моляльная концентрация раствора равна
Моляльная концентрация раствора равна 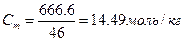
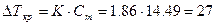 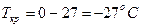
| | 6.
| В пересчёте на 1000г воды масса сахарозы составляет 1000г
Эбуллиоскопическая постоянная для воды E(H2O)=0.52,
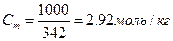 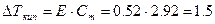  Раствор сахарозы закипит при t=101.5 С
Раствор сахарозы закипит при t=101.5 С
|
5. Выполнить тестовые задания (письменно):
| 1.
|
| При комнатной температуре ограниченно смешиваются:
| |
| А
| вода и этанол
| |
| В
| вода и уксусная кислота
| |
| С
| вода и бензол
| |
| D
| бензол и толуол
| |
|
|
| | 2.
|
| Растворимость кислорода при одинаковой температуре и парциальном давлении наибольшая в…
| |
| А
| дистиллированной воде
| |
| В
| морской воде
| |
| С
| плазме крови
| |
| D
| речной воде
| |
|
|
| | 3.
|
| Процесс электролитической диссоциации нитрата бария описывается уравненем:
| |
| А
| Ba(NO3)2 ↔ Ba4+ + 2 NO32-
| |
| В
| Ba(NO2)2 ↔ Ba2+ + 2 NO2-
| |
| С
| Ba(NO3)2 ↔ Ba2+ + 2 NO3-
| |
| D
| Ba(NO3)2 ↔ Ba2+ + NO32-
| |
|
|
| | 4.
|
| К сильным электролитам относится:
| |
| А
| хлорид серебра
| |
| В
| сульфит калия
| |
| С
| гидроксид аммония
| |
| D
| хлорид натрия
| |
|
|
| | 5.
|
| Выбрать неэлектролиты:
| |
| А
| С12H22O11
| |
| В
| CH3COOH
| |
| С
| NaCl
| |
| D
| AgCl
| |
|
|
| | 6.
|
| Какая будет молярная концентрация ионов калия К+ в 0,1 М растворе K2SO4?
| |
| А
| 2 М
| |
| В
| 0,2 М
| |
| С
| 0,1 М
| |
| D
| 1 M
| |
|
|
| | 7.
|
| Константа диссоциации угольной кислоты H2CO3 может быть записана как:
| |
| А
| 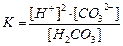
| |
| В
| 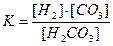
| |
| С
| 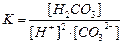
| |
| D
| 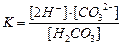
| |
|
|
| | 8.
|
| Произведение растворимости для Ca3(PO4)2 может быть записано как:
| |
| А
| 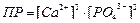
| |
| В
| 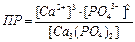
| |
| С
| 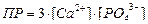
| |
| D
| 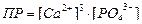
| |
|
|
| | 9.
|
| В процессе осмоса:
| |
| А
| молекулы растворенного вещества переходят через мембрану из раствора с большей концентрацией в раствор с меньшей концентрацией.
| |
| В
| молекулы растворенного вещества переходят через мембрану из раствора с меньшей концентрацией в раствор с большей концентрацией.
| |
| С
| молекулы растворителя и растворенного вещества переходят через мембрану в различных направлениях, что не приводит к изменению концентрации растворов по разные стороны мембраны.
| |
| D
| молекулы растворителя переходят через мембрану из раствора с меньшей концентрацией в раствор с большей концентрацией.
| |
|
|
| | 10.
|
| Одинаковое ли осмотическое давление будут иметь растворы сахарозы, калия хлорида, натрия сульфата одинаковой молярной концентрации при одинаковой температуре?
| |
| А
| Одинаковое
| |
| В
| Различное
| |
| С
| Зависит от атмосферного давления
| |
|
|
| | 11.
|
| Для уничтожения бактерий, вызывающих ботулизм, в качестве консерванта используется раствор с высоким содержанием сахара. С чем это связано?
| |
| А
| С нарушением подвижности бактерий.
| |
| В
| С явлением плазмолиза.
| |
| С
| С явлением гемолиза.
| |
|
|
| | 12.
|
| Какие электролиты будут иметь одинаковое осмотическое давление при одинаковой температуре и молярной концентрации.
| |
| А
| Na2SO4 и NaCl
| |
| В
| NaCl и KCl
| |
| С
| CaCl2 и KCl
| |
|
|
| | 13.
|
| Какое осмотическое давление имеют растворы, которые применяются в медицине как изотонические или кровезаменители?
| |
| А
| 700 – 800 кПа
| |
| В
| 200 – 300 кПа
| |
| С
| 300 – 400 кПа
| |
| D
| 500 – 600 кПа
| |
|
|
| | 14.
|
| Среди водных растворов одинаковых моляльных концентраций наименьшую температуру кипения будет иметь водный раствор:
| |
| А
| С12Н22О11
| |
| В
| MgSO4
| |
| С
| Na3PO4
| |
| D
| KСl
| |
|
|
| | 15.
|
| Эбуллиоскопия – один из методов определения молярной массы лекарственных веществ. Эбуллиоскопическая постоянная – это:
| |
| А
| повышение температуры кипения однопроцентного раствора
| |
| В
| понижение температуры замерзания одномолярного раствора
| |
| С
| показатель, который характеризует природу растворителя
| |
| D
| показатель, который характеризует природу растворенного вещества
| |
|
|
| | 16.
|
| Температура кристаллизации раствора
| |
| А
| всегда выше, чем температура кристаллизации растворителя
| |
| В
| всегда ниже, чем температура кристаллизации растворителя
| |
| С
| всегда равна температуре кристаллизации растворителя
| |
| D
| зависит от полярности растворителя
| |
|
|
| | 17.
|
| При обезвоживании организма происходит:
| |
| А
| набухание и разрыв клеток (осмотический шок)
| |
| В
| коллапс клеток (плазмолиз)
| |
| С
| резкое повышение рН внутриклеточной жидкости
| |
| D
| клетки находятся в тургоре
| |
|
|
| | 18.
|
| Какое явление произойдет, если клетку поместить в 5%-ный раствор глюкозы?
| |
| А
| Плазмолиз
| |
| В
| Гемолиз
| |
| С
| Лизис
| |
| D
| Не произойдет
| |
|
|
| | 19.
|
| При лечении гнойных ран в виде компрессов и примочек применяют:
| |
| А
| 0,05-0,1 % раствор хлорида натрия
| |
| В
| 0,5-0,8 % раствор хлорида натрия
| |
| С
| 0,9 % раствор хлорида натрия
| |
| D
| 3-10% раствор хлорида натрия
| |
|
|
| | 20.
|
| Величина изотонического коэффициента при расчете осмотического давления раствора:
| |
| А
| сахароза
| 1)
| 4
| |
| В
| нитрат алюминия
| 2)
| 3
| |
| С
| фенол
| 3)
| 2
| |
| D
| сульфат лития
| 4)
| 1
|
6. Решить самостоятельно:
| 1.
| Для внутривенных инъекций используют ампулы, содержащие 10 мл водного раствора хлорида кальция с массовой долей 10%. Рассчитать молярную концентрацию этого раствора. Определить массы воды и хлорида кальция, необходимые для изготовления 500 ампул. Плотность указанного раствора при комнатной температуре – 1,09 г\мл.
|
| | 2.
| При какой минимальной температуре можно хранить водный раствор с массовой долей новокаина 0,25%, применяемый в хирургии для анестезии, чтобы он не замерзал? Молярная масса новокаина равна 272,8 г\моль.
|
| | 3.
| Вычислить осмотическое давление 5% раствора глюкозы. Можно ли данный раствор использовать для внутривенного введения. Ответ пояснить.
|
| | 4.
| В 500 мл раствора содержится 9,2 г глицерина. Определить осмотическое давление данного раствора при 00С. Что произойдет с клеткой, имеющей осмотическое давление 7 атм, при попадании в этот раствор?
|
| | 5.
| Раствор, содержащий 10 г вещества-неэлектролита в 150 г бензола, замерзает при 2,04°С (температура кристаллизации бензола 5,450С). Определить молекулярную массу растворенного вещества.
|
|
7. Вспомогательные материалы по самоподготовке.
Таб. 1. Криоскопические и эбуллиоскопические постоянные.
| Растворитель
| К
| Е
| | CH3COOH
Бензол
CS
CCl4
Нафталин
Фенол
Вода
Этанол
| 3,90
5,12
-
3,88
6,94
7,39
1,86
-
| 3,07
2,57
2,37
4,95
5,8
3,6
0,516
1,20
|
|




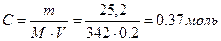
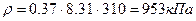 Ответ: Раствор гипертонический.
Ответ: Раствор гипертонический.
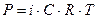
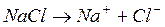
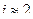
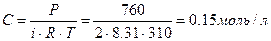
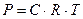
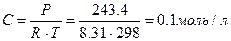
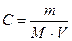
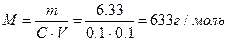
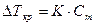 , где K – криоскопическая константа K(H2O)=1.86, Cm – моляльная концентрация (число молей растворённого вещества в 1000 г растворителя).
В пересчёте на 1000г воды масса глюкозы составляет 216г
, где K – криоскопическая константа K(H2O)=1.86, Cm – моляльная концентрация (число молей растворённого вещества в 1000 г растворителя).
В пересчёте на 1000г воды масса глюкозы составляет 216г
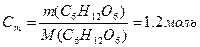 или по формуле
или по формуле 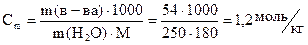
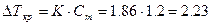
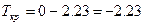 Раствор глюкозы замёрзнет при температуре –2.23 С
Раствор глюкозы замёрзнет при температуре –2.23 С
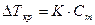 . В пересчёте на 1000г воды масса этилового спирта составляет 666,6г
. В пересчёте на 1000г воды масса этилового спирта составляет 666,6г
 Моляльная концентрация раствора равна
Моляльная концентрация раствора равна 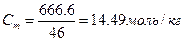
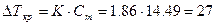
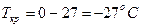
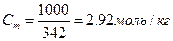
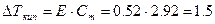
 Раствор сахарозы закипит при t=101.5 С
Раствор сахарозы закипит при t=101.5 С