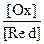Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Занятие № 4 Тема: «Окислительно–восстановительные взаимодействия. Гальванические элементы. Определение окислительно-восстановительных потенциалов».
1. Актуальность темы: Живой организм является не только системой, в которой возникает биоэлектричество, но и пассивным проводником электрического тока, возникающего в организме или приложенного извне. В организме происходит ряд окислительно-восстановительных реакций, которые при соответствующих условиях могут служить источником э.д.с. Многие вещества, находясь в виде ионов, перераспределяются и транспортируются в виде зарядов, что служит причиной возникновения биоэлектрических потенциалов. Окислительно-восстановительные реакции позволяют координировать на уровне организма функции органов, тканей, клеток и субклеточных структур. Возможно их применение для диагностики и лечения заболеваний. Окислительно-восстановительные реакции лежат в основе методов оксидиметрии (перманганатометрия, йодометрия), которые применяют в клиническом анализе для определения, например, содержания мочевой кислоты в моче, кальция в сыворотке крови и т.д.
2. Цель обучения: Знать классификацию электродов и их устройство, устройство и принцип действия гальванических элементов, механизмы возникновения электродных, окислительно-восстановительных, диффузионных и мембранных потенциалов. Уметь составлять схемы гальванических элементов, прогнозировать направление протекания окислительно-восстановительных реакций, рассчитывать окислительно-восстановительные потенциалы, рассчитывать ЭДС гальванического элемента.
3. Вопросы для обсуждения: 1. Понятие об окислительно-восстановительных процессах. Окислители и восстановители. 2. Электродные потенциалы, механизмы их возникновения. Формула Нернста для расчета величины электродного потенциала. 3. Виды электродов. Нормальный (стандартный) электродный потенциал. 4. Гальванические элементы, их классификация. Устройство и принцип работы биметаллических и концентрационных элементов. 5. Понятие об ЭДC гальванических элементов. Уравнение Нернста. 6. Виды биологических потенциалов, механизмы их возникновения: a) диффузный; б) мембранный (потенциал покоя и повреждения); в) потенциал течения; г) окислительно-восстановительный (редокс-потенциал). 7. Взаимосвязь между ЭДС, Kр, ∆G. Направленность окислительно-восстановительных реакций.
8. Значение окислительно-восстановительных потенциалов в механизмах процессов биологического окисления. 9. Методы оксидиметрии: перманганатометрия и йодометрия, их применение в лабораторно-клиническом анализе. 4. Ситуационные задачи:
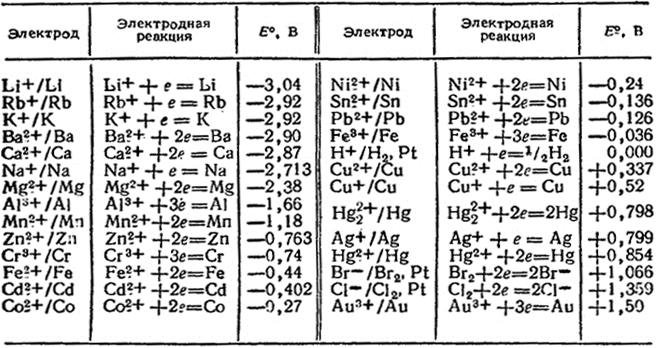
5. Вспомогательные материалы по самоподготовке: Таб. 1. Стандартные электродные потенциалы в водных растворах при 25°С
6. Выполнить тестовые задания (письменно):
6. Задачи для самостоятельного решения (выполнить письменно):
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2020-12-09; просмотров: 226; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.88.130 (0.009 с.) |
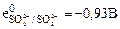 ,
, 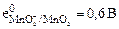
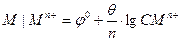
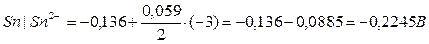
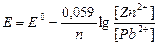 , где Ео = ео катода – ео анода
Eо = eо (Pb+2/Pb) – eо (Zn+2/Zn) = - 0,13 – (-0,76) = +0,63 B
, где Ео = ео катода – ео анода
Eо = eо (Pb+2/Pb) – eо (Zn+2/Zn) = - 0,13 – (-0,76) = +0,63 B
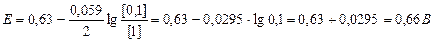 2 способ решения:
Рассчитываем значение электродного потенциала для каждого элемента отдельно: Катод:
2 способ решения:
Рассчитываем значение электродного потенциала для каждого элемента отдельно: Катод:
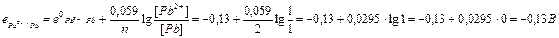 Анод:
Анод: 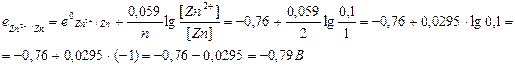 Е0 = е0катода – е0анода = -0,13 – (-0,79) = 0,66 В.
Е0 = е0катода – е0анода = -0,13 – (-0,79) = 0,66 В.
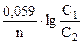 , где Ео = ео катода – ео анода = 0,34 – 0,34 = 0 В
E =
, где Ео = ео катода – ео анода = 0,34 – 0,34 = 0 В
E = 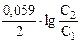 = 0,0295 ´ lg
= 0,0295 ´ lg 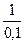 , E = 0,0295 ´ lg10 = 0,0295 B
, E = 0,0295 ´ lg10 = 0,0295 B

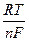 lg a Men+
lg a Men+
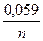 lg a Men+
lg a Men+
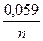 lg
lg