Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Роль витаминов и микроэлементов в кроветворении
Витамин В12 и фолиевая кислота (витамин В9) необходимы для синтеза нуклеопротеинов в разных тканях организма, созревания и деления ядер эритроидных клеток в кроветворной ткани. При дефиците витаминов В12 и В9 в наиболее интенсивно делящейся ткани организма — эритроидной — раньше, чем в других, возникают нарушения, вызывающие анемию. При дефиците витамина В12 в костном мозге появляются большие ядросодержащие эритроидные клетки — мегалобласты, которые образуют с замедленной скоростью большие эритроциты — мегалоциты с резко укороченным периодом жизни. Замедление поступления эритроцитов в кровь и быстрое их разрушение ведет к анемии. Дефицит витамина BJ2 возникает в организме при утрате париетальными клетками желудка способности продуцировать «внутренний фактор» — гликопротеин (молекулярная масса 60 000). Фактор связывает витамин В12, поступающий с пищей, и предохраняет его от расщепления пищеварительными ферментами. Эти нарушения возникают при атрофии слизистой оболочки желудка, эпителия двенадцатиперстной кишки, часто наблюдающейся, например, у стариков. И хотя запаса витамина В12 в печени достаточно взрослому человеку на 1—5 лет, постепенное его истощение приводит к заболеванию. Суточная потребность в витамине В!2 — 5 мкг, содержание в плазме крови — 150—450 мкг/л. В кишечнике комплекс гликопротеин—витамин В12 фиксируется специальными рецепторами слизистой оболочки тонкого кишечника, далее витамин поступает в интестинальные клетки, затем в кровь и переносится с помощью особых молекул — транскобаламинов (I, II, III типов). Транскобаламины I и III типа продуцируются лейкоцитами, II — макрофагами. Поэтому при выраженном лейкоцитозе отмечается гипервитаминоз В12. Витамин В12 содержится в больших количествах в печени, почках, куриных яйцах. Фолиевая кислота (витамин В9) поддерживает синтез ДНК в клетках костного мозга, благодаря обеспечению этого процесса одним из нуклеотидов — диокситимидилатом, образующимся в результате митилирования диоксиуридиловой кислоты в присутствии тетрагидрофолата (одной из редуцированных форм фолиевой кислоты). При дефиците витамина В9 в пище у человека уже через 1—6 мес нарушается синтез ДНК и деление эритроидных клеток, ускоряется разрушение эритроцитов, что ведет к анемии. Суточная потребность организма человека в фолиевой кислоте 500—700 мкг. Ее резерв в организме равен 5—10 мг, !/3 которого находится в печени. Фолиевой кислотой богаты овощи (шпинат), дрожжи, молоко.
1,2,5-дигидроксивитамин D3 и ретиноловая кислота (производное витамина А) участвуют в организме человека в дифференциации кроветворных клеток до их зрелых форм. Витаминами А и D богаты печень трески, тунца, сельдь, коровье молоко и сливочное масло. Витамин В6 (пиридоксин) является кофактором (т. е. дополнительным фактором активности) фермента — синтетазы 5-аминолевулиновой кислоты (АЛК-синтетазы), участвующей в образовании гема в эритроидных клетках в ткани костного мозга (см. рис. 7.2). Дефицит витамина В6 в организме человека нарушает синтез гемоглобина и вызывает анемию. Витамином В6 богаты зерна злаков, капуста, картофель, молоко. Витамин С поддерживает основные этапы эритропоэза, способствуя метаболизму фолиевой кислоты в эритробластах. Он участвует в метаболизме железа, повышая как его абсорбцию в желудочно-кишечном тракте, так и мобилизацию депонированного в клетках железа. Витамин Е (а-токоферол) и витамин РР защищают фосфатидилэтанол- амин мембраны эритроцитов от усиливающего их гемолиз перекисного окисления. Защиту гемоглобина и мембраны эритроцитов от окисления осуществляет и витамин РР, являющийся одной из составляющих пиридиннуклео- тидов НАД и НАДФ. Дефицит витамина В2, участвующего в окислительно-восстановительных реакциях, вызывает у человека анемию вследствие замедленного образования эритроцитов в костном мозге. Микроэлементы: медь способствует всасыванию ионов железа в кишечнике и мобилизации его резерва из печени и макрофагов; никель и кобальт способствуют утилизации железа, поддерживая синтез гемоглобина в эритроидных клетках и гемсодержащих молекул в тканях. Кобальт входит в состав витамина В12. При дефиците кобальта в организме человека возникает мегалобластическая анемия. Никель индуцирует синтез фосфатидилсери- на, стабилизирующего мембрану эритроцитов. При дефиците никеля усиливается выведение ионов железа из организме человека. Селен, тесно воздействуя с витамином Е, защищает мембрану эритроцита от повреждения свободными радикалами. Почти 75 % всего цинка в организме человека находится в эритроцитах в составе фермента карбоангидразы, цинк входит в состав транскрипционных факторов, регулирующих активность генома гемопоэтических клеток.
Основы трансфузиологии Трансфузиология (от лат. transfusio — переливание) — отрасль медицинской науки, изучающая способы и средства управления функциями организма путем воздействия на него переливания цельной крови, ее компонентов (эритроцитов, лейкоцитов, тромбоцитов, стволовых кроветворных клеток, плазмы крови) и кровезаменителей. Переливание крови или ее компонентов от человека человеку основывается на знании антигенных (иммунных) свойств клеток и белков крови. 7.7.1. Группы крови Эритроцитарные антигены. Часть из более чем 300 антигенов мембраны эритроцитов человека объединена в 23 генетически контролируемые системы групп крови (ABO, Rh-Hr, Дафи, М, N, S, Леви, Диего). Система антигенов эритроцитов АВО содержит в сыворотке крови естественные анти-А и анти-В антитела. Генетический локус, контролирующий образование антигенов этой системы, расположен в длинном плече 9-й хромосомы и представлен генами Н, А, В и 0. Гены А, В, Н контролируют синтез ферментов, которые формируют особые моносахариды или антигены мембраны эритроцита — А, В и Н. Образование антигенов начинается с гена Н, который через контролируемый им энзим гликолизилтранферазу формирует из особого вещества-предшественника — церамидпентасахарида — антиген Н эритроцитов. Далее гены А и В через активность контролируемых ими энзимов формируют из Н-антигена, являющегося для них исходным материалом, антигены А или В. Ген «0» не контролирует трансферазу, и Н- антиген остается неизменным, формируя группу крови 0(1). Таким образом, на мембране эритроцитов человека присутствуют антигены А, В и Н. У 20 % людей антиген А имеет антигенные отличия (^ и А2). Антитела против антигенов А, Аи А2 и В начинают формироваться после рождения человека иммунной системой в ответ на стимуляцию ее антигенами пищи Таблица 7.3. Группы крови системы АВО
Таблица 7.4. Определение группы крови системы АВО
«—» — агглютинация отсутствует, «+» — агглютинация эритроцитов.
и бактерий, поступающих, например, в организм с вдыхаемым воздухом. Максимум продукции анти-А и анти-В антител приходится на 8—10-летний возраст. При этом в плазме крови накапливается анти-А больше, чем анти-В. Антитела анти-А и анти-В называются изоантителами, или агглютининами, а соответствующие антигены мембраны — агглютиногенами. Характеристика групп крови системы АВО представлена в табл. 7.3.
Естественные анти-А- и анти-В-антитела принадлежат к иммуноглобулинам класса М. Выработанные в процессе иммунизации А или В антигеном анти-А- и анти-В-антитела являются иммунными и относятся к иммуноглобулинам класса G. Иммуноглобулины склеивают эритроциты (явление агглютинации) и вызывают их гемолиз. При несовместимости группы крови донора (т. е. человека, у которого берут кровь для переливания) и реципиента (т. е. человека, которому переливают кровь) переливание крови вызывает гемоконфликт, связанный с агглютинацией и гемолизом эритроцитов, заканчивающийся гибелью реципиента. Для исключения гемоконфликтов человеку переливают лишь одногруппную кровь. Для определения группы крови по системе АВО смешивают антитела анти- А и анти- В с исследуемыми эритроцитами и по наличию или отсутствию агглютинации эритроцитов определяют группу крови (табл. 7.4). Rh-Hr антигены эритроцитов. Rh-антигены представлены на мембране эритроцитов тремя связанными участками: антигенами С (rh') или с (hr"), Е (rh") или е (hr") и D (Rho) или d. Из этих антигенов сильным является D, он способен иммунизировать человека, у которого антиген D отсутствует. Люди, имеющие D-антиген, называются «резус-положительными» (Rh+), среди европейцев их 85 %, а не имеющие его — «резус-отрицательными» (Rh-) (15 %). У некоторых народов, например эвенков, отмечается 100 % Rh+ принадлежность. Резус-положительная кровь донора образует иммунные антитела (анти- D) у резус-отрицательного реципиента. Повторное переливание резус-по- ложительной крови может вызвать гемоконфликт. Подобная же ситуация возникает у резус-отрицательной женщины, беременной резус-положи- тельным плодом. Во время родов (или аборта) эритроциты плода поступают в кровь матери и иммунизируют ее организм (вырабатывают анти-D- антитела). При последующих беременностях резус-положительным плодом анти-D-антитела проникают через плацентарный барьер, повреждают ткани и эритроциты плода, вызывая выкидыш, а при рождении ребенка — резусную болезнь, одним из проявлений которой является гемолитическая анемия. Для профилактики иммунизации резус-отрицательной женщины D-антигёнами плода во время родов или абортов ей вводят концентрированные анти-О-антитела. Они агглютинируют резус-положительные эритроциты плода, поступающие в ее организм, и имммунизации не наступает. Слабые резусные антигены С и Е при их значительном поступлении в организм резус-положительного человека могут вызвать антигенные реакции. Чаще всего антитела к антигенам эритроцитов системы резус являются иммуноглобулинами класса G. Для выявления этих антител используют анти- глобулиновую сыворотку крови, содержащую aHTH-IgG-антитела.
Антигенные свойства лейкоцитов и тромбоцитов. В настоящее время вместе с эритроцитарными антигенами открыто более 500 антигенов клеток крови и белков плазмы, которые создают свыше 40 различных антигенных систем крови, сочетания же различных антигенных систем образуют в человеческой популяции множество антигенных комбинаций. Поэтому, несмотря на подбор донора и реципиента по системам АВО эритроцитов, всегда имеется несовместимость в других антигенных структурах их крови, приводящая к иммунизации организма реципиента. На мембранах лейкоцитов помимо антигенов системы ABO, MN, Левис содержатся антигены гистосовместимости HLA (от Human Leucocyte Antigens), представленные более чем 150 антигенами, а также антигены нескольких других генетических систем — NA, NB, NC, ND, NE и др. Антигены гистосовместимости HLA представлены и на поверхности тромбоцитов. Несовместимость по антигенам HLA комплекса у донора и реципиента при переливании цельной крови и ее компонентов (лейкоцитарной или тромбоцитарной массы) приводит к иммунизации реципиента. Минимальное количество лейкоцитов, вызывающее иммунизацию реципиента, составляет 1 • 106. Образовавшиеся в организме реципиента антитела против антигенов системы HLA или антигенов лейкоцитов NA-NE при повторном переливании крови реципиенту вызывают различные осложнения (лихорадку, возникающую в результате освобождения пирогенных веществ из поврежденных антителами лейкоцитов; антитела вызывают разрушение донорских лейкоцитов и тромбоцитов и др.). Такие реакции могут развиваться у реципиентов после повторного переливания цельной крови, эритроцитарной или тромбоцитарной массы, плазмы крови, так как лейкоцитарные антигены находятся в растворимой форме в плазме крови, присутствуют на поверхности других клеток крови. Из сказанного следует, что трансфузия цельной крови от донора реципиенту, даже имеющим одну и ту же группу крови по системе АВО и Rh-Hr, тем не менее, может привести к осложнениям, связанным с поступлением в организм реципиента лейкоцитов и тромбоцитов, имеющих разные с лейкоцитами и тромбоцитами реципиента антигенные характеристики, что вызывает иммунизацию и по- слетрансфузионную реакцию у реципиента. Поэтому цельную кровь для переливания используют в клинике крайне редко, лишь по экстренным жизненным показаниям, например с целью полного восполнения кровопотери у детей, весьма чувствительных к гипоксии, вызванной острой кровопотерей. Кроме того, переливание цельной свежезаготовленной крови несет опасность передачи инфекции реципиенту, если донор находился в латентном (скрытом), не поддающемся диагностике периоде заболевания гепатитом В, С, D, СПИДом, сифилисом и малярией. Поэтому больным с целью восстановления газотранспортной функции крови переливают эритроцитарную массу, отмытую от плазмы крови, обедненную или лишенную лейкоцитов и тромбоцитов. Так, 5-кратное отмывание эритроцитов изотоническим раствором NaCl удаляет из эритроцитарной массы до 80 % лейкоцитов и почти все тромбоциты и эффективно предупреждает иммунизацию организма реципиента.
7.7.2. Влияние переливаемой крови и ее компонентов на организм человека Перелитая пациенту кровь или ее компоненты позволяют восстановить объем потерянной крови, коллоидно-осмотическое давление крови, газотранспортную, кроветворную, защитную (иммунную), питательную, регуляторную, гемостатическую функции крови, стимулируют гомеостатические механизмы, поддерживающие объем жидкостей различных секторов организма. После кровопотери взрослый человек может выжить без переливания крови или кровезаменителей, если потеря циркулировавших в сосудистом русле эритроцитов не превысит 2/3, а плазма крови — ’/3 от их исходного количества. Большая потеря объема циркулирующих эритроцитов и объема циркулирующей плазмы без возмещения их потери приводит организм человека к гибели. Для получения лечебного эффекта дефицит потерянных с кровопотерей эритроцитов восполняют на 80%, а плазмы —на 150— 170 %, т. е. объем плазмы крови, переливаемой больному, должен быть больше утраченного с кровопотерей. Введение избыточного объема плазмы улучшает реалогические характеристики циркулирующей крови, способствует вымыванию эритроцитов из депо в циркуляцию. Например, с целью восстановления газотранспортной функции крови больным, перенесшим кровопотерю или страдающим анемией с уменьшением гемоглобина ниже 80 г/л крови, переливают одногруппную (по системе AB0) эритроцитарную массу, полученную от одного донора, и изотонический раствор NaCl, устраняя дефицит эритроцитов в организме больного на 80 %, а плазмы крови — на 130—150 % от нормального уровня. Переливание одногруппной крови (по системе AB0) от разных доноров одному реципиенту может вызвать сильное иммунологическое воздействие на организм реципиента и синдром «гомологичной крови», связанный с появлением микроагрегатов клеток крови (до 150—200 мкм), вызывающих закупорку мелких легочных и мозговых сосудов реципиента, других, опасных для жизни осложнений. С целью восстановления тромбоцитарного звена гемостаза (например, при тромбоцитопении или функциональной недостаточности тромбоцитов) переливают тромбоцитарный концентрат. Так, при снижении тромбоцитов у человека ниже 20 • 109/л крови могут возникать самопроизвольные, внезапные кровотечения в желудочно-кишечном тракте, внутричерепные, что требует переливания таким больным тромбоцитарного концентрата. Лечебная доза тромбоцитарного концентрата, обеспечивающая прекращение кровоточивости, содержит не менее 2,8—3,0 • 10" тромбоцитов. Трансфузия концентратов лейкоцитов производится с целью повышения иммунных и защитных сил организма больных (например, с гнойнодеструктивными заболеваниями легких, при стафилококковом сепсисе, гнойном менингите и др.). Концентрат лейкоцитов (состоящий из гранулоцитов и лимфоцитов) донора должен быть совместим с лейкоцитами реципиента по системам АВО, Rh-Hr и лейкоцитарным антигенам. Лечебная доза концентрата, переливаемая больному, содержит от 10 • 109 до 40 • 109 лейкоцитов. При использовании концентрата лейкоцитов или тромбоцитов должно строго выполняться правило «один донор — один реципиент». Переливание плазмы крови производится с целью поддержания плазменно-коагуляционного гомеостаза (например, для остановки кровотечения больному с гемофилией, страдающему дефицитом VIII фактора); с целью создания пассивного гуморального иммунитета (например, при инфекции организма синегнойной палочкой или стафилококками больным переливают антисинегнойную плазму донора, содержащую антитела против синегнойной палочки, антистафилококковую — с антителами против стафилококков, повышая устойчивость организма больных против этих инфекций); с целью заместительной терапии — например, при ожоговой болезни, когда имеет место выраженная потеря плазмы, связанная с выходом плазмы крови из сосудов, вызывающая сгущение крови и ухудшение кровоснабжения тканей. Так, при ожоговом поражении до 10—15 % площади тела плазмопотеря достигает 6—8 л в сутки и ее замещение производят плазмой крови и кровезаменителями. Средняя доза вводимой плазмы — 500 мл. Переливаемая плазма должна быть одной группы с кровью реципиента по системе АВО. В чрезвычайных ситуациях, когда отсутствует одногруп- пная плазма, переливают плазму донора группы А(П) или В(Ш) реципиенту с 0 (I) группой крови и плазму АВ (IV) группы реципиентам любой группы крови. При дефиците донорской крови и ее компонентов для лечения острой кровопотери, травматического шока, плазмопотери (при ожоговой травме) используют кровезаменители, которые восстанавливают объем циркулирующей крови, нарушенную гемодинамику (повышают до нормального значения уровень артериального давления, нормализуют микроциркуляцию), коллоидно-осмотическое давление крови. В качестве кровезаменителей, восстанавливающих нарушенное кровопотерей кровообращение, используют, например, декстран — водорастворимый высокомолекулярный (мол. масса 80 000) полимер глюкозы — и созданные на его основе полиглюкин, полиглюсоль, реополиглюкин. Кровезаменители, благодаря молекулярной массе, препятствующей выходу молекул через стенку сосудов в интерстиций, поддерживают высокое коллоидно-осмотическое давление плазмы крови, вследствие чего способствуют движению тканевой жидкости в кровоток, поддерживают нормальный объем циркулирующей крови. ГЛАВА 8 Иммунная система [‡] Во внутренней среде организма присутствуют клетки и молекулы, которые обеспечивают защитную функцию (иммунитет). Часть из них относятся к факторам врожденного иммунитета, т. е. присутствуют в организме еще до встречи с каким-либо болезнетворным микроорганизмом или чужеродной молекулой. К таким факторам защиты относятся фагоцитирующие клетки крови и тканей, а также большие гранулярные лимфоциты, получившие название «натуральные (естественные) киллеры». Врожденными факторами защиты организма являются также молекулы, продуцируемые и секретируемые вышеназванными клетками, а также лимфоцитами, стромальными и другими клетками. К таким молекулам относятся: белки системы комплемента, медиаторы межклеточного взаимодействия — цитокины и др. Белки системы комплемента продуцируются постоянно и циркулируют в крови, большинство цитокинов начинают продуцироваться и секретироваться клетками только в ответ на сигнал активации (например, на контакт с микроорганизмом). Более эффективным способом защиты внутренней среды организма от проникающих в нее чужеродных агентов (антигенов) является специфический иммунный ответ, в результате которого организм приобретает дополнительные защитные механизмы: активированные клетки и продуцируемые ими молекулы. Защитное действие этих механизмов строго избирательно (специфично) в отношении того конкретного антигена (например, патогенного микроорганизма), контакт с которым вызвал иммунный ответ. Специфический иммунный ответ является функцией клеток и органов иммунной системы.
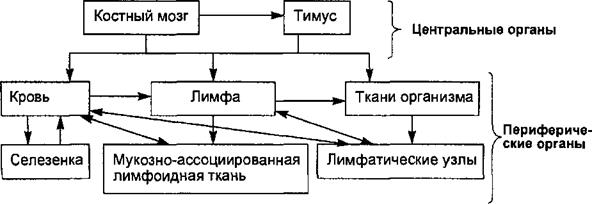
Рис. 8.1. Рециркуляция лимфоцитов. Из центральных органов иммунной системы (костного мозга и тимуса) созревающие лимфоциты поступают в кровь и заселяют периферические органы и ткани иммунной системы, откуда снова поступают в лимфоток, в кровоток, продолжая рециркуляцию. Главными клетками иммунной системы являются Г- и В-лимфоциты, которые рециркулируют в системе кровотока и лимфотока, постоянно перемещаясь из одних органов иммунной системы в другие, обладают способностью выходить в ткани для выполнения защитных функций (рис. 8.1). В защитных реакциях специфического иммунитета кроме Т- и В-лим- фоцитов участвуют фагоцитирующие клетки (гранулоциты, моноциты, макрофаги), «естественные киллеры, тучные клетки, эндотелиальные и эпителиальные клетки, которые играют роль вспомогательных, взаимодействуя с Т- и В-лимфоцитами.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2020-12-09; просмотров: 155; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.19.27.178 (0.023 с.) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||