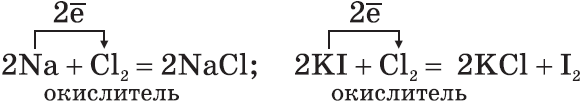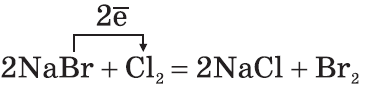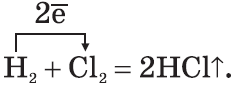Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Восстановительные свойства простых веществ — неметаллов.Содержание книги
Поиск на нашем сайте
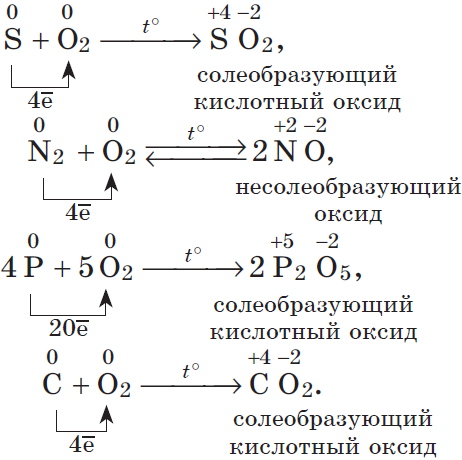
1. По отношению ко фтору все неметаллы (даже кислород) проявляют восстановительные свойства. 2. Разумеется, неметаллы, кроме фтора, служат восстановителями при взаимодействии с кислородом:
В результате реакций образуются оксиды неметаллов: несолеобразующие и солеобразующие кислотные. И хотя галогены непосредственно с кислородом не соединяются, известны их оксиды: Cl2O, ClO2, Cl2O7 и др., которые получают косвенным путем.
3. Многие неметаллы могут выступать в роли восстановителя в реакциях со сложными веществами — окислителями: а) H2+ CuO→ Cu+ H2О б) 6 P +5 KClO 3 →5 KCl +3 P 2 O 5 в) C+4HNO3→ CO2↑+4O2↑+2H2O Существуют и такие реакции, в которых один и тот же неметалл является одновременно и окислителем, и восстановителем. Это реакции самоокисления-самовосстановления (диспропорционирования): а) Cl2+H2O ⇄ HCl+HClO б) 3 Cl 2 +6 KO Н= 5 KCl + KClO 3 +2 H 2 O Химические свойства водорода. 1. Молекула водорода очень прочная, что делает ее малоактивной: H2=2H–432 кДж 2. При обычных температурах водород вступает в реакцию с активными металлами : Ca+H2=CaH2 образуя гидрид кальция, и с F2, образуя фтороводород: F2+H2=2HF 3. При высоких температурах получают аммиак: N2+3H2=2NH3 и гидрид титана (металл в порошке): Ti+H2=TiH2 4. При поджигании водород реагирует с кислородом: 2H2+O2=2H2O+484кДж 5. Водород обладает восстановительной способностью: CuO+H2=Cu+H2O Химические свойства галогенов: хлор, бром, йод. 1. Галогены — сильные окислители. Они окисляют простые и сложные вещества:
2. По окислительной активности каждый вышестоящий в Периодической таблице галоген является более сильным по отношению к нижестоящему. Поэтому каждый галоген вытесняет любой нижестоящий из его соединений:
3. Галогены активно реагируют с неметаллами:
4. Галогены реагируют с водой, образуя атомарный кислород: H2O+Cl2=2HCl+O; O+O=O2 5. Галогены очень активны в присутствии воды. Химические свойства кислорода. Взаимодействие веществ с кислородом называется реакцией окисления этих веществ. Кислород принимает участие в таких окислительных процессах: горение, дыхание, ржавление металлов, гниение растительных и животных останков. Реакции окисления, сопровождающиеся выделением теплоты и света, называются реакциями горения:
а) горение простых веществ: - неметаллов: C+O2=CO2 S+O2=SO2 4P+5O2=2P2O5 - металлов: 3Fe+2O2=Fe3O4, или FeO·Fe2O3 Эти процессы горения происходят быстро. Возможно и медленное горение — окисление: 2Cu+O2=2CuO б) горение сложных веществ: 2 C2H2+5O2→4CO2+2H2O Химические свойства серы. Сера | Соединения серы | ||||
| Оксиды серы | ||||||
| При обычных условиях — твердое желтое кристаллическое вещество. | При обычных условиях SO2 — газ, SO3 — жидкое вещество (t°пл=16,8°С). | |||||
| Горит в кислороде: S+O2=SO2 (проявляет восстановительные свойства) | Проявляют свойства кислотных оксидов, взаимодействуя: SO2+2NaOH=Na2SO3+H2O SO3+CaO=CaSO4 | |||||
| Взаимодействует с металлами и водородом: Fe+S=FeS H2+S=H2S (проявляет окислительные свойства) |
Химические свойства азота.
Азот
|
| Поделиться: |