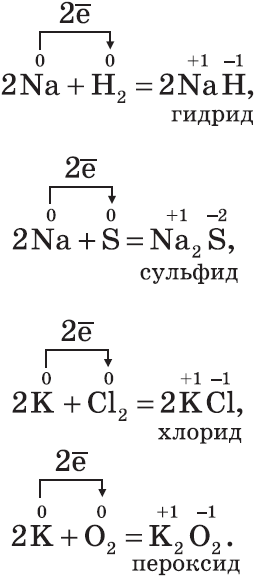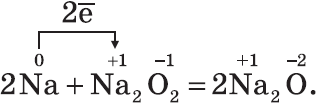Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Характерные химические свойства простых веществ — металлов: щелочных, щелочноземельных, алюминия, переходных металлов — меди, цинка, хрома, железаСодержание книги
Поиск на нашем сайте
Характерные химические свойства простых веществ — металлов: щелочных, щелочноземельных, алюминия, переходных металлов — меди, цинка, хрома, железа Электрохимический ряд напряжений металлов Восстановительную активность металла в химических реакциях, которые протекают в водных растворах, отражает его положение в электрохимическом ряду напряжений металлов.
На основании этого ряда напряжений можно сделать следующие важные заключения о химической активности металлов в реакциях, протекающих в водных растворах при стандартных условиях: 1. Чем левее стоит металл в этом ряду, тем более сильным восстановителем он является. 2. Каждый металл способен вытеснять (восстанавливать) из солей в растворе те металлы, которые в ряду напряжений стоят после него (правее). 3. Металлы, находящиеся в ряду напряжений левее водорода, способны вытеснять его из кислот в растворе. Восстановительная активность металла, определенная по электрохимическому ряду, не всегда соответствует положению его в Периодической системе. Это объясняется тем, что при определении положения металла в ряду напряжений учитывают не только энергию отрыва электронов от отдельных атомов, но и энергию, затрачиваемую на разрушение кристаллической решетки, а также энергию, выделяющуюся при гидратации ионов. Металлы, являющиеся самыми сильными восстановителями (щелочные и щелочноземельные), в любых водных растворах взаимодействуют прежде всего с водой. Например, литий более активен в водных растворах, чем натрий (хотя по положению в Периодической системе Na — более активный металл). Дело в том, что энергия гидратации ионов Li+ значительно больше, чем энергия гидратации Na+, поэтому первый процесс является энергетически более выгодным. Химические свойства щелочных металлов (Na,K) Щелочные металлы — типичные металлы, имеют серебристо-белый цвет, мягкие (режутся ножом), легкие и легкоплавкие. Активно взаимодействуют со всеми неметаллами:
Все щелочные металлы при взаимодействии с кислородом (исключение — Li) образуют пероксиды. В свободном виде щелочные металлы не встречаются из-за их высокой химической активности. Оксиды — твердые вещества, имеют основные свойства. Их получают, прокаливая пероксиды с соответствующими металлами:
Химические свойства алюминия Алюминий | Соединения алюминия | ||||
| Оксид алюминия | ||||||
| Серебристо-белый легкий металл | Очень твердый порошок белого цвета | |||||
| Окисляется на воздухе с образованием защитной пленки: 4Al+3O2=2Al2O3 | Амфотерный оксид, взаимодействует: Al2O3+6H+=2Al3++3H2O Al2O3+2OH–=2AlO2−+H2O | |||||
| Вытесняет водород из воды: 2Al+6H2O=2Al(OH)3↓+3H2↑ | ||||||
| Взаимодействует с кислотами: 2Al0+6H+=2Al3++3H20↑ | ||||||
| Взаимодействует с водным раст-вором щелочи: 2Al+2H2O+2NaOH=2NaAlO2+3H2↑ | ||||||
| Вытесняет металлы из их оксидов (алюминотермия): 8Al+3Fe3O4=9Fe+4Al2O3+Q | ||||||
| Получение Разложение электрическим током расплава оксида алюминия (в криолите): 2Al2O3=4Al+3O2↑–3352кДж | Образуется: а) при окислении или горении алюминия на воздухе: 4Al+3O2=2Al2O3 б) в реакции алюминотермии: 2Al+Fe2O3=Al2O3+2Fe; в) при термическом разложении гидроксида алюминия: 2Al(OH)3=Al2O3+3H2O |
Химические свойства меди
Как и другие металлы побочной подгруппы I группы Периодической системы, медь стоит в ряду активности правее водорода и не вытесняет его из кислот, но реагирует с кислотами-окислителями:
Cu+2H2SO4(конц.)=CuSO4+SO2↑+2H2O
Cu+4HNO3(конц.)=Cu(NO3)2+2NO2↑+2H2O
Под действием щелочей на растворы солей меди выпадает осадок слабого основания голубого цвета — гидроксида меди (II), который при нагревании разлагается на основный оксид CuO черного цвета и воду:
Cu 2+ +2 OH –= Cu (OH)2↓
Cu (OH)2→ CuO+H2O
Химические свойства цинка
Цинк — один из активнейших металлов, при повышенной температуре реагирует с простыми веществами:
Zn+Cl2→ ZnCl2 2Zn+O2→2ZnO Zn+S→ ZnS
Цинк вытесняет водород из кислот:
Zn+2Н+=Zn2++H2↑
Гидроксид цинка амфотерен, т. е. проявляет свойства и кислоты, и основания. При постепенном приливании раствора щелочи к раствору соли цинка выпавший вначале осадок растворяется (то же происходит и с алюминием): ZnSO 4 +2 NaOH = Zn (OH)2↓+ Na 2 SO 4
Zn(OH)2+2NaOH= Na2[Zn(OH)4]
Химические свойства хрома
На примере хрома (Cr) можно показать, что свойства переходных элементов меняются вдоль периода не принципиально: происходит количественное изменение, связанное с изменением числа электронов на валентных орбиталях. Максимальная степень окисления хрома +6. Металл в ряду активности стоит левее водорода и вытесняет его из кислот:
|
|
Cr+2H+=Cr2++H2↑
При добавлении раствора щелочи к такому раствору образуется осадок Me(OH)2, который быстро окисляется кислородом воздуха:
4Cr(OH)2+O2+2H2O=4Cr(OH)3
Ему соответствует амфотерный оксид Cr2O3. Оксид и гидроксид хрома (в высшей степени окисления) проявляют свойства кислотных оксидов и кислот соответственно. Соли хромовой кислоты (H2CrO4) в кислой среде превращаются в дихроматы — соли дихромовой кислоты (H2Cr2O7).
Окисление сопровождается изменением окраски, т.к. соли хроматы желтого цвета, а дихроматы — оранжевого.
2CrO42−+H+ ⇄ Cr2O72−+H2O
Соединения хрома обладают высокой окислительной способностью.
Химические свойства железа
Подобно всем металлам, атомы железа проявляют восстановительные свойства, отдавая при химических взаимодействиях не только два электрона с последнего уровня и приобретая степень окисления +2, но и электрон с предпоследнего уровня, при этом степень окисления повышается до +3.
Железо и его соединения
| Железо | Оксиды железа (II) и (III) |
| Серебристо-белый металл | Проявляют основные свойства, взаимодействуя с кислотами: FeO+2H+=Fe2++H2O |
| Взаимодействует с простыми веществами: а) горит в кислороде: 3Fe+2O2=Fe3O4 б) реагирует с хлором: 2Fe+3Cl2=2FeCl3 в) взаимодействует с серой: Fe+S=FeS | |
| Реагирует с растворами кислот: Fe+2H+=Fe2++H2↑ | Оксид железа (III) проявляет слабые амфотерные свойства, взаимодейст-вуя при нагревании с основными оксидами с образованием ферритов: |
| Вытесняет водород из воды при сильном нагревании: Fe+H2O=FeO+H2↑ | |
| Окисляется в присутствии воды и кислорода воздуха (с образованием ржавчины): 4Fe+6H2O+3O2=4Fe(OH)3 | |
| Замещает менее активный металл в растворе его соли: Fe+Cu2+=Fe2++Cu | |
| Получение Восстановление оксидов железа оксидом углерода (II), водородом или алюминием: Fe3O4+4CO=3Fe+4CO2 FeO+H2=Fe+H2O Fe2O3+2Al=2Fe+Al2O3 |
Химические свойства серы.
Сера
Проявляют свойства кислотных оксидов, взаимодействуя:
- с водой: SO2+H2O⇄H2SO3
SO3+H2O=H2SO4
- со щелочами:
SO2+2NaOH=Na2SO3+H2O
SO3+2NaOH=Na2SO4+H2O
- с основными оксидами:
SO3+CaO=CaSO4
Химические свойства азота.
Азот
Фосфор
|
|
Углерод
Получение
Неполное сжигание метана:
CH4+O2=C+2H2O
Кремний
| Тренировочные задания |
Задание 1. Из предложенного перечня выберите две пары металлов, каждый из которых не реагирует с разбавленной серной кислотой.
1) медь и серебро
2) железо и олово
3) железо и хром
4) платина и золото
5) медь и цинк
Запишите в поле ответа номера выбранных пар металлов.
Решение.
С разбавленной серной кислотой не будут реагировать металлы, стоящие в ряду напряжений правее водорода. Среди перечисленных это медь, золото, платина и серебро.
|
|
Ответ 14
Задание 2. Из предложенного перечня выберите два оксида, которые реагируют с водой.
1) оксид кальция
2) оксид кремния
3) оксид бария
4) оксид азота (I)
5) оксид меди (II)
Запишите в поле ответа номера выбранных веществ.
Решение.
С водой реагируют оксиды, дающие растворимые гидроксиды. Гидроксид кальция и бария это щелочи, поэтому реакции возможны.
Ответ: 13.
Характерные химические свойства простых веществ — металлов: щелочных, щелочноземельных, алюминия, переходных металлов — меди, цинка, хрома, железа
|
| Поделиться: |