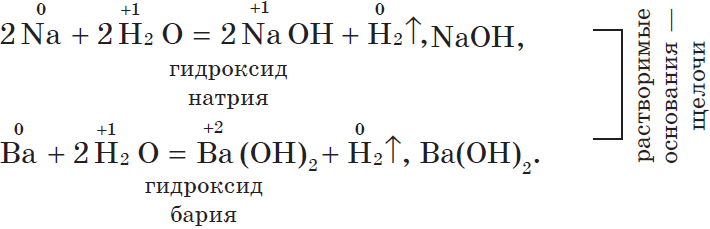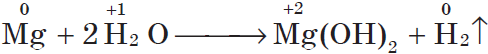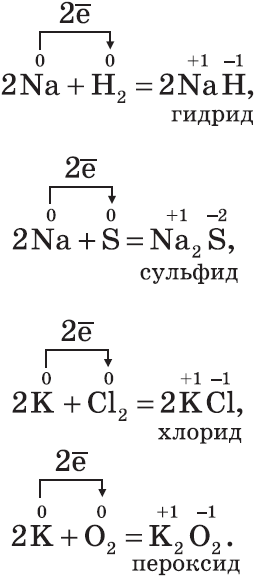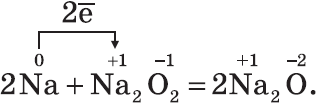Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Взаимодействие металлов со сложными веществами
1. С водой. Щелочные и щелочноземельные металлы при обычных условиях вытесняют водород из воды и образуют растворимые основания — щелочи, например:
Другие металлы, стоящие в ряду напряжений до водорода, тоже могут при определенных условиях вытеснять водород из воды. Но алюминий бурно взаимодействует с водой, только если удалить с его поверхности оксидную пленку:
Магний взаимодействует с водой только при кипячении, при этом также выделяется водород:
Если горящий магний внести в воду, то горение продолжается, т.к. протекает реакция: 2H2+O2=2H2O Железо взаимодействует с водой только в раскаленном виде:
2. С кислотами в растворе (HCl, H2SO4(разб.),CH3COOH и др., кроме HNO3) взаимодействуют металлы, стоящие в ряду напряжений до водорода. При этом образуются соль и водород. 2 Al +6 HCl = 2 AlCl 3 +3 H 2 ↑ 2CH3COOH+Mg = Mg(CH3COO)2+ H2↑ А вот свинец (и некоторые другие металлы), несмотря на его положение в ряду напряжений (слева от водорода), почти не растворяется в разбавленной серной кислоте, т.к. образующийся сульфат свинца PbSO4 нерастворим и создает на поверхности металла защитную пленку. 3. С солями менее активных металлов в растворе. В результате такой реакции образуется соль более активного металла и выделяется менее активный металл в свободном виде Fe + CuSO 4 = FeSO 4 + Cu Нужно помнить, что реакция идет в тех случаях, когда образующаяся соль растворима. 4. С органическими веществами. Взаимодействие с органическими кислотами аналогично реакциям с минеральными кислотами. Спирты же могут проявлять слабые кислотные свойства при взаимодействии со щелочными металлами: 2 C 2 H 5 OH + Na →2 C 2 H 5 ONa + H 2 ↑ Аналогично реагирует и фенол: 2 C 6 H 5 OH +2 Na →2 C 6 H 5 ONa + H 2 ↑ Металлы участвуют в реакциях с галогеналканами, которые используют для получения низших циклоалканов и для синтезов, в ходе которых происходит усложнение углеродного скелета молекулы (реакция А. Вюрца):
2CH3Cl+2Na→ C2H6+2NaCl 5. Со щелочами в растворе взаимодействуют металлы, гидроксиды которых амфотерны. 2 Al +2 KOH +6 H 2 O =2 K [ Al (OH)4]+3 H 2 ↑ Химические свойства щелочных металлов (Na,K) Щелочные металлы — типичные металлы, имеют серебристо-белый цвет, мягкие (режутся ножом), легкие и легкоплавкие. Активно взаимодействуют со всеми неметаллами:
Все щелочные металлы при взаимодействии с кислородом (исключение — Li) образуют пероксиды. В свободном виде щелочные металлы не встречаются из-за их высокой химической активности. Оксиды — твердые вещества, имеют основные свойства. Их получают, прокаливая пероксиды с соответствующими металлами:
|
|||||
|
Последнее изменение этой страницы: 2020-11-28; просмотров: 135; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.223.32.230 (0.005 с.) |