
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Питательные среды для выращивания клеток животныхСодержание книги
Поиск на нашем сайте
Функции сред для выращивания клеток: поддержание необходимых для роста физико-химических условий; обеспечение клеток питательными веществами для синтеза клеточной биомассы и продуктов. Среда культивирования может создавать следующие условия: для клонального роста, т.е. для роста одиночной клетки; массового выращивания клеток; образования целевого продукта; поддержания обмена веществ у неделящихся клеток. Первоначально для культивирования клеток создавались комплексные среды на основе плазмы крови и других биологических жидкостей. Наиболее рациональным при выборе состава сред является уменьшение числа компонентов до минимума, необходимого для роста, т.е. создание так называемых минимальных сред. Термин «питательное вещество» подразумевает вещество, которое поступает в клетки и используется как метаболический субстрат или кофактор. Известны незаменимые питательные вещества – это аминокислоты, витамины, растворенные газы, неорганические ионы, источники энергии. Основной состав питательных сред: Источники энергии – глюкоза, глютамин, фруктоза, галактоза, уридин и цитидин. Аминокислоты. Для культивирования клеток незаменимыми считаются 13 аминокислот (аргинин, цистин, глутамин, гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан, тирозин, валин). Потребность в них снижается, если в среде содержится достаточно заменимых аминокислот (аланин, аспарагин, аспарагиновая кислота, пролин, глицин, серин). Важное значение имеет баланс между аминокислотами. Витамины. Для многих культивируемых клеток необходимы водорастворимые витамины (биотин, фолиевая кислота, никотинамид, пантотеновая кислота, пиридоксин, рибофлавин и тиамин). Например, аскорбиновая кислота увеличивает урожай интерферона при его получении из культур клеток человека на микроносителе. Информация о влиянии жирорастворимых витаминов (А, D, Е, К и др.) на культивируемые клетки весьма ограничена. Неорганические ионы. Клеткам животных для роста требуется натрий, калий, кальций, магний, фосфат, бикарбонат, хлорид. Они необходимы для поддержания осмотического давления; создания потенциалов у мембран; регулирования рН (за счет буферности); способствуют прикреплению клеток к различным поверхностям; действуют как кофакторы для энзиматических реакций; от соотношения различных ионов, особенно ионов натрия и калия, зависит урожай клеток и скорость их роста. Следовые элементы. Считают, что для животных клеток незаменимыми или полезными являются 15 элементов: Со, Сu, I, Fe, Mn, Mo, Zn, Se, Cr, Ni, V, As, Si, Sn. Следовые элементы переходят в среды из химических соединений или из стекла (колбы, бутыли). Липиды. Источник липидов – сыворотка. Она содержит белки, транспортирующие липиды: альбумин – переносит свободные жирные кислоты, и липопротеины – транспортируют фосфолипиды, триглицериды и холестерол. рН и буферные растворы. Оптимальное значение рН для максимального роста клеток – 6,9-7,8. Для оптимизации рН применяют неорганические буферы (например, карбонатный буфер – СО Газы. К ислород – незаменимый элемент для роста клеток млекопитающих. Потребность в нем обеспечивают путем обдувания поверхности среды воздухом или смесью, содержащей 95% воздуха и 5% СО2. Двуокись углерода – растворяется в воде, служит источником бикарбоната. Для некоторых клеток оптимальна газовая смесь, содержащая 0,5-2,0% СО2. Антибиотики. Наиболее часто применяют антибактериальные агенты – пенициллин, стрептомицин, гентамицин; противогрибковые агенты – амфотерицин, нистатин. Постоянное применение антибиотиков не желательно из-за выработки резистентных микроорганизмов; отрицательного влияния на рост и функции клеток; снижения урожайности, скорости роста и сохраняемости клеток. Неопределенные добавки – сыворотки эмбриона теленка, новорожденных телят и лошадей. Функции сыворотки: является носителем для лабильных или нерастворимых в воде питательных веществ; связывает или нейтрализует токсины; содержит ингибиторы протеазы, которая инактивирует трипсин; способствует прикреплению клеток к субстрату; является источником незаменимых низкомолекулярных питательных веществ, гормонов и пептидных факторов роста; обладает защитным эффектом (например, при перемешивании). При использовании сыворотки возникают следующие проблемы: вариабельность состава; высокая стоимость и периодическая дефицитность; источник контаминации микоплазмами, бактериофагами, вирусами и др.; источник токсинов; модифицирование поверхности клеток вследствие адсорбции или внедрения сывороточных белков; невозможность точно определить питательность среды; осложнения при очистке продуктов; чрезмерный рост фибробластов в первичных культурах других типов клеток. В бессывороточные питательные среды вводят и другие неопределенные добавки (пептоны, эмульсии яичного желтка, гидролизат лактальбумина, триптозный фосфат и молоко).
При выборе среды следует учитывать: · Любые данные о предшествующем использовании; наиболее надежно применение той среды, которая ранее показала хорошие результаты для данного типа клеток. · Тип клеток. Трансформированные и отселекционированные клеточные линии обычно относительно хорошо растут в более простой среде или требуют меньше сыворотки, чем нетрансформированные или первичные клеточные линии. · Обеспеченность материалом. Специализированные предприятия обеспечивают широкий выбор традиционных сред и необходимый набор бессывороточных смесей (например, среда Искова). Должны быть также доступными ростовые факторы и добавки к бессывороточным средам. · Система культивирования. · Стоимость. Дороговизна сыворотки должна балансировать высокой стоимостью добавок к бессывороточным средам. · Точность химического состава. Например, для ряда исследований предпочтительны бессывороточные среды. Вопросы для самоконтроля
1) История применения культур клеток животных. 2) Разъясните понятия «рост клеток», «специализация клеток» и «трансформация клеток». 3) Перечислите этапы культивирования клеток животных. 4) Методы сепарации клеток животных. 5) Какие ферменты используют для диссоциации тканей? 6) Какие приемы используют для сбора урожая клеток и подсчета их общего числа? 7) Методы синхронизации роста клеток. 8) Иммобилизация и микрокапсулирование клеток: значение, приемы. 9) Консервирование клеток животных. 10) Технология восстановления жизненных функций клеток после консервирования. 11) Глубинное выращивание клеток в монослое. 12) Глубинное выращивание клтоек в суспензионных культурах. 13) Какие факторы следует учитывать при выборе питательной среды для культивирования клеток животных? 14) Перечислите основные компоненты питательных сред для культивированич клеток животных. СПИСОК ЛИТЕРАТУРЫ Основная
1. Блинов, В.А. Общая биотехнология: Курс лекций. В 2-х частях. Ч. 2. – Саратов: ФГОУ ВПО «Саратовский СГАУ», 2004. – 144 с. – ISBN 5-7011-0436-2 2. Глик, Б. Молекулярная биотехнология. Принципы и применение. Пер. с англ. / Б. Глик, Дж. Пастернак.– М: Мир, 2002. – 589 с. 3. Елинов, Н.П. Основы биотехнологии / Н.П. Елинов. – СПб.: Наука, 1995. – ISBN 5-02-026027-4 4. Клунова, С.М. Биотехнология: учебник / С.М. Клунова, Т.А. Егорова, Е.А. Живухина. – М.: Академия, 2010. – 256 с. – ISBN 978-5-7695-6697-4 5. Сельскохозяйственная биотехнология / Шевелуха В.С. и др. – М.: Высшая школа, 2003. – 427 с. – ISBN: 5-06-004264-2 6. Тарантул, В.З. Толковый биотехнологический словарь русско-английский: справочное издание [Электронный ресурс] / В.З. Тарантул. – М.: Языки славянских культур, 2009. – 936 с. – ISBN: 978-5-95-51-0342-6 – Доступ с сайта научной библиотеки СГАУ – ЭБС IPRbooks 7. Цыганский, Р.А. Физиология и патология животной клетки: учебное пособие / Р.А. Цыганский. – СПб.: Лань, 2009. – 336 с. – ISBN 978-5-8114-0870-2
Дополнительная
1. Биотехнология: учебное пособие для вузов, в 8 кн., под ред. Егорова Н.С., Самуилова В.Д. – М., 1987. 2. Журнал «Биотехнология» (аннотации статей) (ссылка доступа – http://www.genetika.ru/journal) 3. Интернет-журнал «Коммерческая биотехнология» (ссылка доступа – http://cbio.ru) 4. Оn-line-журнал «Биотехнология. Теория и практика» (ссылка доступа – http://www.biotechlink.org)
Лекция 9
ТРАНСПЛАНТАЦИЯ ЭМБРИОНОВ 9.1. Этапы технологии трансплантации эмбрионов Биотехнология имеет особое значение в воспроизводстве и селекции крупного рогатого скота. Крупный рогатый скот относится к одноплодным видам млекопитающих. От одной коровы можно получить в лучшем случае одного теленка в год. Однако в ее яичнике содержатся сотни тысяч незрелых половых клеток (ооцитов). Они представляют огромный генетический резерв. Ускорить воспроизводство скота можно при переходе к нетрадиционным способам увеличения плодовитости. В последнее время приобрела практическое значение трансплантация эмбрионов. Использование этого метода в сочетании с длительным хранением семени в замороженном состоянии позволяет получить десятки тысяч потомков от одного производителя в год и освободить генетически выдающихся самок от необходимости вынашивания плода и вскармливания потомства. Суть метода состоит в том, что самок стимулируют с целью увеличения выхода яйцеклеток, которые затем извлекают на стадии ранних зародышей и пересаживают менее ценным в генетическом отношении реципиентам.
Технология трансплантации эмбрионов включает следующие этапы: Отбор доноров. В качестве коров-доноров отбирают матерей потенциальных племенных быков. На первом этапе племенная ценность донора оценивается по главным признакам молочного скота – по уровню молочной продуктивности и жирности молока. На втором этапе число признаков в зависимости от цели селекции расширяется (форма вымени и сосков, свойства молокоотдачи, резистентность, крепость костяка и копыт, тип и воспроизводительные качества). Предпочтение отдают коровам, которые сохранили в течение трех отелов стабильную воспроизводительную способность. От таких коров можно регулярно получать эмбрионы через каждые два месяца. У коров-доноров при всех отелах должны отсутствовать осложнения (мертворождаемость, задержание последа, послеродовые заболевания половых органов).
Вызывание суперовуляции. В группу доноров переводят только тех коров, которые положительно реагируют на введение гормонов. Для стимуляции множественной овуляции используют: а) гонадотропин сыворотки жеребых кобыл (СЖК) в сочетании с простагландинами и другими биологически активными веществами. Вводят однократно. Этот способ позволяет вызывать суперовуляцию примерно у 70 % коров; б) фолликулостимулирующий гормон ФСГ или его комбинация с лютеинизирующим гормоном ЛГ в соотношении 5:1. Вводят многократно. Оптимальный результат суперовуляции – выход из яичника в воронку яйцепровода 10 - 20 яйцеклеток. Эмбрионы можно получить менее чем от половины первоначально отобранных потенциальных коров-доноров. Хорошими донорами считают коров, которые после многократных суперовуляций имеют хорошую реакцию яичника и производят большое число пригодных для пересадки эмбрионов за одно вымывание. Кормление доноров должно быть таким, чтобы они находились в хорошем физиологическом состоянии. Рацион коровы-донора должен быть сбалансированным по основным питательным веществам, и особенно по аминокислотам и микроэлементам. Искусственное осеменение коров-доноров. Для этого используют сперму только выдающихся быков-производителей, достоверно оцененных по качеству потомства. Коров осеменяют дважды: первый раз при начале появления половой охоты и второй – через 12 - 24 часа. Со дня осеменения начинается отсчет развития эмбрионов in vitro.
Извлечение эмбрионов. Возможно три способа: · Извлечение эмбриона после убоя коровы-донора – самый простой и надежный способ. Этот способ практиковался только на первых этапах освоения метода трансплантации. В настоящее время он не используется из-за потери генетически ценной коровы-донора. · Хирургический способ – эмбрионы извлекают между 7-8-ми сутками после первого искусственного осеменения (разрез верхнего свода влагалища, лапаротомия по белой линии живота и лапаротомия в области голодной ямки). Этот способ трудоемкий, дорогостоящий, им нельзя пользоваться многократно. В настоящее время применяется редко, главным образом в научных целях. · Нехирургический способ. Преимущество – простота манипуляций. Для этого не требуется специального операционного помещения. Эмбрионы можно извлекать непосредственно в производственных условиях. При правильном применении этого способа воспроизводительная способность доноров не нарушается. Это позволяет многократно использовать генетически ценных коров-доноров для получения от них большого числа потомков. Эмбрионы извлекают под местной анестезией путем вымывания (5 - 8 раз). Длительность манипуляции – 20 - 50 минут. После вымывания эмбрионов в матку вводят раствор антибиотика. В среднем из вымытых яйцеклеток до 25 % оказываются неоплодотворенными или дезинтегрированными.
Кратковременное культивирование и хранение эмбрионов. Манипуляции с ранними эмбрионами, находящимися на предимплантационных стадиях развития, т.е. от момента их получения до введения в рога матки реципиента, занимают от 1 до 5 часов. В этот период нужно создать оптимальные условия, обеспечивающие сохранение их биологических качеств. Кратковременное хранение эмбрионов дает также возможность транспортировать их в другие хозяйства. Эмбрионы КРС можно сохранить путем пересадки их в яйцепровод самок других видов млекопитающих, например, крольчих. Недостаток метода – трудоемкость и возможные потери зигот при их переносе. В настоящее время распространен метод краткосрочного хранения эмбрионов in vitro. При этом жизнеспособные эмбрионы переносят в питательные среды с температурой 37 ºС. В состав сред включены растворы солей, аминокислоты с бикарбонатным ионом как буферным агентом. Он обеспечивает рН в пределах 7,2 - 7,6. При этом биологические качества эмбрионов сохраняются до 95 часов.
Оценка эмбрионов. Производится несколькими методами: а) Морфологический метод – при этом основное внимание обращают на форму зиготы, равномерность дробления и т.д. б) Оценка по адсорбционным свойствам оболочек и цитоплазмы к различным красителям (например, синьке Эванса). в) Гистохимические методы – основаны на специфических реакциях структурных элементов и веществ клеток к различным красителям. При оценке качества эмбрионов в нашей стране принята 5-балльная шкала с учетом следующих показателей: соответствие стадии развития эмбриона его возрасту; правильность формы прозрачной оболочки и ее целостность; состояние цитоплазмы и др. Идеальный эмбрион должен быть компактным, сферической формы, с однородной окраской, с клетками одинаковой величины и т.д. Эмбрионы с замедленным развитием выбраковываются. Наиболее пригодными для трансплантации являются эмбрионы, которые извлечены из матки коровы-донора на 7 - 8 сутки после первого осеменения.
Пересадка эмбрионов реципиентам. В качестве реципиента отбирают гинекологически здоровых коров после двух-трех нормальных половых циклов; продуктивные, племенные и породные качества роли не играют. Основное условие хорошего приживления эмбрионов – синхронность проявления половой охоты у доноров и реципиентов. В настоящее время пересадка эмбрионов реципиентам производится следующими способами: · Хирургический способ – эго эффективность 60 - 70 %, а число телят – 3 - 4 на донора. Этот способ использовали в основном до середины 70-х годов. Однако он требует больших затрат, его трудно применять в производственных условиях. Из-за возможных травм его нельзя многократного использовать. · Нехирургический способ – прост, экономичен, возможно многократное использование реципиента. Разработано несколько способов нехирургической пересадки эмбрионов. Метод основан на введении эмбриона в рог матки через шейку. Аппликацию зародышей – 50 - 60 %. Эффективность трансплантации повышается при пересадке двух эмбрионов, по одному в каждый рог матки. Это позволяет получить двойные отелы. При пересадке двух эмбрионов в каждый рог матки частота двоен составляет 55 - 60 %, а при естественном многоплодии коров – всего 2 %. Также можно пересаживать эмбрион и оплодотворенной корове. При этом приживляемость эмбриона составляет 50 %.
Консервация эмбрионов. Самый эффективный метод – глубокое замораживание (криоконсервация) в жидком азоте при температуре -196 ºС. Долговременное хранение глубокозамороженных эмбрионов имеет преимущества: а) пересадки могут быть проведены в любое время независимо от сроков взятия эмбрионов, поэтому нет необходимости в содержании больших групп реципиентов. В результате повышается рентабельность трансплантации; б) возможно создание эмбриобанков от генетически ценных животных. Это важно для сохранения генофонда редких и исчезающих пород, при транспортировке эмбрионов. Выживаемость эмбрионов составляет 90 %, а стельность коров-реципиентов после нехирургической пересадки находится 50 - 55 %. Эмбрионы замораживают в пробирках 50×6 мм или в ампулах вместимостью 1 мл. В них вносят 1 - 4 эмбриона от одного донора и 0,4 мл раствора криопротектора (например, 10 % раствор глицерина). Затем ампулы запаивают на пламени газовой горелки. Возможно два режима охлаждения: 1) Ампулы или пробирки охлаждают с 20 до -6 ºС со скоростью 1 ºС в минуту, проводят кристаллизацию, охлаждение со скоростью 0,3ºС в минуту и погружают в жидкий азот. 2) Охлаждение от -7 до -35 ºС со скоростью 0,3 ºС в минуту; от -35 до -38 ºС со скоростью 0,1 ºС в минуту и погружение в жидкий азот. Оттаивание эмбрионов производится на водяной бане с температурой 25 или 37 ºС в течение 10 - 12 секунд.
|
||||
|
Последнее изменение этой страницы: 2020-12-17; просмотров: 131; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.195.79 (0.011 с.) |

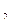 /НСО
/НСО 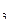 -) или органические буферы (α-глицерофосфат).
-) или органические буферы (α-глицерофосфат).


