
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Периодический закон и периодическая система химических элементов Д.И.Менделеева.Содержание книги
Поиск на нашем сайте
ОБЩАЯ ХИМИЯ Периодические изменения свойств химических элементов: радиус атома, энергия ионизации, энергия сродства к электрону, электроотрицательность, металлические и неметаллические свойства. Такие свойства атомов, как их размер, энергия ионизации, сродство к электрону, электроотрицательность, степень окисления, связаны с электронной конфигурацией атома. В их изменении с увеличением порядкового номера элемента наблюдается периодичность. Атомы не имеют строго определенных границ, что обусловлено волновой природой электронов. В расчетах пользуются так называемыми эффективными или кажущимися радиусами, т. е. радиусами шарообразных атомов, сближенных между собой при образовании кристалла. Обычно их рассчитывают из рентгенометрических данных. Радиус атома — важная его характеристика. Чем больше атомный радиус, тем слабее удерживаются внешние электроны. И, наоборот, с уменьшением атомного радиуса электроны притягиваются к ядру сильнее. В периоде атомный радиус в общем уменьшается слева направо. Это объясняется ростом силы притяжения электронов с ростом заряда ядра. В подгруппах сверху вниз атомный радиус возрастает, так как в результате прибавления дополнительного электронного слоя увеличивается объем атома, а значит, и его радиус. Энергия ионизации — это энергия, необходимая для отрыва наиболее слабо связанного электрона от атома. Она обычно выражается в электрон-вольтах. При отрыве электрона от атома образуется соответствующий катион. Энергия ионизации для элементов одного периода возрастает слева направо с возрастанием заряда ядра. В подгруппе она уменьшается сверху вниз вследствие увеличения расстояния электрона от ядра. Энергия ионизации связана с химическими свойствами элементов. Так, щелочные металлы, имеющие небольшие энергии ионизации, обладают ярко выраженными металлическими свойствами. Химическая инертность благородных; газов связана с их высокими значениями энергии ионизации. Атомы могут не только отдавать, но и присоединять электроны. При этом образуется соответствующий анион. Энергия, которая выделяется при присоединении к атому одного электрона, называется сродством к электрону. Обычно сродство к электрону, как и энергия ионизации, выражается в электрон-вольтах. Значения сродства к электрону известны не для всех элементов; измерять их весьма трудно. Наиболее велики они у галогенов, имеющих на внешнем уровне по 7 электронов. Это говорит об усилении неметаллических свойств элементов по мере приближения к концу периода. Определение электроотрицательности дал американский ученый Л. Полинг в 1932 г. Он же предложил и первую шкалу электроотрицательности. Согласно Полингу, электроотрицательность - это способность атома в соединении притягивать к себе электроны. Имеются в виду валентные электроны, т. е. электроны, которые участвуют в образовании химической связи. Очевидно, у благородных газов электроотрицательность отсутствует, так как внешний уровень в их атомах завершен и устойчив. Сопоставляя значения электроотрицательностей элементов от франция (0,86) до фтора (4,10), легко заметить, что относительная электроотрицательность подчиняется периодическому закону: в периоде она растет с увеличением номера элемента, в группе — уменьшается. Ее значения служат мерой неметалличности элементов. Очевидно, чем больше относительная электроотрицательность, тем сильнее элемент проявляет неметаллические свойства. Неметаллы характеризуются большой относительной электроотрицательностью, а металлы — небольшой. При химическом взаимодействии элементов электроны смещаются от атома с меньшей к атому с большей относительной электроотрицательностью. 3. Развитие представления о строении атома: планетарная модель Резерфорда, теория Бора, квантовая теория строения атома. Окислительно-восстановительные реакции: определение ОВР, типы ОВР. Характеристика окислителей и восстановителей. Метод электронного баланса. Метод ионно-электронного баланса. Биологическое значение ОВР. Все химические реакции можно разделить на два типа. 1 - реакции, протекающие без изменения степени окисления атомов, входящих в состав реагирующих веществ. 2 - ОВР реакции, т.е, реакции, идущие с изменением степени окисления атомов в молекуле. (про степень окисления – вопрос 9) Реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ, называются окислительно-восстановительными. Сущности процессов окисления и восстановления: 1. Окислением называется процесс отдачи электронов атомом, молекулой или ионом. Например: Al – 3e- = Al3+ Fe2+ - e- = Fe3+ H2 – 2e- = 2H+ 2Cl- - 2e- = Cl2 При окислении степень окисления повышается. 2. Восстановлением называется процесс присоединения электронов атомом, молекулой или ионом. Например: S + 2е- = S2- Сl2 + 2е- = 2Сl- Fe3+ + e- = Fe2+ При восстановлении степень окисления понижается. 3. Атомы, молекулы или ионы, отдающие электроны называются восстановителями. Во время реакции они окисляются. Атомы, молекулы или ионы, присоединяющие электроны, называются окислителями. Во время реакции они восстанавливаются. Так как атомы, молекулы и ионы входят в состав определенных веществ, то и эти вещества соответственно называются восстановителями или окислителями. Окислительными свойствами обладают вещества, которые содержат в своем составе атомы, находящиеся в высшей степени окисления (они способны её только понижать), а также вещества, содержащие атомы в промежуточной с.о., или простые вещества – неметаллы. Восстановительными свойствами обладают вещества, которые содержат в своём составе атомы, находящиеся в низшей с.о., а также атомы в промежуточной с.о., или простые вещества – металлы и неметалы. 4. Окисление всегда сопровождается восстановлением, и наоборот, восстановление всегда связано с окислением, что можно выразить уравнениями: Восстановитель – е- Окислитель + е-
Поэтому окислительно-восстановительные реакции представляют собой единство двух противоположных процессов - окисления и восстановления. Число электронов, отдаваемых восстановителем, равно числу электронов, присоединяемых окислителем. При этом, независимо от того, переходят ли электроны с одного атома на другой полностью или же лишь частично оттягиваются к одному из атомов, условно говорят только об отдаче и присоединении электронов.
Зная СО соединений, м предсказать – окислительные или восстановительные свойства оно проявит: сера: +1 -2 +1 +4 -2 +1 +6 -2 Н2S H2SO3 H2SO4 - в 1-м – это ее низшая СО=> в химических реакциях будет восстановителем. 2 – средняя СО, в зависимости от среды и партнера может выступать как в роли окислителя, так и восстановителя. 3 – более S не может повысить свою СО, => будет окислителем в этом соединении.
Типы ОВР: 1 – Межмолекулярные ОВР- такие ОВР, в которых меняют СО атомы, находящиеся в разных веществах: 0 +2 -2 +4 -2 0 C +CuO à CO2+Cu
2 – Внутримолекулярные ОВР - в которых меняют СО атомы разных элементов, находящиеся в одном веществе: +1 +5 -2 +1 -1 0 KClO3 àKCl+O2 3 – Реакции диспропорционирования - такие ОВР, в которых атом одного и того же элемента дважды меняет СО: 0 +1 -2 +1 -1 +1 +1 -2 Cl2+H2O à HCl+HClO Они возможны только в том случае, если вещество находится в промежуточной СО. Среди простых веществ окислительные свойства характерны для типичных неметаллов (F2, Cl2, Br2, I2, O2, O3). Галогены, выступая в качестве окислителей, приобретают степень окисления –1, причем от фтора к иоду окислительные свойства ослабевают. Кислород, восстанавливаясь, приобретает степень окисления –2 (H2O или OH–). Сложные вещества, используемые в качестве окислителей, очень часто, содержат элементы в высшей степени окисления. Например: +7 +6 +5 +7 KMnO4 K2Cr2O7 HNO3 KClO4 Среди кислородсодержащих кислот и их солей к наиболее важным окислителям относятся концентрированная серная кислота, азотная кислота и нитраты, перманганаты MnO4–, хроматы CrO42– и дихроматы Cr2O72–, кислородсодержащие кислоты галогенов (например, HClO) и их соли (например, KClO3). Хроматы и дихроматы, выступая в роли окислителей, в кислой среде восстанавливаются с образованием ионов Cr3+. Поскольку в кислой среде равновесие 2CrO42– + 2H+ смещено вправо, то окислителем служит ион Cr2O72–. Например: K2Cr2O7 + Na2SO3 + 4H2SO4 = Cr2(SO4)3 + K2SO4 + Na2SO4 + 7H2O Концентрированная серная кислота проявляет окислительные свойства за счет серы в высшей степени окисления +6. Продуктами восстановления серы могут быть: SO2 (степень окисления серы +4), сера – простое вещество (степень окисления серы 0), сероводород (степень окисления серы –2). Азотная кислота проявляет окислительные свойства за счет азота в высшей степени окисления +5, причем окислительная способность HNO3 усиливается с ростом ее концентрации. Состав продуктов восстановления азотной кислоты зависит от активности восстановителя, концентрации кислоты и температуры системы; чем активнее восстановитель и ниже концентрация кислоты, тем глубже происходит восстановление азота. Кислородсодержащие кислоты галогенов (например, HClO, HClO3, HBrO3) и их соли, действуя в качестве окислителей, обычно восстанавливаются до степени окисления галогена –1 (в случае хлора и брома) и 0 (в случае иода). Водород в степени окисления +1 выступает как окислитель преимущественно в растворах кислот (как правило, при взаимодействии с металлами, расположенными в ряду напряжений до водорода): Zn + H2SO4 (разб.) = ZnSO4 + H2 При взаимодействии с сильными восстановителями в качестве окислителя может проявлять себя и водород, входящий в состав воды: 2H2O + 2Na = 2NaOH + H2 H2O + NaH = NaOH + H2 Ионы металлов, находящихся в высшей степени окисления (например, Fe3+, Hg2+, Cu2+), выполняя функцию окислителей, превращаются в ионы с более низкой степенью окисления: 2FeCl3 + H2S = 2FeCl2 + S + 2HCl 2HgCl2 + SnCl2 = Hg2Cl2 + SnCl4. Среди простых веществ к типичным восстановителям принадлежат активные металлы (щелочные и щелочноземельные, алюминий, цинк, железо и др.), а также некоторые неметаллы, такие как водород, углерод (в виде угля или кокса), фосфор, кремний. При этом в кислой среде металлы окисляются до положительно заряженных ионов. В щелочной среде металлы, которые образуют амфотерные гидроксиды (например, цинк, алюминий, олово), входят в состав анионов гидроксокомплексов. Углерод чаще всего окисляется до монооксида или диоксида; фосфор, при действии сильных окислителей, окисляется до ортофосфорной кислоты. В бескислородных кислотах (HCl, HBr, HI, H2S) и их солях носителями восстановительной функции являются анионы, которые, окисляясь, обычно образуют простые вещества. В ряду галогенид-ионов восстановительные свойства усиливаются от Cl– к I–. Гидриды щелочных и щелочноземельных металлов, содержащие ион H–, проявляют восстановительные свойства, легко окисляясь до свободного водорода: CaH2 + 2H2O = Ca(OH)2 + 2H2 Металлы в промежуточной степени окисления (ионы Sn2+, Fe2+, Cu+, Hg22+ и др.), взаимодействуя с окислителями, способны повышать свою степень окисления: SnCl2 + Cl2 = SnCl4 10FeSO4 +2KMnO4 + 8H2SO4 = 2MnSO4 + 5Fe2(SO4)3 + K2SO4 + 8H2O. Окислительно-восстановительная двойственность XE " Окислительно-восстановительная двойственность " – способность одного и того же вещества, в зависимости от реагентов и от условий проведения реакции, выступать как в роли окислителя, так и в роли восстановителя. В таких веществах содержится элемент в промежуточной степени окисления. Окислительно-восстановительная двойственность характерна для простых веществ – неметаллов. Например, фосфор по отношению к металлам выступает в роли окислителя: 6e– 0 0 +2 –3 0 3P + 2Ca = Ca3P2 (P – окислитель) В то же время фосфор выступает в роли восстановителя по отношению к фтору, кислороду или хлору. Например: 20e– 0 0 +5 –2 0 4P + 5O2 = 2P2O5 (P – восстановитель) Другой пример. Азотная кислота за счет азота в высшей степени окисления +5 может выступать только в роли окислителя. В аммиаке азот в низшей степени окисления –3, и, поэтому, за счет азота аммиак может выступать только в роли восстановителя. А в азотистой кислоте HNO2 азот находится в промежуточной степени окисления +3. Азотистая кислота окисляется кислородом, и в этом случае азот – восстановитель:
+3 0 +5 –2 +3 2HNO2 + O2 = 2HNO3 (N – восстановитель) Но в реакции с сильным восстановителем, например, с иодоводородной кислотой, азотистая кислота – окислитель: +3 -1 0 +2 +3 2HNO2 + 2HI = I2 + 2NO + 2H2O (N – окислитель).
Для составления уравнений реакций (подбора коэффициентов) используют 2 способа: 1) Метод электронного баланса применяется при подборе коэф-ов в ОВР, протекающих при сплавлении или термическом разложении веществ, при обжиге, при взаимодействии металла с практически безводными кислотами. В этом методе составляют вспомогательные электронные уравнения. Пример: Составление уравнения реакции взаимодействия сероводорода с подкисленным раствором перманганата калия. Напишем схему реакции - формулы исходных и полученных веществ: Н2S + КМnO4 + Н2SО4 → S + МnSО4 + К2SO4 + Н2О Затем покажем изменение степеней окисления атомов до и после реакции:
Изменяются степени окисления у атомов серы и марганца (Н2S - восстановитель, КМnО4 - окислитель). Составляем электронные уравнения, т.е. изображаем процессы отдачи и присоединения электронов:
И наконец, находим коэффициенты при окислителе и восстановителе, а затем при других реагирующих веществах. Из электронных уравнений видно, что надо взять 5 моль Н2S и 2 моль КМnО4, тогда получим 5 моль атомов S и 2 моль МnSО4. Кроме того, из сопоставления атомов в левой и правой частях уравнения, найдем, что образуется также 1 моль К2SО4 и 8 моль воды. Окончательное уравнение реакции будет иметь вид 5Н2S + 2КМnО4 + ЗН2SО4 = 5S + 2МnSО4 + К2SО4 + 8Н2О Правильность написания уравнения подтверждается подсчетом атомов одного элемента, например кислорода; в левой части их 2*4 + 3*4 = 20 и в правой части 2*4 + 4 + 8 = 20. Переписываем уравнение в ионной форме: 5Н2S + 2MnO4- + 6H+ = 5S + 2Мn2+ + 8Н2О Известно, что правильно написанное уравнение реакции является выражением закона сохранения массы веществ. Поэтому число одних и тех же атомов в исходных веществах и продуктах реакции должно быть одинаковым. Должны сохраняться и заряды. Сумма зарядов исходных веществ всегда должна быть равна сумме зарядов продуктов реакции.
2) Метод ионно-электронного баланса (метод полуреакций) – используют при нахождении коэф-в в ОВР, происходящих в водных растворах, причем это м.б. кислые или щелочные, или растворы, близкие к нейтральным. В этом методе составляют вспомогательные ионно-электронные уравнения. Следует различать методику уравнивания в кислой и щелочной среде. Атомы элементов, изменяющие свою СО, записывают в форме тех частиц, которые реально присутствуют в водных растворах. 1 – правило уравнивания в кислой среде В ту часть полуреакции, где не хватает кислорода, ставим столько молекул воды, сколько не хватает О, а в другую часть полуреакции – соответствующее число протонов Н. KMnO4+KNO2+H2SO4 à т.к. H2SO4, => среда кислая (среду не берем, берем соли (KMnO4, KNO2), они диссоциируют)
- + +2 0 MnO4 + 8H + 5e− à Mn + 4 H2O | 2 --------------- ------------------- +7 +2 значит, + 5e− - 0 - + NO2 + H2O - 2e− à NO3 + 2H здесь слева не хватает О, значит слева + 1молекула воды, тогда справа 2Н --------------- -------------- | 5 -1 +1 значит, - 2e− Складываем обе части уравнений с коэф-ми: - + - 0 +2 0 - + 2MnO4 + 16H + 5NO2 + 5H2O à 2Mn + 8 H2O + 5NO3 + 10H Сокращаем подобные: - + - +2 0 - 2MnO4 + 6H + 5NO2 + à 2Mn + 3H2O + 5NO3 Теперь пишем молекулярную с этими кэф-ми, т.к. 6H – в кислоте, => H2SO4 с коф-м 3 2KMnO4 + 5KNO2 + 3H2SO4 à 2Mn SO4 + 3H2O + 5К NO3, (т.к. не хватает 2К и 1 SO4, то еще соль:) + К2SO4 2 – правило уравнивания в щелочной среде В ту часть полуреакции, где не хватает кислорода, ставим удвоенное произведение ОН группы, т.е. 2ОН, а в другую часть полуреакции – соответствующее число молекул Н2О. Пример: NaNO3 + MnO2 + NaOH à - - NO3 à NO2 справа добавляем 2ОН, тогда слева H2O - 0 - - NO3 + H2O + 2е− à NO2 + 2ОН --------------- -------------- | 1 -1 -3 значит, + 2e− 0 - -2 0 MnO2 + 4ОН - 2е− à MnO4 + 2H2O --------------- -------------- | 1 -4 -2 значит, - 2e− Складываем обе части уравнений с коэф-ми (в этом случае коэф-т =1): - 0 0 - - - -2 0 NO3 + H2O + MnO2 + 4ОН à NO2 + 2ОН + MnO4 + 2H2O Сокращаем подобные: - 0 - - -2 0 NO3 + MnO2 + 2ОН à NO2 + MnO4 + H2O Теперь пишем молекулярную форму с этими кэф-ми NaNO3 + MnO2 + 2NaOH à NaNO2 + Na2MnO4 + H2O Биологическая роль ОВР. Многие процессы жизнедеятельности организма в основе своей являются ОВР – процессы окисления питательных веществ, дыхание, усвоение СО2 растениями и т.п. Перенос электронов с субстрата (восстановитель) на кислород (окислитель) непрерывно осуществляется в тканях и представляет собой цепь ОВР. ОВР распространены в природе и технике, к ним относятся процессы окисления металлов (ржавление), восстановление их из руд, в т.ч. электрохимическими способами. Связывание атмосферного азота, производство различных химических препаратов (лекарств, красителей и т.п.)
Закон Рауля Франц. химик Рауль первым провёл измерения, которые позволили сформулировать законы, описывающие влияние растворённого вещества (р.в.) на физико-химические свойства растворителя (р-ля). Рассмотрим пример: В закрытый сосуд поместили чистый растворитель (вода). В такой системе происходят 2 противоположных процесса: испарение и конденсация. В определённый момент в системе устанавливается равновесие. Т.е. число частиц, которые испаряются с поверхности в единицу времени, равно числу частиц, переходящих из газовой фазы в жидкость. Пар, который находится в равновесии с жидкостью, называется насыщенным. Давление такого пара р0 называется давлением насыщенного пара чистого растворителя. При данной температуре давление насыщенного пара р-ля = const, т.е. при t = const, p0 = const. При повышении температуры давление насыщ.пара над р-лем увеличивается в соответствии с принципом Ле-Шателье. Как же изменится давление пара, если в летучий р-ль (спирт, вода) внести нелетучее вещество (в-во) (например, NaCl, сахароза)? Р-ль + р.в. = раствор (р-р) Концентрация р-ля в растворе в этом случае уменьшается, следовательно, число частиц р-ля, переходящего в газовую фазу, тоже уменьшается. Поэтому, давление насыщ.пара над раствором должно стать меньше, чем над чистым р-лем. Вывод! Чем концентрированнее раствор, тем ниже давление пара растворителя над раствором. В1886 г. Рауль сформулировал закон. Первый закон Рауля: «Относительное понижение давления насыщ. пара растворителя над раствором (р) равно мольной доле растворённого вещества» Р0 – Р / Р0 = χ2 (1), где Р0 – давление насыщ.пара чистого растворителя над растворителем Р – давление насыщ.пара растворителя над раствором Χ2 – мольная доля раств.в-ва Χ1 – мольная доля р-ля Χ1 + Χ2 = 1 Χ = ⱱр.в. / ⱱр.в. + ⱱР-ЛЯ Растворы, поведение которых описывается 1-м законом Рауля, при всех концентрациях и температурах, являются идеальными (и для реальных разбавленных р-ров (приближённо!)). Чем разбавленнее р- р, тем более он похож на идеальный. Приведём выражение (1) к другому виду: Р0 – Р = Χ2 * Р0 Р = Р0 – (Χ2 * Р0) Р = Р0 (1 - Χ2) Р = Р0 * Χ1 При постоянной температуре давление пара над р-ром приблизительно равно его концентрации в р-ре. Из закона Рауля следует, что давление пара р-ля над р-ром меньше, чем над чистым р-лем! Понятие о катализе. Увеличить скорость реакции можно с помощью катализаторов. Одни катализаторы ускоряют реакцию – положительный катализ, другие замедляют – отрицательный катализ (ингибирование). Сам катализатор в реакциях не расходуется и в конечные продукты не входит. Гомогенный катализ – катализатор и все реагирующие вещества находятся в одной фазе. Например, разложение Н2О2 (катализатор – раствор солей). Гетерогенный катализ – каталитические процессы протекают на границе раздела фаз. Например, окисление NH3(г) (катализатор – Pt(тв)); разложение Н2О2(ж) (катализатор – уголь(тв) или MnO2(тв). Поверхность катализатора неоднородна. На ней имеются активные центры, на которых главным образом протекают каталитические реакции. Реагирующие вещества адсорбируются на этих центрах, в результате увеличивается концентрация их на поверхности катализатора. А это отчасти приводит к повышению химической активности адсорбированных молекул. Под действием катализатора у адсорбированных молекул ослабляются связи между атомами и они становятся более реакционноспособными. В этом случае реакция ускоряется благодаря снижению энергии активации (в том числе за счет образования поверхностных промежуточных соединений). Таким образом, действие катализаторов сводится к уменьшению энергии активации реакции, т.е. к снижению высокого энергетического барьера. При этом образуется активированный комплекс с более низким уровнем энергии. В результате скорость реакции возрастает. Механизм действия катализаторов обычно объясняют образованием промежуточных соединений с одним из реагирующих веществ. Если реакцию А + В = АВ вести в присутствии катализатора К, то катализатор вступает в химическое взаимодействие с одним из исходных веществ, образуя непрочное промежуточное соединение: SO2 + O2 = SO3 (катализатор NO) А + К = АК: O2 + NO = NO2 Реакция протекает быстро, т.к. энергия активации этого процесса мала. Затем промежуточное соединение АК взаимодействует с другим исходным веществом, при этом катализатор высвобождается: АК + В = АВ + К: NO2 + SO2 = SO3 + NO Энергия активации этого процесса также мала, поэтому реакция протекает достаточно быстро.
ОБЩАЯ ХИМИЯ Периодический закон и периодическая система химических элементов Д.И.Менделеева. До открытия Д. И. Менделеева в науке уже были предприняты попытки классифицировать химические элементы по определенным признакам. «Свойства простых веществ, а также формы, и свойства их соединений находятся в периодической зависимости от значения зарядов ядер атомов (равному атомному номеру элемента в периодической таблице элементов)». На основе периодического закона были систематизированы элементы, или, говоря иначе, построена периодическая система химических элементов. Графическое изображение этого закона называется периодической таблицей.
|
||||
|
Последнее изменение этой страницы: 2020-11-11; просмотров: 100; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.139.234.68 (0.014 с.) |

 Окислитель
Окислитель Cr2O72– + H2O
Cr2O72– + H2O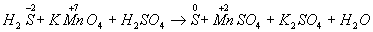
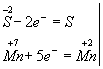
 KMnO4 K+ + MnO4− т.о. берем этот анион: справа + 4 молекулы воды, тогда слева 8 молекул Н
KMnO4 K+ + MnO4− т.о. берем этот анион: справа + 4 молекулы воды, тогда слева 8 молекул Н





