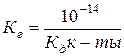Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Диссоциация – процесс обратимый. Т. Е. Идут два противоположных процесса: распад на ионы – диссоциация и соединение ионов в молекулы – ассоциация. ⇐ ПредыдущаяСтр 3 из 3
NaCl Свойство электролитов в различной степени диссоциировать на ионы выражается степенью диссоциации (т.к. только часть молекул электролита диссоциирует в растворе на ионы) – a. Степень диссоциации (a) – число показывающее, какая часть молекул распалась на ионы и равна отношению числа молекул, которые распались на ионы к общему числу молекул в растворе.
Степень диссоциации выражается в процентах от 0 до 100% или в долях от 0 до 1. Пример. 0,1М раствор уксусной кислоты со степенью диссоциации 1,36% Из 10 тыс. молекул 136 распалось. По степени диссоциации электролиты делят условно на две группы сильные и слабые. Сильные – которые в водных растворах полностью диссоциируют на ионы. Слабые – не полностью диссоциируют, т.е. часть в виде молекул, часть в виде ионов.
Степень диссоциации электролитов зависит от природы электролита и растворителя, от температуры и концентрации раствора. Она увеличивается при растворении и нагревании. Для характеристики слабых электролитов применяют константу диссоциации (константа равновесия для процесса диссоциации). Слабые электролиты диссоциируют на ионы не полностью, в их растворах устанавливается динамическое равновесие между недиссоциированными молекулами и ионами. Так, для процесса диссоциации уксусной кислоты: СН3СООН Константа равновесия
Константа диссоциации зависит от природы диссоциирующих веществ и растворителя, от температуры, и не зависит от концентрации раствора. Чем больше константа диссоциации, тем легче электролит распадается на ионы, тем больше ионов в его растворе и тем сильнее электролит. Многоосновные кислоты диссоциируют ступенчато, и каждя ступень характеризуется своим значением константы диссоциации. I. Н2СО3
II. НСО3–
Т.к. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ВОДЫ
ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ РН
Чистая вода очень плохо проводит электрический ток, но все же обладает измеримой электропроводностью, которая объясняется небольшой диссоциацией воды на ионы водорода и гидроксид-ионы: Н2О По величине электропроводности чистой воды можно вычислить концентрацию ионов Н+ и ОН– в воде. При Т = 25оС она равна 10–7 моль/л. Напишем выражение для константы диссоциации воды:
Поскольку степень диссоциации воды очень мала, то концентрация недиссоциированных молекул Н2О в воде практически равна общей концентрации воды. Концентрацию молекул воды можно рассчитать, разделив массу 1 л воды на массу ее моля:
т.е. [H2O] = 55.56 моль/л. Записав уравнение следующим образом, и подставив значения константы диссоциации и концентрации воды, получим значение для произведения концентраций ионов водорода и гидроксид ионов в воде – ионное произведение воды
Получим выражение:
В чистой воде [H+] = [OH–] = 10–7 Видно, чтобы охарактеризовать реакцию среды любого водного раствора, достаточно указать лишь концентрацию ионов водорода H+ или гидроксид–ионов OH–. За такой показатель взята концентрация ионов H+. Нейтральная среда [H+] = [OH–] = 10–7 Кислая среда [H+] > 10–7 > [OH–] Щелочная среда [H+] < 10–7 < [OH–] Для удобства, концентрацию ионов водорода характеризуют водородным показателем воды рН.
Водородный показатель – количественная характеристика среды. pH = – lg [H+] [H+] = 10–7 pH = – lg 10–7 = 7 – нейтральная [H+] = 10–3 pH = – lg 10–3 = 3 – кислая [H+] = 10–11 pH = – lg 10–11 = 11 – щелочная Запомним: в нейтральной среде рН = 7, в кислой рН < 7, в щелочной рН > 7. это можно представить в виде схемы:
Гидроксильный показатель
pOH = – lg [OH–] [ОH–] = 10–7 pОH = – lg 10–7 = 7 – нейтральная [ОH–] = 10–4 pОH = – lg 10–4 = 4 – щелочная [ОH–] = 10–12 pОH = – lg 10–12 = 12 – кислая Реакция среды устанавливается с помощью индикатора. В качестве индикаторов чаще всего применяют вещества (как правило, это сложные органические красители), способные давать с одним из реагирующих веществ легко заметную цветную реакцию. В растворе происходит диссоциация индикатора, в результате которой образуется диссоциированная форма и не распавшаяся часть, которая в разных средах приобретает различную окраску (пример с фенолфталеином).
ГИДРОЛИЗ СОЛЕЙ Взаимодействие соли с молекулами воды, в результате которого образуются кислота и (или кислая соль) и основание (или основная соль), называется гидролизом солей. Причиной гидролиза является электролитическая диссоциация соответствующих солей и воды. Вода незначительно диссоциирует на ионы Н+ и ОН–, но в процессе гидролиза один или оба из этих ионов могут «связываться» ионами подвергающейся гидролизу соли в малодиссоциированные, летучие или труднорастворимые вещества. Характер протекания гидролиза зависит от природы солей. Все многообразие гидролиза можно свести к трем типам. 1. Гидролиз соли, образованной сильным основанием и слабой кислотой: CH3COONa + H2O В результате гидролиза такой соли в растворе находится сильнодиссоциированное основание и слабодиссоциированная кислота. Следовательно, образуется больше гидроксоионов (т.к. ионы водорода выводятся из реакции) и раствор имеет щелочную реакцию.
|
||||||||||
|
Последнее изменение этой страницы: 2020-11-11; просмотров: 76; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.226.222.12 (0.01 с.) |
 Na+ + Cl–
Na+ + Cl–
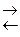 Н+ + СН3СОО–
Н+ + СН3СОО–
 (СН3СООН) = 1,8×10–5
(СН3СООН) = 1,8×10–5 Н+ + НСО3–
Н+ + НСО3–

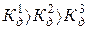 , то диссоциация протекает преимущественно по первой ступени.
, то диссоциация протекает преимущественно по первой ступени. Н+ + ОН–
Н+ + ОН–

 :
:
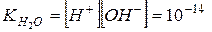
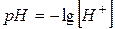

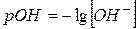
 CH3COOH + NaOH
CH3COOH + NaOH