
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Растворы. Классификация растворов.Стр 1 из 3Следующая ⇒
Лекция 4. Растворы План 1. Общие положения; 2. Способы выражения концентраций раствора; 3. Электролитическая диссоциация, рН раствора; 4. Гидролиз солей.
Растворы. Классификация растворов. Растворами называются гомогенные системы переменного состава, состоящие из двух или более компонентов. Существуют растворы твердых, жидких и газообразных веществ в жидких растворителях, а также однородные смеси (растворы) твердых, жидких и газообразных веществ. В дальнейшем мы будем рассматривать только системы с жидким растворителем. Раствор состоит из растворенных веществ и растворителя. Растворитель – компонент, который преобладает и находится в том же агрегатном состоянии, что и раствор. Истинные и коллоидные растворы В растворах вещества могут находиться в различных степенях дисперсности (т.е. раздробленности). Величина частиц служит важным признаком, обуславливающим многие физикохимические свойства растворов.
По величине частиц растворы делятся на: 1. Истинные растворы (размер частиц меньше 1 мкм) и 2. Коллоидные растворы (размер частиц от 1 до 100 мкм).
Смеси с частицами размером более 100 мкм образуют взвеси: суспензии и эмульсии.
Истинные растворы могут быть ионными или молекулярными в зависимости от того, диссоциирует ли растворённое вещество на ионы или остаётся в недиссоциированном состоянии в виде молекул.
Коллоидные растворы резко отличаются по свойствам от истинных растворов. Они гетерогенны, так как имеют поверхность раздела между фазами – растворённым веществом (дисперсной фазой) и растворителем (дисперсионной средой). В процессе растворения частицы (ионы или молекулы) растворяемого вещества под действием хаотически движущихся частиц растворителя переходят в раствор, образуя в результате беспорядочного движения частиц качественно новую однородную систему. Процесс растворения является обратимым, так как может осуществляться не только переход частиц растворяемого вещества в раствор, но и выделение частиц из раствора в результате, например, процесса кристаллизации. Через определенное время процессы растворения или выделения частиц при данных внешних условиях приводят систему к состоянию равновесия – состоянию, в котором скорости этих процессов равны. В состоянии равновесия образуются насыщенные растворы.
Насыщенным раствором называется такой раствор, который находится в равновесии с избытком растворяемого вещества – он содержит максимально возможное при данных условиях количество растворенного вещества. Если скорость растворения превышает скорость выделения, то образуются ненасыщенные растворы, если наоборот – пересыщенные. По соотношению количеств растворенного вещества и растворителя растворы подразделяют на разбавленные и концентрированные ( растворы, близкие к состоянию насыщения ). Концентрация насыщенного раствора для данного вещества при строго определенных условиях (Т, Р и растворитель) – величина постоянная и называется растворимостью вещества. Растворимость – способность вещества растворятся в растворителе. Количественной характеристикой растворимости является коэффициент растворимости. Он показывает, какая максимальная масса вещества может растворится в 1000 мл (т.е. 1 литре) растворителя при данной температуре. Растворимость выражается в г/л. По растворимости в воде вещества делятся на три группы: 1. Хорошо растворимые (в таблице растворимости обозначаются буквой «р») более 10г вещества в 1 л воды при температуре 20оС (сахар в воде); 2. Малорастворимые – «м» 0,01 – 10г на 1л воды (сульфат кальция – гипс в воде); 3. Практически нерастворимые – «н» менее 0,01 г. Растворимость зависит от природы растворителя, природы растворенного вещества, температуры и давления для газов. Так растворимость газов при повышении температуры уменьшается, а при увеличении давления увеличивается. Растворимость же многих твердых веществ при нагревании увеличивается. Зависимость растворимости от температуры показывают кривые растворимости. По ним можно определить: коэффициент растворимости веществ при различных температурах и массу растворенного вещества, которая выпадает в осадок при охлаждении раствора. Количественной характеристикой растворимости является концентрация. Концентрацией раствора называется количество растворенного вещества, содержащегося в определенном количестве раствора или растворителя.
Концентрацию раствора можно выражать по разному. 2. СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ РАСТВОРОВ Массовая концентрация, массовая доля w– отношение массы растворенного вещества m [ X ] к массе всего раствора m [ S ]
Массовая доля выражается в долях единицы или процентах. Пример. 5%-ный раствор серной кислоты в 100 граммах раствора содержит 5 грамм H2SO4 и 95 грамм растворителя – воды. Молярная концентрация, молярность СМ (М) – число молей растворенного вещества n [ X ], содержащегося в 1 л раствора V [ S ]
Различают обозначения: 0,1М – децимолярный; 0,01М – сантимолярный (0,02М – двусантимолярный); 0,001М – милимолярный. Пример. 1,5М раствор H2SO4 или СМ = 1,5 моль/л H2SO4 В 1000 мл раствора содержится 1,5 моля серной кислоты или в 1 л раствора содержится 1,5 ´ 98 = 147 г, где 98 – молярная масса серной кислоты. Для пересчета молей в граммы используем молярную массу вещества. Пример. Определите массу нитрата натрия, которая требуется для приготовления 2 л децимолярного раствора.
В 1 л раствора содержится СМ ´ М [ X ] = 0,1 ´ 85 = 8,5 г NaNO3 Составим пропорцию: в 1 л раствора содержится 8,5 г NaNO3 в 2 л раствора содержится х г NaNO3 Тогда х = 17 г нужно взять, чтобы приготовить 2 л 0,1М раствора. Эквивалентная концентрация, нормальность C Н - число эквивалентов растворенного вещества n Е, содержащихся в 1 л раствора V [ S ]
Различают обозначения: 0,1н – децинормальный; 0,01н – сантинормальный; 0,001н – милинормальный. Если в растворе содержится 1 эквивалент вещества, то это 1н раствор. Один эквивалент весит эквивалентную массу. Пример. 0,75н раствор H2SO4 или C Н = 0,75 моль/л H2SO4 В 1000 мл раствора содержится 0,75 моль серной кислоты или в 1 л раствора содержится 0,75 ´ 49 = 36,75 г, где 49 – эквивалентная масса серной кислоты. В общем виде: в 1 л раствора содержится СН ´ МЭ [ X ] в заданном V [ S ] раствора содержится х г Моляльная концентрация, моляльность Cm – число молей растворенного вещества n [ X ], приходящихся на 1 кг растворителя mP
Пример. 2m раствор H2SO4 2 моля приходятся на 1000 г растворителя (т.е. воды) Cm ´ М [ X ] приходятся на 1000 г растворителя Титр Т – показывает количество граммов растворенного вещества m [ X ], содержащихся в 1 мл раствора V [ S ]
Пример. Титр раствора равен 0,0036 г/мл. Это значит, что в 1 мл раствора содержится 0,0036г растворенного вещества. Если растворы имеют разную нормальность, то применяют: Закон эквивалентов для растворов
Объемы реагирующих веществ обратно пропорциональны их нормальностям. В растворе или расплаве ионы движутся хаотически. При пропускании через раствор или расплав электрического тока положительно заряженные ионы движутся к отрицательно заряженному электроду (катоду), а отрицательные ионы к положительному аноду. Для характеристики слабых электролитов применяют константу диссоциации (константа равновесия для процесса диссоциации). Слабые электролиты диссоциируют на ионы не полностью, в их растворах устанавливается динамическое равновесие между недиссоциированными молекулами и ионами. Константа равновесия
Константа диссоциации зависит от природы диссоциирующих веществ и растворителя, от температуры, и не зависит от концентрации раствора. Чем больше константа диссоциации, тем легче электролит распадается на ионы, тем больше ионов в его растворе и тем сильнее электролит.
ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ РН
Чистая вода очень плохо проводит электрический ток, но все же обладает измеримой электропроводностью, которая объясняется небольшой диссоциацией воды на ионы водорода и гидроксид-ионы: Н2О По величине электропроводности чистой воды можно вычислить концентрацию ионов Н+ и ОН– в воде. При Т = 25оС она равна 10–7 моль/л. Напишем выражение для константы диссоциации воды:
Поскольку степень диссоциации воды очень мала, то концентрация недиссоциированных молекул Н2О в воде практически равна общей концентрации воды. Концентрацию молекул воды можно рассчитать, разделив массу 1 л воды на массу ее моля:
т.е. [H2O] = 55.56 моль/л. Записав уравнение следующим образом, и подставив значения константы диссоциации и концентрации воды, получим значение для произведения концентраций ионов водорода и гидроксид ионов в воде – ионное произведение воды
Получим выражение:
В чистой воде [H+] = [OH–] = 10–7 Видно, чтобы охарактеризовать реакцию среды любого водного раствора, достаточно указать лишь концентрацию ионов водорода H+ или гидроксид–ионов OH–. За такой показатель взята концентрация ионов H+. Нейтральная среда [H+] = [OH–] = 10–7 Кислая среда [H+] > 10–7 > [OH–] Щелочная среда [H+] < 10–7 < [OH–] Для удобства, концентрацию ионов водорода характеризуют водородным показателем воды рН.
Водородный показатель – количественная характеристика среды. pH = – lg [H+] [H+] = 10–7 pH = – lg 10–7 = 7 – нейтральная [H+] = 10–3 pH = – lg 10–3 = 3 – кислая [H+] = 10–11 pH = – lg 10–11 = 11 – щелочная Запомним: в нейтральной среде рН = 7, в кислой рН < 7, в щелочной рН > 7. это можно представить в виде схемы:
Гидроксильный показатель
pOH = – lg [OH–] [ОH–] = 10–7 pОH = – lg 10–7 = 7 – нейтральная [ОH–] = 10–4 pОH = – lg 10–4 = 4 – щелочная [ОH–] = 10–12 pОH = – lg 10–12 = 12 – кислая Реакция среды устанавливается с помощью индикатора. В качестве индикаторов чаще всего применяют вещества (как правило, это сложные органические красители), способные давать с одним из реагирующих веществ легко заметную цветную реакцию. В растворе происходит диссоциация индикатора, в результате которой образуется диссоциированная форма и не распавшаяся часть, которая в разных средах приобретает различную окраску (пример с фенолфталеином).
ГИДРОЛИЗ СОЛЕЙ Взаимодействие соли с молекулами воды, в результате которого образуются кислота и (или кислая соль) и основание (или основная соль), называется гидролизом солей. Причиной гидролиза является электролитическая диссоциация соответствующих солей и воды. Вода незначительно диссоциирует на ионы Н+ и ОН–, но в процессе гидролиза один или оба из этих ионов могут «связываться» ионами подвергающейся гидролизу соли в малодиссоциированные, летучие или труднорастворимые вещества. Характер протекания гидролиза зависит от природы солей. Все многообразие гидролиза можно свести к трем типам. 1. Гидролиз соли, образованной сильным основанием и слабой кислотой: CH3COONa + H2O В результате гидролиза такой соли в растворе находится сильнодиссоциированное основание и слабодиссоциированная кислота. Следовательно, образуется больше гидроксоионов (т.к. ионы водорода выводятся из реакции) и раствор имеет щелочную реакцию.
Взаимный гидролиз
Гидролиз солей протекает по схемам: FeCl3 Fe+3 + HOH Na2CO3 CO3-2 + HOH При сливании солей они нейтрализуются. 2FeCl3 + 3Na2CO3 В водном растворе хлорид натрия гидролизу не подвергается, гидролиз карбоната железа протекает в одну ступень, гидролиз усиливается, за счет выпадения осадка и выделения газа. Fe2(CO3)3 + 6H2O ® 2Fe(OH)3¯ + 3H2O + 3CO2 Получаем: 2FeCl3 + 3Na2CO3 + 3H2O Для большинства солей процесс гидролиза обратим. Количественно процесс гидролиза солей можно охарактеризовать степенью гидролиза (h), показывающей отношение числа гидролизованных молекул к общему числу растворенных молекул (выражаемое обычно в %).
Лекция 4. Растворы План 1. Общие положения; 2. Способы выражения концентраций раствора; 3. Электролитическая диссоциация, рН раствора; 4. Гидролиз солей.
Растворы. Классификация растворов. Растворами называются гомогенные системы переменного состава, состоящие из двух или более компонентов. Существуют растворы твердых, жидких и газообразных веществ в жидких растворителях, а также однородные смеси (растворы) твердых, жидких и газообразных веществ. В дальнейшем мы будем рассматривать только системы с жидким растворителем.
|
||||||||
|
Последнее изменение этой страницы: 2020-11-11; просмотров: 67; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.134.78.106 (0.074 с.) |
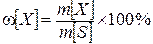
 [ моль / л; моль / см 3]
[ моль / л; моль / см 3]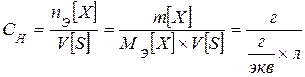 [ экв / л; моль / л ]
[ экв / л; моль / л ] [ моль / кг ]
[ моль / кг ] [ г/мл ]
[ г/мл ]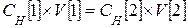

 (СН3СООН) = 1,8×10–5
(СН3СООН) = 1,8×10–5 Н+ + ОН–
Н+ + ОН–

 :
:
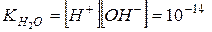
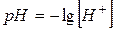

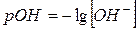
 CH3COOH + NaOH
CH3COOH + NaOH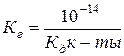
 FeOH+2 + H+
FeOH+2 + H+ 6NaCl + Fe2(CO3)3
6NaCl + Fe2(CO3)3


