
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Принцип существования энтропии идеального газа.
Энтропия
С учетом того, что для идеального газа, исходя из уравнения Клапейрона, справедливы равенства:
Правая часть уравнения (74) представляет собой сумму полных дифференциалов. Это значит, что и соотношение Изменение удельной энтропии в элементарном процессе представляет собой полный дифференциал и определяется соотношением
Из уравнения (74) после интегрирования получим, что изменение удельной энтропии идеального газа в процессе (1-2) может быть найдено из соотношения
Изобарный процесс ( Удельная термодинамическая и потенциальная работы в изобарном процессе определяются из соотношений: Количество теплоты, подведенной к рабочему телу или отведенной от него в изобарном процессе, определяется из выражения первого начала термодинамики
Так как Первое начало термодинамики: Для идеального газа:
17. Изобарный процесс изменения состояния идеального газа. Уравнение процесса, изображение в координатах T-s, связь между параметрами, работа и теплообмен, изменение функций состояния. Для идеального газа:
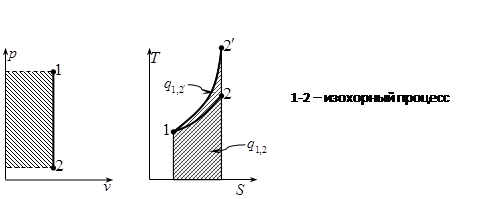
Первое начало термодинамики: Для идеального газа: 18. Изохорный процесс изменения состояния простого тела. Уравнение процесса, изображение в координатах Р-v, связь между параметрами, работа и теплообмен, изменение функций состояния. Изохорный процесс (
Удельная термодинамическая и потенциальная работы в изохорном процессе определяются из соотношений: Количество теплоты, подведенной к рабочему телу или отведенной от него в изохорном процессе, определяется из выражения первого начала термодинамики
Изохорный процесс.
19. Изохорный процесс изменения состояния идеального газа. Уравнения процесса, изображение в координатах T-s, связь между параметрами, работа и теплообмен, изменение функции состояния. Для идеального газа в изохорном процессе давление прямо пропорционально температуре рабочего тела Для идеального газа:
20. Изопотенциальный процессизменения состояния простого тела. Уравнение процесса, изображение в координатах Р-v, связь между параметрами, работа и теплообмен, изменение функций состояния. Изопотенциальный процесс – термодинамический процесс изменения состояния системы, при котором значение потенциальной функции Удельная термодинамическая и потенциальная работы в изопотенциальном процессе определяются из следующих соотношений:
Нетрудно заметить, что постоянство потенциальной функции ( Количество теплоты, подведенной к рабочему телу или отведенной от него, в изопотенциальном процессе определяется из выражения первого начала термодинамики по балансу рабочего тела: Изопотенциальный процесс.
Так как
Для идеального газа:
Первое начало термодинамики:
21,22-Изотермический процесс изменения состояния идеального газа. Уравнение процесса, изображение в координатах T-s, связь между параметрами, работа и теплообмен, изменение функций состояния.
Для идеального газа, согласно уравнению Клапейрона ( Для идеального газа:
Первое начало термодинамики:
23,(24).Адиабатический процесс изменения состояния простого тела. Уравнение процесса, показатель процесса, изображение в координатах Р-v, связь между параметрами(Работа и теплообмен, изменение функций состояния. Изображение в координатах работы и теплообмена). Адиабатный процесс - термодинамический процесс изменения состояния системы, при котором отсутствует теплообмен Из выражения первого начала термодинамики для простого тела при условии
Для адиабатического процесса
Все уравнения для политропного процесса остаются справедливы и для адиабатического процесса, только вместо политропного показателя используют адиабатический показатель. Для идеального газа
Первое начало термодинамики:
Для идеального газа: 25,26. Адиабатический процесс изменения состояния идеального газа. Уравнение процесса, показатель процесса, изображение в координатах T-s, связь между параметрами.(Работа и теплообмен, изменение функций состояния. Изображение в координатах работы и теплообмена).
Для идеального газа
Первое начало термодинамики:
27, (28). Политропный процесс изменения состояния простого тела. Уравнение процесса, показатель процесса, изображение в координатах Р-v, связь между параметрами.(Работа и теплообмен, изменение функций состояния. Изображение в координатах работы и теплообмена.) Уравнения перечисленных простейших термодинамических процессов могут быть представлены одним уравнением. Это уравнение называется уравнением политропы, а термодинамические процессы, описываемые этим уравнением, называются политропными. Политропным процессом с постоянным показателем называется обратимый термодинамический процесс изменения состояния простого тела, подчиняющийся уравнению, которое может быть представлено в следующих формах:
где п – показатель политропы, являющий в рассматриваемом процессе постоянной величиной, которая может иметь любые частные значения - положительные и отрицательные (-¥ £ n £ +¥). Постоянный показатель политропы определяется соотношением потенциальной и термодинамической работ в элементарном или конечном процессах, либо через параметры состояния
Из соотношения следует, что для изобарного процесса– n = 0, для изохорного процесса – n = ± ∞, для изопотенциального процесса– n = 1, для адиабатического процесса– n = k.
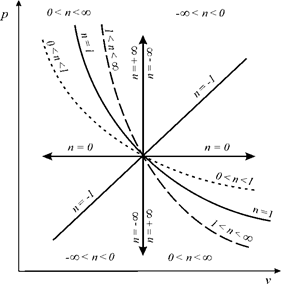
Показателем политропного процесса является линейная зависимость
1. 2.
Выражения конечных (интегральных) величин термодинамической и потенциальных работ в политропных процессах рассчитываются по следующим соотношениям
где Соотношение для определения характеристики расширения или сжатия в рассматриваемом процессе Расчетное выражения теплообмена для простых тел выводится на основе рассмотрения выражения первого начала термодинамики и имеет следующий вид
где k – показатель адиабаты, n – показатель политропы, n u – показатель изо-энергетического процесса. Расчетные зависимости показателей термодинамических процессов получаются с использованием дифференциальных соотношений уравнения состояния простого тела F (р, v, T) = 0:
Если
При этом политропный показатель может принимать значения в пределах от минус бесконечности до плюс бесконечности и оставаться постоянным в течение процесса. Если Если уравнением процесса является уравнение Для идеального газа
Работа:
Характеристика растяжения (сжатия).
29,(30). Политропный процесс изменения состояния идеального газа. Уравнение процесса, показатель процесса, изображение в координатах T-s, связь между параметрами.(Работа и теплообмен, изменение функций состояния. Изображение в координатах работы и теплоты.) Если
|
|||||||||
|
Последнее изменение этой страницы: 2020-10-24; просмотров: 181; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.16.51.3 (0.067 с.) |
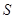 ,
, 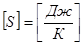 . Удельная энтропия
. Удельная энтропия 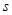 ,
, 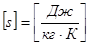
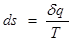
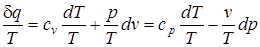 .
.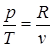 ;
; 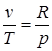 получим
получим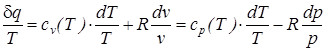 .
. 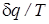 есть полный дифференциал некоторой функции состояния идеального газа(s), называемой удельной энтропией.
есть полный дифференциал некоторой функции состояния идеального газа(s), называемой удельной энтропией. . (75)
. (75)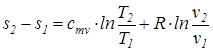 =
= 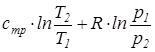 .
. 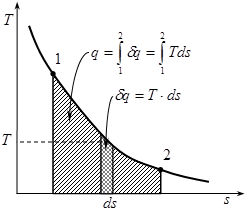 16. Изобарный процесс изменения состояния простого тела. Уравнение процесса, изображение в координатах P-v, связь между параметрами, работа и теплообмен, изменение функций состояния.
16. Изобарный процесс изменения состояния простого тела. Уравнение процесса, изображение в координатах P-v, связь между параметрами, работа и теплообмен, изменение функций состояния.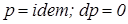 ) – процесс в котором давление в системе остается постоянным. В изобарных процессах происходит увеличение или уменьшение удельного объема, что связано изменением температуры, обусловленным подводом или отводом теплоты.
) – процесс в котором давление в системе остается постоянным. В изобарных процессах происходит увеличение или уменьшение удельного объема, что связано изменением температуры, обусловленным подводом или отводом теплоты.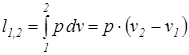 ,
, 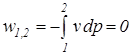 .
.  .
. 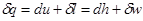 .
. 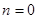
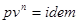


 , то
, то  .
. .
.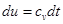 и
и 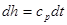
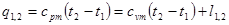 .
.
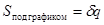
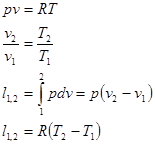
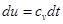 и
и  ) – процесс, при котором объем системы или удельный объем рабочего тела остается постоянным. В изохорных процессах происходит увеличение или уменьшение давления, что связано с соответственным изменением температуры – подводом или отводом теплоты.
) – процесс, при котором объем системы или удельный объем рабочего тела остается постоянным. В изохорных процессах происходит увеличение или уменьшение давления, что связано с соответственным изменением температуры – подводом или отводом теплоты.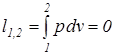 ,
, 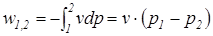 .
.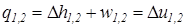 .
. 

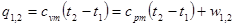
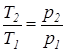 .Первое начало термодинамики:
.Первое начало термодинамики:  .
. и
и 
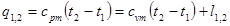 .
.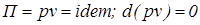 ) сохраняет неизменное значение.
) сохраняет неизменное значение.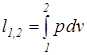 =
= 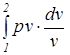 =
= 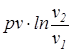 ;
; 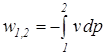 =
=  =
= 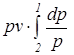 =
=  .
.  ) приводит к равенству логарифмов в выражениях в силу того, что соблюдается условие
) приводит к равенству логарифмов в выражениях в силу того, что соблюдается условие 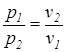 . Поэтому, в изопотенциальном процессе, численные значения термодинамической и потенциальной работ равны между собой.
. Поэтому, в изопотенциальном процессе, численные значения термодинамической и потенциальной работ равны между собой.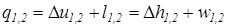 .
. 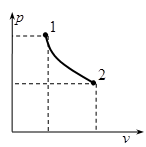


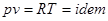 , то
, то 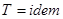 , следовательно, процесс будет также являться изотермическим.
, следовательно, процесс будет также являться изотермическим.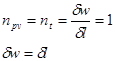
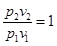

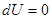 . Для идеального газа
. Для идеального газа 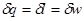 , тогда:
, тогда: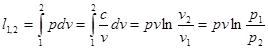 .
. ), изопотенциальный процесс (
), изопотенциальный процесс (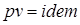 ) является и изотермическим (
) является и изотермическим (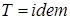 ).
).
 . Если процесс изотермический, то есть
. Если процесс изотермический, то есть 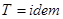 , следовательно
, следовательно  .
. и в силу обратимости процесса энтропия остается величиной постоянной
и в силу обратимости процесса энтропия остается величиной постоянной 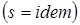 .
. имеем
имеем =0
=0  .
.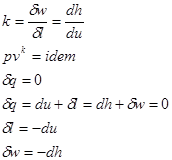
 и
и 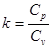
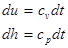
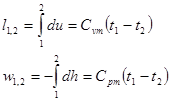
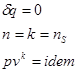

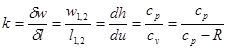
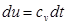 и
и 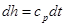 .
.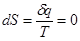
 Если
Если  , то
, то 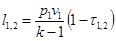 . Так как
. Так как 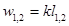 , то достаточно знать одну из работ, чтобы определить другую.
, то достаточно знать одну из работ, чтобы определить другую.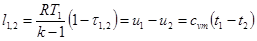
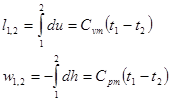
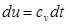 и
и  ,
, 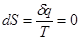
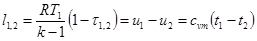
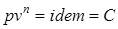 ;
; 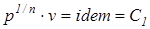 ;
; 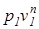 =
=  ,
,  =
= 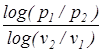
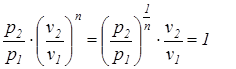
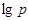 от
от  , то есть:
, то есть: 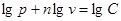 .
.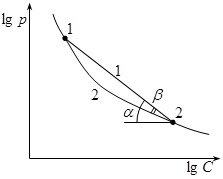
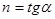
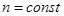

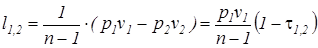 .
.  ,
, 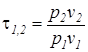 – характеристика процесса расширения или сжатия.
– характеристика процесса расширения или сжатия.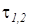 определяется с учетом зависимостей и имеет следующий вид:
определяется с учетом зависимостей и имеет следующий вид: 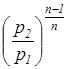 =
= 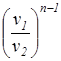 .
. 
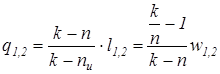 ,
, 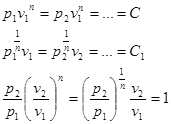
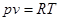 , то есть в случае идеального газа:
, то есть в случае идеального газа:
 , то
, то  , следовательно
, следовательно  , то есть процесс изохорический. Если
, то есть процесс изохорический. Если  , то
, то 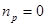 , следовательно
, следовательно 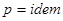 , то есть процесс изобарический. Если
, то есть процесс изобарический. Если 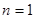 , то
, то 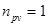 , следовательно
, следовательно 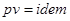 . Так как для идеального газа
. Так как для идеального газа 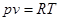 , то
, то 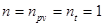 .
.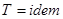 , то в этом процессе
, то в этом процессе  , следовательно
, следовательно 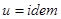 , то есть процесс изоэнергетический.
, то есть процесс изоэнергетический.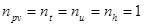 , следовательно
, следовательно  , то есть процесс изоэнтальпийный.
, то есть процесс изоэнтальпийный.
 .
.
 - для идеального газа.
- для идеального газа.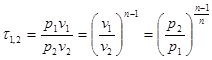
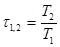 - для идеального газа.
- для идеального газа.

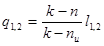 , где
, где 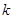 - показатель адиабаты,
- показатель адиабаты, 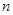 - политропный показатель,
- политропный показатель, 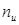 - показатель изоэнергетического процесса.
- показатель изоэнергетического процесса. - для идеального газа.
- для идеального газа.


