
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Постулат и математическое выражение 1 начала термодинамики.Содержание книги
Поиск на нашем сайте Первое начало термодинамики – это количественное выражение закона сохранения и превращения энергии. Закон сохранения и превращения энергии является универсальным законом природы и применим ко всем явлениям. Он гласит: «запас энергии изолированной системы остается неизменным при любых происходящих в системе процессах; энергия не уничтожается и не создается, а только переходит из одного вида в другой». Математическое выражение первого начала термодинамики: Внутренняя энергия изолированной системы сохраняет своё постоянное значение при всех изменениях, протекающих внутри системы, то есть Первое начало термодинамики по внешнему балансу:
В термодинамике приняты следущие знаки при определении работы и теплоты в уравнениях первого начала термодинамики: если работа выполняется телом, то она положительная; если работа подводится к телу, то она отрицательная. Если теплота сообщается телу, она имеет положительное значение; если теплота отводится от тела, она имеет отрицательное значение. Работа необратимых потерь
Подставив значение Эти уравнения называются уравнениями первого начала термодинамики по балансу рабочего тела, и справедливы для реальных процессов. В обратимых процессах 13. Первое начало термодинамики в аналитическое форме. Значения удельных внутренней энергии и энтальпии простого тела однозначно определяются двумя независимыми переменными и могут быть представлены следующим образом:
Для изохорного процесса ( а для изобарного процесса (
В результате подстановки выражений (1) и (2) в уравнение
Данное соотношение называется первым началом термодинамики для простых тел в аналитической форме.
|
||
|
Последнее изменение этой страницы: 2020-10-24; просмотров: 200; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.57 (0.006 с.) |

 . Изменение внутренней энергии неизолированной системы складывается из подведённой (отведённой) теплоты и подведённой (отведённой) работы, то есть
. Изменение внутренней энергии неизолированной системы складывается из подведённой (отведённой) теплоты и подведённой (отведённой) работы, то есть  .
.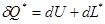 , где
, где  - теплота внешнего теплообмена, то есть количество теплоты, которая подводится извне,
- теплота внешнего теплообмена, то есть количество теплоты, которая подводится извне,  - эффективная работа, то есть термодинамическая работа без учёта работы эффективных потерь. Первое начало термодинамики по внешнему балансу справедливо для обратимых процессов.
- эффективная работа, то есть термодинамическая работа без учёта работы эффективных потерь. Первое начало термодинамики по внешнему балансу справедливо для обратимых процессов.
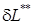 , связанная с затратами энергии на преодоление сил трения, удары, завихрения превращается в теплоту внутреннего теплообмена (
, связанная с затратами энергии на преодоление сил трения, удары, завихрения превращается в теплоту внутреннего теплообмена ( ).
). 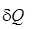 =
=  +
+  .
.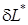 и
и 
 ;
; 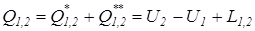 .
.  =
= 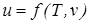 ;
;  . Изменения внутренней энергии и энтальпии простого тела, как функций состояния, в элементарных процессах являются полными дифференциалами и определяются соотношениями
. Изменения внутренней энергии и энтальпии простого тела, как функций состояния, в элементарных процессах являются полными дифференциалами и определяются соотношениями ; (1)
; (1) . (2)
. (2)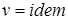 ) частная производная внутренней энергии по температуре равна истинной изохорной теплоемкости:
) частная производная внутренней энергии по температуре равна истинной изохорной теплоемкости: 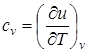 ,
, ) частная производная энтальпии по температуре равна истинной изобарной теплоемкости:
) частная производная энтальпии по температуре равна истинной изобарной теплоемкости:  .
.  и разделения переменных получим:
и разделения переменных получим: .
. 


