
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Универсальное уравнение состояния идеального газа.Стр 1 из 14Следующая ⇒
Термодинамическая система В любом явлении участвуют множество различных тел, связанных между собой. При термодинамическом изучении какого-либо явления в качестве объекта изучения выделяется группа тел, или единичное тело, или даже отдельные его части. Объект изучения называется термодинамической системой. Все, что окружает термодинамическую систему, называется окружающей средой. Термодинамическая система – совокупность макроскопических тел, обменивающихся энергией как друг с другом, так и с окружающей средой. Пример: газ, находящийся в цилиндре с поршнем, –термодинамическая система. Цилиндр и поршень, воздух, который окружает их, стены помещения, где находится цилиндр с поршнем и т. д. – окружающая среда. Виды систем По степени обмена веществом и энергией: 1) изолированная – нет взаимодействия с окружающей средой. Пример: термос; 2) закрытая – обменивается только энергией. Пример: батарея; 3) открытая – обменивается с окружающей средой и веществом, и энергией. Пример: стакан, наполненный водным раствором соли. Фаза – совокупность гомогенных частей гетерогенной системы, одинаковых по физическим и химическим свойствам, отделенная от других частей системы видимой поверхностью раздела. Фаза может быть твердой, жидкой и газообразной. По наличию границы раздела фаз: 1) гомогенная – система, внутри которой нет поверхностей, разделяющих отличающиеся по своим свойствам части системы (фазы). Пример: идеальный газ или раствор поваренной соли. Если во всех точках система имеет одинаковый состав и физические свойства одинаковы, то система называется физически однородной. 2) гетерогенная – система, внутри которой присутствует поверхность, разделяющая отличающиеся по свойствам части системы. Пример: вода и бензол, взвешенные частицы в жидкости, система из воды и льда.
Термодинамический процесс Основные термодинамические параметры состояния р, υ и Т однородного тела зависят друг от друга и связаны соотношением F (p, υ, T) = 0 – уравнение состояния. Если известно уравнение состояния, то для определения состояния простейших систем – днородных и постоянных по времени, по массе и по составу (состоящих из одной фазы и не изменяющихся химически) – достаточно знать две независимые переменные из трех: p = f 1 (υ, T); υ = f 2 (p, T); T = f 3 (υ, p).
Если внешние условия меняются, то меняется и состояние системы. Совокупность изменений состояния термодинамической системы при переходе из одного равновесного состояния в другое называется термодинамическим процессом. Равновесное состояние – состояние системы, в котором во всех ее точках давление, температура, удельный объем и другие физические параметры одинаковы. Равновесный термодинамический процесс – процесс, проходящий через равновесные состояния. Термодинамика в первую очередь рассматривает равновесные состояния и процессы изменения состояния термодинамической системы. Равновесный процесс осуществляется только в случае бесконечно медленного изменения параметров внешней среды или когда изменения параметров системы малы по сравнению со значениями этих параметров. Реальные процессы – неравновесные, поскольку под влиянием внешних условий они протекают с конечными скоростями, и равновесное состояние не успевает устанавливаться. С математической точки зрения, уравнение состояния выражает некоторую поверхность – термодинамическую поверхность. Произвольно взятое равновесное состояние – это точка на термодинамической поверхности, а совокупность этих точек при непрерывном изменении состояния – кривая, которая является графическим отображением равновесного процесса. Параметры состояния системы могут быть: 1) экстенсивные – параметры, значения которых пропорциональны массе системы (объем, энергия, энтропия и др.); 2) интенсивные – параметры, не зависящие от массы системы (р, Т и др.). Экстенсивные параметры подчиняются закону аддитивности, а интенсивные нет. Измерение экстенсивной величины – это сравнение ее с другой, однородной с ней величиной (длины с длиной, объема с объемом). Измерение интенсивной величины состоит в использовании объективной связи между изменением интенсивной и экстенсивной величины (для измерения температуры используется термометр, который фиксирует интенсивную величину – температуру путем измерения экстенсивной величины – объема ртути).
2. Основные параметры состояния. Уравнения состояния идеальных газов. Параметры состояния. Величины, которые характеризуют физическое состояние тела называются термодинамическими параметрами состояния. Такими параметрами являются удельный объем, абсолютное давление, абсолютная температура, внутренняя энергия, энтальпия, энтропия, концентрация, теплоемкость и т.д. При отсутствии внешних силовых полей (гравитационного, электромагнитного и др.) термодинамическое состояние однофазного тела можно однозначно определить 3-мя параметрами – уд. объемом (υ), температурой (Т), давлением (Р). Удельный объем– величина, определяемая отношением объема вещества к его массе. υ = V / m, [м3/кг], Плотность вещества – величина, определяемая отношением массы к объему вещества. ρ = m / V, [кг/м3], (1.2)υ = 1 / ρ; ρ = 1 / υ; υ • ρ = 1 Давление – с точки зрения молекулярно-кинетической теории есть средний результат ударов молекул газа, находящихся в непрерывном хаотическом движении, о стенку сосуда, в котором заключен газ. Р = F / S; [Па] = [Н/м2]
Внесистемные единицы давления: 1 кгс/м2= 9,81 Па = 1 мм.водн.ст.1 ат. (техн.атмосфера) = 1 кгс/см2= 98,1 кПа.1 атм. (физическая атмосфера) = 101,325 кПа = 760 мм.рт.ст.1 ат. = 0,968 атм.1 мм.рт.ст. = 133,32 Па.1 бар = 0,1 МПа = 100 кПа = 105Па.Различаютизбыточноеиабсолютноедавление.Избыточноедавление (Ри)– разность между давлением жидкости или газа и давлением окружающей реды.Абсолютноедавление (Р)– давление отсчитываемое от абсолютного нуля давления или от абсолютного вакуума. Это давление является т/д параметром состояния.Абсолютное давление определяется:1). При давлении сосуда больше атмосферного: Р = Ри+ Ро; 2). При давлении сосуда меньше атмосферного: Р = Ро+ Рв; где Ро– атмосферное давление;Рв– давление вакуума. Температура– характеризует степень нагретости тел, представляет собой меру редней кинетической энергии поступательного движения его молекул. Чем больше редняя скорость движения, тем вышетемпература тела.За т/д параметр состояния истемы принимаюттермодинамическую температуру (Т), т.е.абсолютнуютемпературу. Она всегда положительна, При температуре абсолютного нуля (Т=0) тепловые движения рекращаются и эта температура является началом отсчета абсолютной температуры.
Смеси рабочих тел Способы задания состава смеси, соотношения между массовыми и объемными долями. Вычисление параметров состояния смеси, определение кажущейся молекулярной массы и газовой постоянной смеси, определение парциальных давлений компонентов.
Способы задания смеси. Состав газовой смеси может быть задан массовыми, объемными или мольными долями. Массовой долей называется отношение массы отдельного компонента Мi, к массе смеси М: gi= Мi/M Очевидно, что Массовые доли часто задаются в процентах. Например, для сухого воздуха Объемная доля представляет собой отношение приведенного объема газа V, к полному объему смеси V: r=Vi/V. Приведенным называется объем, который занимал бы компонент газа, если бы его давление и температура равнялись давлению и температуре смеси. Для вычисления приведенного объема запишем два уравнения состояния i-го компонента: PiV=MiRiT;
PV=MiRiT. Первое уравнение относится к состоянию компонента газа в Смеси, когда он имеет парциальное давление pi и занимает полный объем смеси, а второе уравнение — к приведенному состоянию, когда давление и температура компонента равны, как и для смеси, р и Т. Из уравнений следует, что
Vi=Vpi/p.
Просуммировав соотношение (2.2) для всех компонентов смеси, получим с учетом закона Дальтона Иногда бывает удобнее задать состав смеси мольными долями. Мольной долей называется отношение количества молей Ni рассматриваемого компонента к общему количеству молей смеси N. Пусть газовая смесь состоит из N1 молей первого компонента, N2 молей второго компонента и т. д. Число молей смеси В соответствии с законом Авогадро объемы моля любого газа при одинаковых р и Т, в частности при температуре и давлении смеси, в идеально газовом состоянии одинаковы. Поэтому приведенный объем любого компонента может быть вычислен как произведение объема моля Вычисление параметров смеси · При определении молярной массы и газовой постоянной обратить внимание на способ задания смеси. · Теплоемкости компонентов смеси рассчитать с использованием закона Майера. · Для расчета параметров состояния использовать уравнение состояния идеального газа. · Правильность вычисления энергетических параметров контролировать по выполнению первого закона термодинамики. Теплоёмкость. Количество теплоты, поглощаемой телом при нагревании на 1 градус; точнее — отношение количества теплоты, поглощаемой телом при бесконечно малом изменении его температуры, к этому изменению Т. единицы массы вещества (г, кг) называется удельной теплоёмкостью, 1 моля вещества — мольной (молярной) Т. Количество теплоты, поглощённой телом при изменении его состояния, зависит не только от начального и конечного состояний (в частности, от их температуры), но и от способа, которым был осуществлен процесс перехода между ними. Соответственно от способа нагревания тела зависит и его Т. Обычно различают Т. при постоянном объёме (Cv) и Т. при постоянном давлении (Ср), если в процессе нагревания поддерживаются постоянными соответственно его объём или давление. При нагревании при постоянном давлении часть теплоты идёт на производство работы расширения тела, а часть — на увеличение его внутренней энергии (См. Внутренняя энергия), тогда как при нагревании при постоянном объёме вся теплота расходуется только на увеличение внутренней энергии; в связи с этим cp всегда больше, чем cv. Для газов (разреженных настолько, что их можно считать идеальными) разность мольных Т. равна cp — cv = R, где R — универсальная Газовая постоянная, равная 8,314 дж/(моль․ К), или 1,986 кал/(моль․ град). У жидкостей и твёрдых тел разница между Ср и Cv сравнительно мала.
Таблицы теплоёмкости Данные о теплоёмкостях различных газов приводятся в табличной форме. Обычно в таблицах приводят для различных температур значения мольной истинной и средней теплоёмкости при постоянном давлении и постоянном объёме. Указывают также средние массовые и объёмные теплоёмкости при постоянном объёме и постоянном давлении. Мольная теплоёмкость указывается в кДж/(кмоль · 0С), массовая – в кДж/(кг · 0С), объёмная – в кДж/(м3 · 0С). При этом значения объёмной теплоёмкости относят к массе газа, заключённой 1 м3 его при нормальных физических условиях. Для газов, массовая теплоёмкость которых зависит как от температуры, так и от давления, приводят значения удельного объёма и энтальпии 1 кг газа при различных давлениях и температурах. С такого рода зависимостями приходится иметь дело при изучении свойств водяного пара.
Первый закон термодинамики. Первый закон термодинамики или закон сохранения энергии для тепловых процессов, связывает количество теплоты, переданное системе, изменение ее внутренней энергии и работу, совершенную системой над окружающими телами. Одна из возможных его формулировок звучит следующим образом: Количество теплоты, сообщаемое термодинамической системе, равно сумме изменения ее внутренней энергии ΔU и работы A, совершаемой системой против внешних сил. Q = ΔU + A. Если работа совершается внешними силами над термодинамической системой, то, обозначив ее A', первый закон термодинамики можно записать в виде уравнения: Q + A' = ΔU. Если термодинамическая система остается изолированной, то есть она не обменивается теплотой с окружающими телами, не совершает работу против внешних сил и внешние силы не совершают работу над системой, то ее внутренняя энергия остается величиной постоянной. Если A (A') и (или Q) не равны нулю, то следует говорить о сохранении не внутренней энергии термодинамической системы, а внутренней энергии и энергии всех тел, участвующих в термодинамическом процессе. Если при A = 0 (A' = 0), Q ≠ 0, то теплообмен системы с окружающими телами происходит без превращения внутренней энергии в другие виды. Если при Q = 0, A ≠ 0 (A' ≠ 0), то происходит превращение одного вида энергии в другой (механической во внутреннюю и внутренней в механическую). Первый закон термодинамики связывает три величины – ΔU, A (A'), Q.
Изменение внутренней энергии ΔU термодинамической системы не зависит от способа перехода системы из одного состояния в другое, поскольку она по определению является однозначной функцией ее состояния. В отличие от ΔU, величины A и Q существенно зависят от характера процесса. Действительно, пусть газ, находящийся в цилиндре под поршнем переходит из состояния А в состояние B тремя разными способами: вдоль изотермы AB, через точку C и через точку D. В первом случае работа, совершаемая газом, равна площади фигуры, ограниченной изотермой и отрезками BV2 и AV1. Во втором случае работа, совершаемая газом, равна площади прямоугольника p1(V2 – V1). В третьем случае – площади прямоугольника p2(V2 – V1). Так как разным переходам соответствуют разные значения работы и одно и то же значение изменения внутренней энергии, то согласно первому закону термодинамики этим переходам будут соответствовать разные количества теплоты. Из сказанного, в частности, вытекает бессмысленность выражений «запас теплоты», «изменение количества теплоты», «запас работы», «изменение работы». Накопителей работы и теплоты не существует. Работа не приобретается и не расходуется, а совершается в процессе воздействия внешних тел на термодинамическую систему или термодинамической системы на внешние тела. О количестве теплоты или теплообмене можно говорить, только описывая процесс взаимодействия термодинамической системы с внешними телами, в процессе которого происходит изменение ее внутренней энергии. Теплообмен происходит при наличии разности температур участвующих в процессе тел. Результатом теплообмена является выравнивание температур. Таким образом, количество теплоты – это энергия, передаваемая от одного тела другому в процессе теплообмена, а не энергия, которой обладают тела до или после теплообмена. Первый закон термодинамики является выражением одного из наиболее общих законов природы – закона сохранения и превращения энергии в приложении к определенному и очень распространенному классу физических явлений. Энергия – это универсальная мера движения материи, которая остается постоянной при любых ее превращениях. Закон сохранения энергии говорит о несотворимости и неуничтожимости движения материи. Законы в науке отражают устойчивые, повторяющиеся связи между явлениями. В то же время законы имеют разную степень общности. Закон сохранения энергии относится к разряду наиболее фундаментальных законов природы. Он свидетельствует не только о сохранении материи и ее движения, но и о ее способности к качественным превращениям.
Срсг
ЈL СІ' Уравнения (2.43)—(2.45) — это и есть искомые условия подобия, которыми ограничивается произвольный выбор констант подобия. Рассматривая члены соотношения (2.43) попарно, получим Ci CaCf СаС - /п л -Jl. — __JLJ_5 или = 1; (2.46)
Ст С, Cf CwCt CaCt „_„ CwCi J N Л*і —=-7^-' или -7г-=1: (2-47) Cj L-i L, a Или r Cf;r - 1. (2.48) Из соотношения (2.44) Или (2.49) Ст С/' Сі -^=С9СРСЭ, или 1; (2.50) С I U' ■SJ—if-, или т^г=1; (2.51) Или (2.52) С; С; Cv Из граничных условий (2.45) получим равенство (СЯС,)/СХ = 1. (2.53) Подставим в уравнения (2.44) - (2.53) значения констант подобия, все величины сгруппируем по индексам и получим условия подобия двух систем в новом выражении: А'Х' й"Х" йХ 17 - л п ^ Jj2y = Jj2y> или -|2-= Fo = idem; (2.54) w'/' vv'7" Wl — = — или — = Ре = idem; (2.55) A a a TOC o "1-3" h z Ч'ЛІ2)' Q'»(i2) " Qj2 qj2 О.. .,, 1, = „ „ „. -, или ------------------------- — = —r— = Po = idem; (2.56) A p cpAt a p Cp At apeR At К At W'x' W" x" H'T —^ или __ — Ho = idem; (2.57) G' |У&'Г Или 2 = idem; (2.58) (Vv2)' (vv2) P' p" Или -------- j-= Eu = idem; (2.59) P'(vv2)' p"(vv2)"' pvv W'l' vv'T wl _ —— =——, или —= Re = idem; (2.60) V v v A'/' a"/" a/ Или — =Nu=idem. (2.61) Уравнения (2.54) —(2.61) иллюстрируют основное свойство подобных между собой систем — существование особых комплексов неоднородных величин, называемых критериями подобия. Критерии подобия для всех подобных между собой процессов сохраняют одно и то же числовое значение. Нулевая размерность является основным свойством критериев подобия. Критерии подобия принято называть именами выдающихся ученых. Так, критерий Fo называют критерием Фурье, Ре — критерий Пекле, Ро - критерий Померанцева, Ей — критерий Эйлера, Re — критерий Рейнольдса, Nu - критерий Нуссельта. Если некоторая система основных уравнений содержит J критериев К, то, очевидно, условиям = idem, К2 ~ idem,= idem эквивалентны условия Ki/Kj = idem, K2/Kj = idem и т. д. Отсюда следует, что критерии подобия можно комбинировать и при этом получать новые критерии подобия. Так, критерий Прандтля (Рг) может быть получен, как Pe/Re = (Wl/A):(Wl/V) — V/A = Pr; Pr = V/A. Другой важный критерий получим, если в комплексе (2.58) умножением на Re2 исключим скорость: (GP&L/W2) Re2 = д 30/3/v2 = Gr. Полученный критерий называют критерием Грасгофа Gr = G$§P/V2. Критерии подобия можно получить для любого явления, для которого имеется аналитическая зависимость между переменными изучаемого явления. Физический смысл критериев следует из их записи, а также исходных уравнений, из которых они получены. Критерии Fo, Ре, Ро являются критериями теплового подобия, а критерии Ей и Re — критериями гидромеханического подобия. Критерий Фурье Fo = (ах)/12 имеет смысл обобщенного времени. Поэтому его называют числом тепловой гомохронности (однородности по времени; если для двух систем отношение (12/а) одинаково, то для них гомохронность переходит в синхронность). Критерий Fo характеризует связь между скоростью изменения температурного поля, физическими свойствами и размерами тела. Критерий Померанцева Ро имеет смысл обобщенной интенсивности внутренних источников теплоты в условиях нестационарного температурного поля. Критерий Ро характеризует отношение количества теплоты, выделяемой в единицу времени в объеме 1 м2-1, к максимально возможному количеству теплоты, передаваемой теплопроводностью через единицу поверхности 1 м2 при толщине стенки I. Критерий Пекле Ре = Wl/A является мерой отношения конвективного и молекулярного переносов теплоты в потоке. Критерий гидродинамической гомохронности Но характеризует скорость изменения поля скоростей течения среды во времени (ускорение поля w). Критерий Грасгофа Gr = G$&L3/V2 является мерой отношения подъемной силы, возникающей вследствие разности плотностей жидкости, к силе вязкого трения. Критерий Эйлера Eu = р/(pvv2) характеризует подобие полей давления и является мерой отношения сил давления и инерционных сил или, другими словами, — отношения перепада статических давлений в потоке жидкости к динамическому давлению. Критерий Рейнольдса Re = (wl)/v характеризует гидродинамический режим потока, являясь мерой отношения сил инерции и сил вязкого трения. Критерий Прандтля Pr = V/A является мерой подобия температурных и скоростных полей в потоке: при Рг = 1 и grad р = 0 поля температур и скоростей подобны: Dt/ Dx = AV2T и Dw/ Dx = vV2w, Критерий Прандтля составлен из физических параметров, поэтому сам является физи- 125 Ческим параметром. Для вязких жидкостей Pr > 1 и сильно зависит от Температуры, для газов мало зависит от температуры и для данного газа определяется его атомностью. В соответствии с кинетической теорией газов величина Рг равна: для одноатомных газов — 0,67, для двухатомных — 0,72, для трехатомных - 0,8 и для многоатомных — 1,0. Для жидких металлов Рг «0,005... 0,05, что объясняется высокой теплопроводностью металлов. Критерии, представляющие собой безразмерную форму условий однозначности, называются определяющими. По существу, критериями подобия являются только определяющие критерии, составленные из заданных постоянных величин. Из этого следует, что понятие «определяющий» не является свойством, присущим определенным критериям. В этом смысле, например, комплекс ах/12 является не критерием, а обобщенной переменной или числом Фурье. Однако если по условию задачи задано некоторое характерное время — пусть период колебания температуры окружающей среды т0, то ах0/12 будет критерием. В задачах конвективного теплообмена Nu есть определяемая величина, безразмерный искомый коэффициент теплоотдачи — число Нус - сельта. В задачах нестационарной теплопроводности в твердом теле [уравнение (2.40) при vv = 0 и граничных условиях (2.42)] аналогичный по форме комплекс а 1/Х является определяющим критерием Био Ві = а 1/Х. В отличие от числа Nu в критерии Био X — теплопроводность твердого тела, а значение а входит в условия однозначности. Критерий Био характеризует отношение термического сопротивления стенки 1/Х к термическому сопротивлению теплоотдачи на поверхности (1/а), причем оба сопротивления заданы по условию задачи. Основные положения теории подобия формулируются в виде трех теорем. Первая теорема подобия формулируется так. Подобные между собой явления имеют одинаковые критерии подобия. Теорема устанавливает связь между константами подобия и позволяет выявить критерий подобия. Теорема, кроме того, показывает, что в опытах надо измерять те величины, которые содержатся в критериях подобия изучаемого явления. Вторая теорема подобия устанавливает возможность представления интеграла как функции от критериев подобия дифференциального уравнения. Уравнение, представляющее зависимость между безразмерными параметрами (критериями), называется критериальным уравнением (Ки К2,..., Kj) = 0 (2.62) Вторая теорема подобия позволяет сократить число переменных в задачах теплообмена и тем самым существенно упростить их решение. В самом деле, как следует из дифференциальных уравнений теплообмена, коэффициент теплоотдачи есть сложная функция большого числа переменных: «= /(*, Тж, Тс, X, Ср, р, р,/, J3,...). В критериальной форме эта зависимость может быть представлена Nu = / (Re, Gr, Pr). Для вынужденного движения, как будет показано ниже, Nu = = / (Re, Pr), для естественной конвекции Nu = / (Gr, Pr). Для газа эти зависимости упрощаются и соответственно имеют вид Nu = /(Re), Nu = / (Gr). В задачах нестационарной теплопроводности в твердом теле температура определяется уравнением T=F(K, с, р, /, х, а). В безразмерном виде число переменных сокращается до двух: 0 = / (Fo, Bi). Если вид функции уравнения (2.62) найден для частного случая, то полученный результат распространяется на бесчисленное множество подобных явлений. Третья теорема подобия формулируется так: подобны те Явления, которые имеют подобные условия однозначности и одинаковые определяющие критерии. Теорема позволяет установить группу явлений, подобных изучаемому образцу, и заключается в установлении условий, необходимых и достаточных для того, чтобы другие явления были подобны первому. Третью теорему, установленную М. В. Кирпичевым и А. А. Гухмаиом, иногда называют обратной, в отличие от первой, прямой. Содержание этой теоремьі лежит в основе моделирования — метода экспериментального изучения модели явления.
Теплообмен при вынужденном движении теплоносителей: теплообмен при движении теплоносителя вдоль плоской поверхности; теплообмен при течении жидкости в трубах; теплообмен при поперечном омывании одиночной круглой трубы и при поперечном омывании пучков труб, коридорно и шахматно расположенных. Критериальные уравнения. Теплообмен при изменении агрегатного состояния. Теплообмен между движущейся средой и поверхностью твердого тела называется конвективным теплообменом или теплоотдачей. Конвективный теплообмен обусловлен совместным действием конвективного и молекулярного переноса теплоты (теплопроводности). Под конвективным переносом теплоты в среде с неоднородным распределением температуры понимают перенос, осуществляемый макроскопическими элементами среды при их перемещении, движении. Различают движение вынужденное и свободное. Под вынужденным движением или вынужденной конвекцией жидкости понимают движение, вызванное действием внешних сил, приложенных на границах системы, поля массовых сил, приложенных к жидкости внутри системы, или за счет кинетической энергии, сообщенной жидкости вне системы. Свободное движение или свободная (естественная) конвекция жидкости — движение под действием неоднородного поля массовых сил, приложенных к частицам жидкости внутри системы и обусловленных внешними полями (например, гравитационным). Различают ламинарный и турбулентный режимы течения. При ламинарном режиме характер течения спокойный, слоистый, без перемешивания (от лат. lamina — полоска, слой). Ламинарное движение жидкости - это движение, при котором возможно существование стационарных траекторий ее частиц, часто повторяющих профиль канала.
При турбулентном движении течение жидкости неупорядоченное, вихревое (от лат. turbulentus - бурный, беспорядочный), с хаотично Переход ламинарного режима течения в турбулентный определяется значением числа Рейнольдса, которое называется критическим ReKp = vvKp//v. Чем больше Re, тем больше силы инерции по сравнению с силами вязкости, тем больше турбулентность потока. Режим движения жидкости, промежуточный между ламинарным и турбулентным, называется переходным. Течение жидкости состоит из основного потока и пограничного слоя. На твердой поверхности вследствие действия сил вязкого трения образуется тонкий слой заторможенной жидкости. Частицы жидкости, непосредственно прилегающие к поверхности теплообмена, как бы прилипают к ней. С возрастанием сил вязкости и, следовательно, с уменьшением числа Re происходит утолщение пограничного слоя. Чем больше Re, тем тоньше пристеночная область течения, тем тоньше пограничный слой. Несмотря на то что пограничный слой остается тонким (а измерение скоростей показывает, что толщина его порой составляет несколько молекулярных слоев жидкости), он играет большую роль в процессах конвективного теплообмена. Различают динамический и тепловой пограничные слои. Динамическим пограничным слоем называют пограничный слой жидкости, характеризующийся большим градиентом продольной составляющей скорости. Тепловой пограничный слой характеризуется большим градиентом температуры, под действием которого осуществляется поперечный перенос теплоты. В области, непосредственно прилегающей к поверхности теплообмена, температура изменяется от гж — температуры основного потока до температуры стенки Tc. За пределами теплового пограничного слоя температура однородна и там явление переноса теплоты отсутствует. Тепловой пограничный слой по толщине 8Х может совпадать или не совпадать с динамическим 8 (рис. 2.28, 2.29). Соотношения толщин теплового и динамического пограничных слоев определяются значением числа Pr = V/A. Как было показано выше, расчет теплоотдачи, несмотря на большую сложность процесса, проводится по формуле Ньютона - Рихмана
П ІП
Tr
У//////////////////Ш л Рис. 2.28. Схема динамического пограничного слоя Ш////////////У/////////Л х Рис. 2.29. Схема теплового пограничного слоя Достаточно простого вида Q = а(гс~гж). (2.229) Вся сложность расчета состоит в определении коэффициента теплоотдачи. Согласно (2.229), коэффициент теплоотдачи определяется как плотность теплового потока при температурном напоре, равном одному градусу. Перенос теплоты в вязком пограничном слое осуще в - ляется путем теплопроводности и в соответствии с законом Фурье определяется соотношением Q = - X Dt/Dy. (2.230) Сравнивая (2.229) и (2.230), получим коэффициент теплоотдачи (2.231) T-IK В первом приближении можно принять градиент температуры в тепловом пограничном слое равным Grad T = BjlJs., (2.232) Ду 8Т В этом случае коэффициент теплоотдачи будет определяться соотношением Ос = У8Т. (2.233) Величина а зависит от всех факторов, влияющих на сам процесс теплообмена. К ним относятся скорость движения жидкости, физические свойства теплоносителя, характеристики температурного поля и гидродинамические характеристики потока, геометрическая форма Ф и размеры / поверхности теплообмена: Ос =/(<•„, р, р, X, w, t, Ф, I, р, (2.234) Классификация задач конвективного теплообмена отражает преобладающее влияние перечисленных факторов. Для некоторых частных случаев эти задачи при упрощающих предпосылках могут быть решены аналитически методами теории пограничного слоя. В общем случае для этой цели используется экспериментальный путь определения а с применением теории подобия. Порядок величины а [Вт/(м2 • К)] для различных условий конвективного теплообмена лежит в пределах: Свободная конвекция в газах...................................................................... 5...30 Свободная конвекция для воды....................................................... 102...103 Вынужденная конвекция газов........................................................ 10...500 Вынужденная конвекция для воды......................................................... 500...104 Теплообмен при изменении агрегатного состояния воды (кипение, конденсация) 103... 105 Решение задачи конвективного теплообмена чаще всего дается в критериальной форме. Так, для теплоотдачи при свободной конвекции определяющим критерием является число Грасгофа и расчетное уравнение имеет вид N U A./ —f(Gr, Рг)ж/. Для вынужденного движения определяющим критерием является число Рейнольдса: Nu./X, = /(Re, Рг)ж(. (2.236) Для газов эти формулы могут быть упрощены, так как для газов число Прандтля слабо зависит от температуры. В этом случае зависимости будут соответственно: Nu,, =/(Сг)ж); (2.237) Миж/=ДКе)ж/. (2.238) Индексы у критериев указывают на определяющую среднюю температуру жидкости гж, которая может быть получена принятым способом осреднения, и определяющий геометрический размер I. Определение а и теплового потока на поверхности теплообмена является основной задачей теории конвективного теплообмена. Теплоотдача при вынужденном движении жидкости вдоль плоской поверхности. При движении жидкости вдоль плоской поверхности профиль распределения продольной скорости поперек потока изменяется по мере удаления от передней кромки пластины. Если скорость в ядре потока Н'о, то основное изменение ее происходит в пограничном слое толщиной 8, где скорость уменьшается от w0 до wx = 0 на поверхности пластины. Течение в пограничном слое может быть как ламинарным, так и турбулентным. Режим течения определяется критическим значением критерия Рейнольдса, нижний предел которого для ламинарного пограничного слоя равен ReKp = 8 • 104, а при Re > 3-Ю6 вдоль пластины устанавливается устойчивый турбулентный режим течения. При значениях 8 • 104 < Re < 3 • 10б режим течения — переходный (рис. 2.30). В турбулентном пограничном слое непосредственно на поверхности пластины имеется весьма тонкий слой жидкости толщиной 0,0018......0,018, называемый ламинарным подслоем, в котором силы вязкого Трения играют преобладающую роль.
При оценке толщины 8 пограничного слоя исходят из определения такой области течения, в пределах которой изменение силы вязкого трения по нормали к поверхности и изменение инерционной силы по направлению движения жидкости — величины одного порядка. Деление потока на вязкий пограничный слой и внешний потенциальный поток позволяет упростить математическое описание движения В процессе теплообмена наряду с динамическим слоем формируется тепловой пограничный слой. В пределах теплового слоя температура жидкости изменяется от температуры твердой поверхности fc до значения температуры невозмущенного потока жидкости T,K. Тепловой пограничный слой характеризуется большим поперечным градиентом температуры Dt/бу. За пределами теплового пограничного слоя толщиной 8, температура однородна и там явление переноса теплоты не возникает. Тепловой пограничный слой образуется аналогично динамическому. По мере удаления от передней кромки пластины толщина теплового пограничного слоя растет 8, —- F(X) вследствие возрастающего влияния поверхности пластины на прогрев жидкости. При турбулентном пограничном слое основное изменение температуры происходит в пределах вязкого ламинарного подслоя.
|
|||||||||||||||||||||||
|
Последнее изменение этой страницы: 2020-10-24; просмотров: 163; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.70.132 (0.138 с.) |
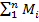 и
и 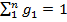 .
.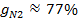 ;
; 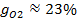 .
. , откуда
, откуда 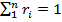 . Объемные доли также часто задаются в процентах. Для воздуха rO2=21%, rN1=79%.
. Объемные доли также часто задаются в процентах. Для воздуха rO2=21%, rN1=79%.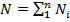 , а мольная доля компонента будет равна Ni/N.
, а мольная доля компонента будет равна Ni/N.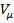 на число молей этого компонента, т. е.
на число молей этого компонента, т. е. 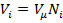 ,а объем смеси — по формуле
,а объем смеси — по формуле 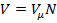 . Тогда ViV=ri=Ni/N, и, следовательно, задание смесильных газов мольными долями равно заданию ее объемными долями.
. Тогда ViV=ri=Ni/N, и, следовательно, задание смесильных газов мольными долями равно заданию ее объемными долями.


