Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Роль отечественных ученых в развитии биохимии.Содержание книги
Поиск на нашем сайте
Роль отечественных ученых в развитии биохимии. 1.3 Разделы биохимии. Значение биохимии для других специальных дисциплин (зоопсихология, кормление животных, кинологии). Периоды развития биохимии. Дать понятие растворов. Особенности строения молекул воды. Классификация растворов. Диффузия и осмос. Осмотическое давление в растворах электролитов. Роль осмотического давления в животном организме. Изотонические, гипо- и гипертонические растворы. Понятие гемолиза и плазмолиза. Теория электролитической диссоциации. Ионное произведение воды и его следствия. Водородный показатель. 2.13 Методы определения рН. Значение реакции среды в биохимических процессах. Механизм действия буферных растворов. Буферные системы крови. Характеристика коллоидных состояний веществ. Условия, необходимые для получения коллоидных растворов. Методы получения коллоидных растворов. Методы очистки коллоидных растворов. Механизм адсорбции. Адсорбционная хроматография. Строение коллоидной мицеллы. Факторы устойчивости коллоидных растворов. Механизм коагуляции под действием электролитов. Коллоидная защита. Студни. Методы получения студней. Общая характеристика углеводов, их роль в питании и жизнедеятельности организма. Классификация углеводов. Моносахариды, их типы и классификация по числу атомов углерода. Триозы, их строение. Характеристика и строение пентоз. Характеристика и строение гексоз. 3.7. Общая характеристика и образование дисахаридов (мальтозы, лактозы, целлобиозы и галактозы). Общая характеристика полисахаридов и классификация. Характеристика, строение и роль крахмала, целюллозы и инулина в питании животных. Характеристика и строение гликогена. Строение и роль в организме гепарина, гиалуроновой, хондроитинсерной кислоты. Химизм переваривания углеводов. Особенности переваривания углеводов у разных видов животных. Пути использования всосавшейся глюкозы. Роль печени в углеводном обмене. Содержание гликогена в печени и мышцах. Роль гликогена в мышечной ткани. Гликонеогенез. Пути расщепления углеводов в организме. Гликогенолиз. Гликолиз. Цикл трикарбоновых кислот. Пентозофосфатный путь окисления глюкозы и его роль в организме. Регуляция углеводного обмена. Действие инсулина на углеводный обмен. Антагонисты инсулина по действию на углеводный обмен. Нарушение углеводного обмена. Гипогликемия, гипергликемия, глюкозурия. Гипогликемия. Общая характеристика белков, их значение и функции в организме. Свойства белков. Классификация и строение аминокислот. Незаменимые, частично заменимые и заменимые аминокислоты. Полноценные и неполноценные белки. Полипептидная теория строения белков. Уровни структурной организации молекулы белка, специфичность его строения. Классификация белков. Характеристики протеинов. Характеристика и строение нуклеопротеидов. Характеристика и строение хромопротеидов, фосфопротеидов, липопротеидов, гликопротеидов. Строение ДНК, её роли и функции. Строение РНК, её роль и функции. Переваривание белков. Всасывание белков. Гниение белков в толстом отделе кишечника. Особенности переваривания белков у разных видов животных. Превращение кормового белка в рубце жвачных Дезаминирование аминокислот. Синтез заменимых аминокислот. Пути обезвреживания аммиака в организме. 4.18 Орнитиновый цикл синтеза мочевины – Количественная сторона белкового обмена, баланс азота. Нарушение и регуляция белкового обмена. Общая характеристика. Биологическая роль липидов. Классификация липидов. Строение нейтрального жира. Характеристика высших жирных кислот. Структурные и запасные жиры. Стерины и стериды. Воски. Глицерофосфоолипиды. Лецитин, кефалин, серинфосфолипиды, инозитфосфолипиды. Регуляция липидного обмена. Патология липидного обмена. Биохимия печени. Биохимия костной ткани. Биохимия нервной ткани. Биохимия яйца. 1.1 Понятие, задачи, предмет, методы, содержание и компетенции дисциплины «Биологическая химия». Биологическая химия — это наука о молекулярной сущности жизни. Наука, изучающая химический состав, структуру и свойства компонентов протоплазмы, обмен веществ и энергии в живом организме. Главной задачей биохимии является установление связи между молекулярной структурой и биологической функцией химических компонентов живых организмов. Современную биологическую химию условно делят на 3 крупных раздела: 1. Статическая биохимия исследует химический состав организма (качественный состав и структура соединений, количественное их содержание в биологических объектах); 2. Динамическая биохимия изучает превращения химических соединений и связанные с ними превращения энергии в организме; 3. Функциональная биохимия вскрывает связи между структурой химических соединений и процессами их превращений, функцией тканей и органов. Деление условно, т.к. все разделы тесно связаны и взаимно дополняют друг друга. Биохимия развивается очень интенсивно и имеет большое практическое значение для животноводства, генетики, микробиологии, вирусологии, ветеринарии. Являясь в своей основе химической наукой, биохимия широко использует химические и физико-химические методы исследований: · колориметрический анализ, · различные виды хроматографии, · избирательную адсорбцию, · электрофорез, · электронную микроскопию. Вместе с тем у биохимии выработались и свои специфические методы исследований. Главные особенности этих методов - применение щадящих способов выделения веществ, лиофильное высушивание биологического материала и использование защитных добавок с целью сохранения нативных свойств изучаемых веществ.
Периоды развития биохимии. I период – с древних времен до эпохи Возрождения (XV век). Это период практического использования биохимических процессов без знаний их теоретических основ и первых, порой очень примитивных, биохимических исследований. Люди уже знали технологию производств, основанных на б/х процессах, таких как хлебопечение, сыроварение, виноделие, дубление кож, приготовления красок и тканей из растений. попытки понять свойства отдельных веществ растительного и животного происхождения. II период – начало эпохи Возрождения до 2-я пол. 19 в. - б/х становится самостоятельной наукой. да Винчи провел опыты и на основании их результатов сделал важный для тех лет вывод, что живой организм способен существовать только в такой атмосфере, в которой может гореть пламя. В этот период следует выделить работы таких ученых, как Парацельс, М. В. Ломоносов, Ю. Либих, А. М. Бутлеров, Лавуазье. II I период – 2-я пол. 19 века- 50-е г. 20 в. Резкое увеличение интенсивности и глубины биохимических исследований, объема получаемой информации, использование достижений б/х в промышленности, медицине, с/х. К этому времени относятся работы одного из основоположников отечественной биохимии А. Я. Данилевского, М. В. Ненцкого IV период – с начала 50-х гг. 20 в.- по наст. время. широкое использованием в б/х исследованиях физических, физико-химических, математических методов, активным и успешным изучением основных биологических процессов (биосинтез белков и нуклеиновых кислот) на молекулярном и надмолекулярном уровнях. 1953 –Уотсон и Крик предложили модель двойной спирали строения ДНК. 1953 – Сенгер впервые расшифровал аминокислотную последовательность белка инсулина. 1961 – Ниренберг расшифровал первую «букву» кода белкового синтеза – триплет ДНК, соответствующий фенилаланину. 1966 – Митчелл сформулировал хемиосмотическую теорию сопряжения дыхания и окислительного-фосфорилирования, сформулирована первая классификация ферментов. 1969 – Мерифильд химическим путем синтезировал фермент рибонуклеазу. 1971 –установлена первичная структура аспартатаминотрансферазы – белка из 412 аминокислот. 1977 – Сенгер впервые полностью расшифровал первичную структуру молекулы ДНК. 2.1 Дать понятие растворов. Растворы – однородные системы, состоящие из растворенного вещества, растворителей и продуктов их взаимодействия. Растворы по факту- это все биологические жидкости организма.
2.2 Особенности строения молекул воды. Молекулы воды полярные, т.е. 1 частица заряжена положительно, а 2 отрицательно, имеют малый заряд и соединяются водородными связями. Диполь, попадая в электрическое поле, притягивается к противоположным полюсам. Прочность межионных связей уменьшается, ионы отрываются и переходят в раствор. (Диполь – центры отрицательных и положительных зарядов в молекуле находятся в разных местах).
2.3 Классификация растворов. В основе лежит размер частиц растворенного вещества (от размера дисперсионной фазы). Все р-ры делят на 4 группы: 1. Молекулярно-дисперсная – р-р частиц <0,0014 микрон. 2. Ионодисперсные р-ры – 0,001 микрон. 3. Коллоидные р-ры – 0,1 – 0,001 микрон. 4. Грубо дисперсные р-ры - >0,1 микрона. Система, состоящая из двух (и более) веществ, одно из которых распределено в виде очень мелких частиц в другом, называется дисперсной системой. Распределенное вещество называется дисперсной фазой, а вещество, в котором распределена дисперсная фаза, — дисперсионной средой.
2.4 Диффузия и осмос. Диффузия. Одним из основных свойств живых клеток является перенос веществ через мембрану. Мембрана – 2й слой фосфолипидов, который состоит из простых жиров и белковых молекул. Диффузия является механизмом, с помощью которого вещества перемещаются через мембрану. Диффузия – самопроизвольный процесс выравнивания концентрированного вещества по всему объему растворителя за счет теплового движения молекул. Осмос – частный случай диффузии или односторонняя диффузия. Наблюдается при наличии полупроницаемой мембраны. Процесс перехода растворителя (воды) в сторону наиболее концентрированного раствора. 2.6 Осмотическое давление в растворах электролитов. Осмотическое давление для электролитов всегда выше, т.к. количество частиц в электролитах постоянно растет. Для электролитов введен изотонический коэффициент, который показывает во сколько раз осмотическое давление электролитов выше, чем неэлектролитов. Р = I * R * C * T. К электролитам относятся кислоты, основания и почти все соли, к неэлектролитам — большинство органических соединений, а также вещества, в молекулах которых имеются только ковалентные неполярные. Сила, обуславливающая осмос, есть осмотическое давление. Закон осмотического давления Вант – Гоффа: осмотическое давление зависит от разбавленного раствора прямо пропорционально молярной концентрации и температуре. P = R (универс газ пост) * С (моляр конц) * Т (t абс 0 по Кельвину = 273).
2.7 Роль осмотического давления в животном организме. Явление осмоса и осмотическое давление играют огромную роль в биологических системах, которые содержат полупроницаемые перегородки в виде разных тканей, в том числе оболочек клеток. Постоянный осмос воды внутрь клеток создает избыточное гидростатическое давление, которое обеспечивает прочность и упругость тканей, которое называют тургором.
2.8 Изотонические, гипо- и гипертонические растворы. Окружающий клетку раствор может быть по отношению к раствору клетки: 1. Изотонический (Pср = Pкл). Ничего не происходит, вода входит/выход с одинаковой скоростью. 2. Гипертонический (Pср > Pкл). Вода выходит, эритроцит смарщивается, происходит явление плазмолиза. 3. Гипотонический (Pср < Pкл). Вода входит, эритроцит набухает, происходит явление гемолиза. Гипертонический раствор может помочь при воспалительных процессах в суставах, гнойниках, при ангине и тонзиллите, головной боли. В медицинской практике гипотонические растворы имеют ограниченное применение. Для ликвидации обезвоживания применяют только гипотонические растворы хлорида натрия, иногда в течение нескольких дней до восстановления сознания.
2.9 Понятие гемолиза и плазмолиза. Плазмолиз (разложение, распад), отделение протопласта от клеточной стенки в гипертоническом растворе. Гемолиз (распад, разрушение) — разрушение эритроцитов крови с выделением в окружающую среду гемоглобина. В гипотоническом растворе происходит гемолиз (разрушение, растворение) эритроцитов, ибо осмос направлен в клетку. Эритроциты набухают, клеточная оболочка (мембрана) разрывается и содержимое клетки растворяется. В гипертоническом растворе эритроциты сморщиваются, теряют первоначальную форму (плазмолиз) в силу того, что осмос направлен из клетки в раствор.
2.10 Теория электролитической диссоциации. В ионно-дисперсных растворах частицы растворенного вещества находятся в виде ионов. К ним относятся все электролиты. Теорию электролитической диссоциации разработал Аррениус в 1887 году. Согласно этой теории молекулы электролитов в воде распадаются на ионы (катионы +, анионы -). Причиной диссоциации является физико-химический процесс взаимодействия электролита (гидротация) с водой. Количественная характеристика диссоциации – степень диссоциации. Степень диссоциации рассчитывается: α = кол-во молекул, распавшихся на ионы / на общее количество молекул. Степень диссоциации определяется опытным путем и выражается в долях единиц или в %. Например, α = 5%, это значит, что из 100 молекул только 5 распались. α зависит: от природы растворителя, от природы электролита, от температуры раствора и от степени разбавления водой. По природе все электролиты делятся на: сильные (α > 30%. HCL, H2SO4, HNO3, почти все щелочи); средние (α от 2 до 30%. H3PO4, H2SO3); слабые электролиты (α < 2%. CH3COOH, H2CO3). Константа диссоциации. Сильные электролиты в воде полностью диссоциируют на ионы, а слабые частично. Диссоциация слабых электролитов выражается следующим уравнением: КА ó К(+) + А (-). Диссоциация – распад молекул на ионы. Обратный процесс – молизация. Через время скорость этих 2 процессов выравнивается и наступает состояние химического равновесия. Химическое равновесие – в одинаковый промежуток времени сколько молекул образовалось, столько и распадается. Для всякого обратного процесса применим закон действующих масс. В состоянии химического равновесия произведение концентрации продуктов реакции, деленное на произведение концентрации продуктов исходных веществ, есть величина постоянная и называется константой равновесия. А для диссоциации – константа диссоциации. КД = [К+]*[А-] / [КА]. КД характеризует способность электролита диссоциировать на ионы, является характеристикой силы электролита, при чем более удобной, чем α, т.к. КД не зависит от разбавления водой. Группы электролитов по КД: 1. Сильные (КД>10-2). 2. Средние (КД от 10-2 до 10-4). 3. Слабые (КД от 10-5 до 10-9). 4. Очень слабые (КД<10-9) Буферные системы крови. БИКАРБОНАТНАЯ – основной внеклеточный буфер (работа почек/легких) НСО3/Н2СО3. При аэробном окислении углеводов/жиров/белков образуются СО2, Н2О, которые реагируют между собой с образованием угольной кислоты, она же диссоциирует – СО2+Н2О => Н2СО3+НСО3 + Н. Концентрация бикарбоната в крови постоянна -24 моль/л, благодаря функциональной активной работе почек(реабсорбция), синтезу/удалению. 1) Повышение концентрации Н+ ведет к тому, что бикарбонатный ион присоединяет его к себе и превращает в угольную кислоту НCL+NaHCO3 => NaCL+H2CO3 2) Повышение концентрации ионов ОН- ведет к тому, что угольная кислота отдает ион Н+. Образуется бикарбонат (НСО-) и вода. NaOH+ H2CO3 => NaHCO3 + H2O. ФОСФАТНАЯ H3PO4/ H2PO4 (фосфорная кислота /дигидрофосфат-ион). Механизм действия направлен на способность образовывать дигидрофосфат (НРО4) из гидрофосфата (Н2РО4-) при нагрузке кислыми продуктами. И наоборот образование гидрофосфата (НРО₄¯2) из дигидрофосфата (Н2РО4) при нагрузке щелочными продуктами. 1) Кислые продукты. При нагрузке кислыми продуктами преобразование гидрофосфата в дигидрофосфат происходит по схеме: H2SO4 + 2 Na2HPO4 (гидрофосфат) ó Na2SO4 + 2 NaH2PO4 (дигидрофосфат) 2) Щелочные. При избыточной потере кислых продуктов и преобладании в среде оснований из дигидрофосфата образуется гидрофосфат: NaOH + Na2H3PO4 (дигидрофосфат) ó H2O + Na2HPO4 (гидрофосфат) БЕЛКОВАЯ Pr / HPr. Концентрация белков в плазме крови = 60-80 г/л. В буферных процессах при рН 7,4 принимает участие лишь ИМИДОЗОЛЬНАЯ группа гистидина. В этой связи вклад белков плазмы крови в БЁ не превышает 3-5%. Внутриклеточные. 1. Гемоглобиновая. Составляет 35 % буферной ёмкости. Главная буферная система эритроцитов, на долю которой приходится около 75% всей буферной ёмкости крови. Участие гемоглобина в регуляции рН крови связано с его ролью в транспорте кислорода и СО2. Гемоглобиновая буферная система крови играет значительную роль сразу в нескольких физиологических процессах: дыхании, транспорте кислорода в ткани и в поддержании постоянства рН внутри эритроцитов, а в конечном итоге – в крови. При насыщении кислородом гемоглобин становится более сильной кислотой (ННbО2). Гемоглобин, отдавая кислород, превращается в очень слабую органическую кислоту (ННb). Точно так же может быть рассмотрена оксигемоглобиновая буферная система. Система гемоглобина и система оксигемоглобина являются вза-имопревращающимися системами и существуют как единое целое. Буферные свойства гемоглобина прежде всего обусловлены возможностью взаимодействия кисло реагирующих соединений с калиевой солью гемоглобина с образованием эквивалентного количества соответствующей калийной соли кислоты и свободного гемоглобина: КНb + Н2СO3—> КНСO3 + ННb. Именно таким образом превращение калийной соли гемоглобина эритроцитов в свободный ННb с образованием эквивалентного количества бикарбоната обеспечивает поддержание рН крови в пределах физиологически допустимых величин, несмотря на поступление в венозную кровь огромного количества углекислого газа и других кисло реагирующих продуктов обмена. Гемоглобин (ННb), попадая в капилляры легких, превращается в окси-гемоглобин (ННbО2), что приводит к некоторому подкислению крови, вытеснению части Н2СО3 из бикарбонатов и понижению щелочного резерва крови. Перечисленные буферные системы крови играют важную роль в регуляции кислотно-основного равновесия. Как отмечалось, в этом процессе, помимо буферных систем крови, активное участие принимают также система дыхания и мочевыделительная система.
Механизм адсорбции. Уменьшение свободной поверхностной энергии может произойти за счет уменьшения поверхностного натяжения в результате притяжения из окружающей среды к-л веществ. из этого утверждения вытекает понятие адсорбции. Поглощение к-л веществом других веществ называется сорбцией. Если этот процесс протекает на поверхности, то его называют адсорбцией. Адсорбция – увеличение концентрации вещества на границе раздела фаз. Адсорбентом называется вещество, на поверхности которого идет адсорбция. Вещество, которое адсорбируется – адсорбтив. Адсорбция – обратимый процесс, противоположный процесс – десорбция. Удаление адсорбированных веществ с адсорбентов при помощи растворителя – элюция. Коллоидная защита. Процесс повышения устойчивости гидрофобного золя, путем добавления к нему небольшого количества молекулярного коллоида (раствор высокого молекулярного соединения - ВМС). Механизм защитного действия – макромолекулы ВМС адсорбируются на поверхности коллоидных частиц, усиливая этим доп заряд и гидратную оболочку. Значение коллоидной защиты велико, например, белки крови защищают капельки жира, холестерин и др гидрофобные вещества от коагуляции. Ослабление защитных свойств белков приводит к отложению холестерина на стенках сосудов, к образованию камней в печени и почках.
Студни. Не текучие дисперсные системы. Студнями являются и ткани организма – клеточные мембраны, протоплазма, кожа, хрусталик, ногти, рога, копыта. Продукты питания студни – сыр, хлеб, холодец. Классификация: 1. По природе среды – гидрогели (вода), органогели (алкогели, глицерогели, бензогели). 2. По природе фазы – неорганические (неэластичные, хрупкие, не возвращающие обратное состояние после высушивания при добавлении воды); органические (эластичные, обратимые после высушивания). 3. По содержанию среды – лиогели (богатые дисперсионной средой – кисель, студень); ксерогели или сухие студни – воды до 2%).
Методы получения студней. 1.Застудневание золя и р-ра высокомолекулярных соединений. Процесс застудневания – а) Концентрация, форма и размер коллоидных частиц. Для каждого студня есть своя минимальная концентрация частиц фазы, ниже которой студень не образуется; б) Температура, время, рН ра-ра и присутствие электролита. 2. Ограниченное набухание сухого ВМС в подходящей среде. Набухание полимера – самопроизвольное поглощение р-ля полимера. С набуханием связаны процессы роста и развития организма, получение продуктивности животных. С возрастом степень набухания белков организма снижается и организм «высыхает».
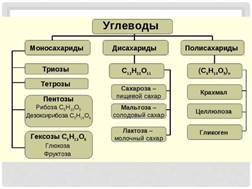
Классификация углеводов. Все углеводы делятся на 3 класса: моносахариды, дисахариды, полисахариды.
Функции углеводов в растении важны и разнообразны. 1. Энергетическая. 2. Пластическая. В процессе дыхания из универсального химического соединения — глюкозы образуются разнообразные метаболиты (углеродные скелеты), необходимые для синтеза разнообразных органических соединений живой клетки. 3. Опорная (структурная). Клеточные оболочки состоят из углеводов. 4. Запасная. Углеводы (крахмал, сахара, инулин, гемицеллюлозы) — важнейшие запасные вещества растений. 5. Осмотическая. Сахара, растворенные в клеточном соке, участвуют в создании его концентрации, а, значит, и осмотических свойств растительной клетки. 6. Регуляторная. Например, связывание с сахарами снижает активность фитогормонов, регулирующих процессы жизнедеятельности растений. 7. Сигнальная. Полагают, например, что некоторые белки гликопротеины (лектины), в состав молекул которых входят моно- и олигосахара, выполняют функцию узнавания патогена, проникающего в клетку. 8. Защитная функция углеводов, например, проявляется при стрессе. Растворимые сахара связывают воду, удерживая ее в клетке, связываются с белками и нуклеиновыми кислотами, стабилизируя их молекулы в неблагоприятных условиях.
Содержание гликогена в печени и мышцах. Основные запасы гликогена находятся в печени и мышцах. Количество гликогена в печени может достигать у взрослого человека 150 — 200 гр. Клетки печени являются лидерами по накоплению гликогена: они могут на 8 % состоять из этого вещества. Основная функция гликогена печени — поддержать уровень сахара в крови на постоянном, здоровом уровне. Если же уровень сахара в крови снижается, то возникает дефицит энергии, из-за которого в организме начинается сбой. Нехватка питания для мозга сказывается на центральной нервной системе, которая истощается. Происходит расщепление гликогена. Потом глюкоза поступает в кровь, благодаря чему организм получает необходимое количество энергии. В печени происходит не только синтез гликогена из глюкозы, но и обратный процесс — гидролиз гликогена до глюкозы. Этот процесс вызывается понижением концентрации сахара в крови в результате усвоения глюкозы различными тканями и органами. Гликоген откладывается также в мышцах. Общее количество гликогена в организме составляет 300 — 400 граммов. Как мы знаем, около 100-120 граммов вещества накапливается в клетках печени, а вот остальная часть (200-280 гр) сохраняется в мышцах и составляет максимум 1 — 2% от общей массы этих тканей. Хотя если говорить максимально точно, то следует отметить, что гликоген хранится не в мышечных волокнах, а в саркоплазме — питательной жидкости, окружающей мышцы. Количество гликогена в мышцах увеличивается в случае обильного питания и уменьшается во время голодания, а снижается только во время физической нагрузки – длительной и/или напряженной. При работе мышц под влиянием специального фермента фосфорилазы, которая активируется в начале мышечного сокращения, происходит усиленное распад гликогена в мышцах, который используется для обеспечения глюкозой работы самих мышц (мышечных сокращений). Таким образом, мышцы используют гликоген только для собственных нужд. Интенсивная мышечная деятельность замедляет всасывание углеводов, а легкая и непродолжительная работа усиливает всасывание глюкозы.
Гликогенолиз. Гликоген- полисахарид, запасный углевод. Гликогенолиз — биохимический процесс расщепления гликогена до глюкозы, осуществляется главным образом в печени и мышцах и не требует затрат энергии. Основная задача гликогенолиза — поддержание постоянного уровня глюкозы в крови. Регуляция гликогенолиза осуществляется совместно с регуляцией гликогеногенеза по типу переключения одного на другое. Важнейшими гормонами, участвующими в регуляции гликогеногенеза, являются инсулин, глюкагон и адреналин. Гликолиз. Процесс окисления глюкозы, при котором из одной молекулы глюкозы образуются две молекулы пировиноградной кислоты. Гликолиз состоит из цепи последовательных ферментативных реакций и сопровождается запасанием энергии в форме АТФ и НАДH. Гликолиз является универсальным путём катаболизма глюкозы и одним из трёх путей окисления глюкозы, встречающихся в живых клетках. Реакция гликолиза в суммарном виде выглядит следующим образом: Глюкоза + 2НАД+ + 2АДФ + 2Pi → 2 пируват + 2НАДH + 2Н+ + 2АТФ + 2Н2O Кислород не требуется для протекания гликолиза. В аэробных условиях пировиноградная кислота далее декарбоксилируется, соединяется с коферментом А и вовлекается в цикл Кребса, а в анаэробных условиях или при гипоксии претерпевает дальнейшие превращения в ходе брожения.
Цикл трикарбоновых кислот. ЦТК является продуктом гликолиза. Между гликолизом и ЦТК имеется тесная связь, т.к. имеется общее звено ПВК. Различие: гликолиз протекает в гиалоплазме, а ЦТК в митохондриях клетки. ЦТК в организме имеет универсальное значение, т.к. здесь происходит окончательное окисление остатков СН3СООН, которая образуется не только при окислении углеводов, а также жиров и белков. В ЦТК роль катализатора выполняют ди- и 3-карбоновые кислоты и главный катализатор ЩУК (щавелевая, уксусная кислоты). Молочная кислота получается в гликолизе обратной реакцией превращения в ПВК. Часть ПВК идёт на синтез ЩУК. Часть ПВК окисляется, превращаясь в ацетилкоА (активноуксусная кислота).
Классификация аминокислот: Ациклические: - Моноаминомонокарбоновые – 1 карбоксильная и 1 аминогруппа (глицин; аланин; серин; цистеин; цистин; треонин; метионин; валин;изолейцин). · Моноаминодикарбоновые – 2 карбоксильные и 1 аминогруппа (аспарагиновая; глютаминовая). · Диаминомонокарбоновые – 1 карбоксильная и 2 аминогруппы (орнитин; лизин; аргинин). Циклические: ·Гомоциклические (фенилаланин; тирозин); Гетероциклические (триптофан; гистидин) Кроме аминокислот в организме встречаются иминокислоты – вместо группы NH2 – группа NH – иминогруппа. Пролин и оксипролин. Переваривание б елков. В ротовой полости белки не перевариваются, т.к. там нет условий. Переваривание белков начинается в желудке. Желудочный сок содержит различные неорганические и органические вещества. Главные из них – соляная кислота и белки-ферменты. Реакция среды желудочного сока обусловлена наличием соляной кислоты. Соляная кислота синтезируется обкладочными клетками желёз слизистой оболочки дна желудка. Для синтеза соляной кислоты используется поваренная соль. Лошади: 1,2-3,1; КРС: 2,17-3,14. Таким образом, реакция среды желудочного сока разных животных резко кислая. Значение соляной кислоты: 1. Вызывает набухание белков; 2. Активизирует пепсиноген, превращая его в пепсин; 3. Создаёт оптимальные условия pH для пепсина, так как он активен только в резко кислой среде; 4. Имеет бактерицидное действие. Пепсин – основной фермент желудочного сока, является простым белком и обладает высокой ферментативной активностью. 1 г пепсина за 2 часа гидролизует 50 кг белка. Пепсин гидролизует внутренние пептидные связи. У жвачных в молочный период основным кормом является молоко и продукты его переработки. В этот период у жвачных вырабатывается фермент химозин, который вызывает свёртывание молока. Химозин действует в слабокислой среде (pH 5-5,3) и только в присутствии солей кальция. Натуральный фермент химозин используется в сыроприготовлении.
Всасывание белков. Белки всасываются в кишечнике в основном в виде аминокислот и частично в виде низкомолекулярных полипептидов. Полипептиды могут образовываться из аминокислот в стенке кишечника и поступать в кровь. Некоторые белки при избыточном поступлении с кормами всасываются без расщепления. Подобные явления наблюдаются у новорожденных животных (глобулины молозив всасываются без изменений, в результате организм получает готовые иммунные тела). У жвачных расщепление белка под влиянием МО начинается в желудке, где и происходит частичное всасывание. Далее полипептиды, которые образовались в желудке под действием пепсина идут в 12-типерстную кишку. Там смесь секрета ПЖ: трипсин, химотрипсин, карбоксипептидаза. Все ферменты вырабатываются в неактивном виде (предохраняет стенки ПЖ от самопереваривания). В тонком кишечнике работает трипсин, он расщепляет внутренние пептидные связи, образуя полипептиды. На них действуют ферменты полипептидазы, получаем дипептиды, на них действуют дипептидазы и получаются аминокислоты. Аминокислоты- конечный продукт переваривания белков.
Классификация липидов. Жиры классифицируются на простые и сложные жиры. Простые жиры – это производные глицерина и высших жирных кислот. К простым жирам относятся: нейтральные (триглицериды), воски и стерины. К сложным жирам относятся фосфолипиды, гликолипиды и сульфатиды. Ещё: жиры растительного и животного происхождения. Стуктурные и запасные.
Стерины и стериды. Холестерин, строение и роль в организме. Стерины – это высокомолекулярные циклические одноатомные спирты, основу которых составляет циклический компонент – циклопентанпергидрофенантрен. Стерины бывают животного происхождения – зоостерины, растительного происхождения – фитостерины, производные грибов – микостерины. Представителем зоостеринов является холестерин. Производным холестерина является 7-дегидрополистерин, из которого синтезируется под действием ультрафиолетовых лучей витамин D3. Стерины в большом количестве содержатся в тканях организма, особенно много в белом веществе головного мозга, желчи, жиропоте овец, яичном белке. Значение стеринов: 1. Источники желчных кислот. 2. Источники половых гормонов, гормонов коры надпочечников и витамина D3. Представителем фитостеринов является эргостерин. Он является источником витамина D2. трафиолетовых лучей витамин D3. Холестерин является источником образования в организме ряда биологически активных веществ желчных кислот, половых гормонов и гормонов коры надпочечников. Всех их объединяют в группу стероидных гормонов. (формулу учили, если понадобится).
Воски. Спермацет, пчелиный воск. Воски состоят из остатков высших жирных кислот и высших одноатомных спиртов. Они могут быть животного и растительного происхождения. Воски животного происхождения (спермацет обнаружен в черепной полости кашалота, он состоит из пальмитиновой кислоты и цетилового спирта) – основы мазей, в косметической промышленности. Пчелиный воск состоит из пальмитиновой кислоты и мерицинового спирта, продуцируется восковыми железами пчёл. Воск – основа пчелиных сот. Ланолин получают после промывки шерсти овец. Он представляет собой смесь сложных триглицеридов – это густая вязкая масса, которая не растворяется в воде, но растворяется в хлороформе и эфире. Применяется в фармацевтике и косметической промышленности. Воск растительного происхождения, например, в кожуре яблока.
5.6 Глицерофосфоолипиды. Лецитин, кефалин, серинфосфолипиды, инозитфосфолипиды. Наиболее простым глицерофосфолипидом является фосфатидная кислота. Много фосфатидов найдено в нервной ткани и головном мозге животных, а также в желтке яиц птиц. При гидролизе распадаются на глицерин, жирные кислоты, фосфорную кислоту и азотистые основания. Классификация 1. Холинфосфатиды, 2. Коламинфосфатиды, 3. Серинфосфатиды, 4. Ацетальфосфатиды, 5. Инозитфосфатиды, 6. Сфингофосфатиды. Они не растворимы в воде, но набухают в ней и образуют водные эмульсии, хорошо растворяются в эфире, бензоле и т.д. Они легко окисляются. Лецитины наиболее широко распространены в тканях животных и растений, были изучены ранее других. Различают альфа- и бета- лецитины (от положения остатка фосфорной кислоты). Больше всего их в ткани мозга, яичном желтке и почках. Составная часть лецитина – холин (находится в тканях и жидкостях организма в свободном состоянии, и в связанном с белками тканей). Холин + уксусная кислота = ацетилхолин (переносчик нервного возбуждения). Кефалины найдены в головном мозге, в печени, почках, надпочечниках, яичном желтке и других тканях; найдены и в растениях. Они растворимы в спиртах (отличие от лецитинов). Серинфосфатиды в качестве азотистого основания в них входит аминокислота –
|
||||
|
Последнее изменение этой страницы: 2020-10-24; просмотров: 551; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.169 (0.019 с.) |