Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Первинна кристалізація металівСодержание книги
Поиск на нашем сайте
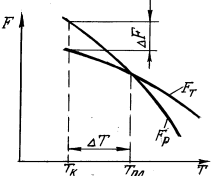
Перехід металу з рідкого стану у твердий (кристалічний) називається кристалізацією. Це відбувається в умовах, коли система переходить до термодинамічно більш стійкого стану з меншою вільною енергією або термодинамічним потенціалом F, тобто коли вільна енергія кристала менша вільної енергії рідкої фази. Якщо перетворення відбувається з невеликою зміною об’єму, то F=Н-ТS, де Н - повна енергія системи; Т - абсолютна температура; S - ентропія. Зміна вільної енергії рідкого та твердого станів у залежності від температури показана на рис.2.1. Вище температури Тпл стійкішим є рідкий метал, який має менший запас вільної енергії, а нижче цієї температури стійкішим є твердий метал. При температурі Тпл величини вільних енергій рідкого та твердого станів рівні. Така температура відповідає рівноважній температурі кристалізації (чи плавлення) даної речовина при якій обидві фази - рідка та тверда - можуть існувати одночасно і нескінченно довго. При ній процес кристалізації ще не відбувається - він розпочнеться лише при переохолодженні металу нижче температури Тпл. Різниця між температурами Тпл і Тк, при якій можливий процес кристалізації, називається ступенем переохолодження: ∆Т=Тпл - Тк.
Рис.2.1. Температурна залежність енергії Гіббса метала в рідкому (Fр) і твердому (Fт) станах При повільному охолодженні ця величина настільки мала, що кристалізація відбувається при температурі, близькій до рівноважної (рис.2.2, крива ν1). Але при збільшенні швидкості охолодження ступінь переохолодження зростає (криві ν2, ν3). Ступінь переохолодження залежить також від природи і чистоти металу. Чим чистіший рідкий метал, тим більше він схильний до переохолодження. При затвердінні дуже чистих металів ступінь переохолодження може досягати великих значень. Так, при затвердінні оловабула досягнута ∆Т=118 оС, а сурми - ∆Т=135 оС. Проте звичайно ступінь переохолодження не перевищує 10…30 о С.
Рис.2.2. Криві охолодження: v1, v2, v3 – швидкості охолодження (ν1 < ν2 < ν3) Процес кристалізації починається з утворення кристалічних зародків (центрів кристалізації) і продовжується шляхом зростання їх числа і розмірів. При переохолодженні сплаву нижче температури Тпл у багатьох ділянках рідкого сплаву утворюються стійкі, спроможні до росту кристалічні зародки - критичні (рис.2.3). Поки кристали ростуть вільно, вони мають правильну геометричну форму. Проте при їх взаємному зіткненні правильна форма порушується, тому що в цих ділянках ріст граней припиняється - він продовжується тільки в тих напрямках, де є вільний доступ для рідини. В результаті кристали після затвердіння одержують неправильну зовнішню форму, тому вони називаються кристалітами чи зернами. Явища, які відбуваються в процесі кристалізації, складні і різноманітні. У рідкому металі впорядковане розташування атомів поширюється на дуже малу відстань, проте й воно внаслідок інтенсивного теплового руху атомів динамічно нестійке. Мікрооб’єми з правильним розташуванням атомів можуть існувати деякий час, потім розсмоктуються і виникають знову в іншому елементарному об’ємі рідини тощо. Зі зниженням температури розміри таких упорядкованих мікрооб’ємів зростають.
Рис.2.3.Схема процесу кристалізації При температурах, близьких до температури плавлення, у рідкому металі можуть утворюватися невеличкі угрупування, в яких атоми упаковані так само, як і в кристалі. Такі дозародкові угрупування називаються фазовими (або гетерофазними) флуктуаціями. У чистому від домішок рідкому металі вони можуть перетворитися у центри кристалізації. Зародки, які виникають у процесі кристалізації, можуть мати різні розміри. Ріст зародка можливий тільки за умови, якщо він досяг певного розміру, починаючи з якого його збільшення призводить до зменшення вільної енергії. В процесі кристалізації вільна енергія системи (рис.2.1), зодного боку, зменшується внаслідок переходу деякого об'єму рідкого металу у твердий, а з іншого боку, зростає в результаті утворення поверхні розділу з надлишковою енергією. Загальна зміна вільної енергії ΔF=-ΔFоб+ΔFпов або ΔF=-VΔf+Sσ, де Δf - різниця об'ємних вільних енергій рідкого і твердого металів (Fр-Fтв); V - об’єм зародка; S - сумарна величина поверхні кристалів; σ - поверхневий натяг. Мінімальний розмір зародка, спроможний до росту при заданих температурних умовах, називається критичним: Rк=4σ⁄ Δf. На його утворення затрачається енергія ΔFк = Sσ⁄3. Отже, зменшення об'ємної вільної енергії при переході атомів з рідкого стану в твердий кристалічний недостатньо для утворення критичного зародка. Вона лише на дві третини компенсує енергетичні витрати, пов'язані з утворенням поверхні зародка. Ріст зародків кристалізації відбувається в результаті переходу атомів з переохолодженої рідини до кристалів. Кристал росте пошарово, причому кожен шар має одноатомну товщину. Ріст кристала значно полегшується тим, що його грані не ідеально рівні площини. На них завжди є різноманітні дефекти поверхні у вигляді сходинок і виступів, на яких легко утримуються нові атоми, що надходять з рідини. Наприклад, гвинтові дислокації утворюють на поверхні кристала спіралі росту висотою від одного до декількох тисяч атомів. За інших рівних умов швидкість процесу кристалізації і будова металу після затвердіння залежать від швидкості утворення зародків, швидкості їхнього зростання чи швидкості збільшення лінійних розмірів кристала, що зростає. Чим більша швидкість утворення зародків і чим більша швидкість їхнього росту, тим швидше відбувається процес кристалізації. При рівноважній температурі кристалізації (Тпл) число зародків і швидкість росту рівні нулю, тому кристалізація не відбувається. При збільшенні ступеня переохолодження швидкість утворення зародків і швидкість їхнього росту зростають, при визначеному ступені переохолодження досягають максимуму, після чого вони знижуються. Це пояснюється тим, що з підвищенням ступеня переохолодження різниця вільних енергій рідкого і твердого металів зростає, а це сприяє підвищенню швидкості кристалізації, тобто швидкості утворення зародків і їхнього росту. Проте для утворення і росту зародків потрібно дифузійне переміщення атомів у рідкому металі. Тому при великих ступенях переохолодження (низьких температурах) внаслідок зменшення швидкості дифузії утворення зародків і їхній ріст утруднені. Внаслідок цього число зародків і швидкість їхнього росту зменшуються. Швидкість утворення зародків і лінійної швидкості росту кристалів визначають швидкість кристалізації. Чим більша швидкість утворення зародків і менша швидкість їхнього росту, тим менший і розмір кристала, що виростає з одного зародка (зерно), і отже, більш дрібнозернистою буде структура металу. При невеликому ступені переохолодження ∆Т (малій швидкості охолодження) число зародків мале. У цих умовах буде отримана великозерниста структура. Зі збільшенням ступеня переохолодження швидкість утворення зародків зростає і розмір зерна зменшується. Розмір зерна металу має значний вплив на механічні властивості, особливо на в'язкість. Розмір зерна залежить від ступеня переохолодження, температури нагрівання і розливання рідкого металу, його хімічного складу, особливо присутності у ньому сторонніх домішок. Вплив цих чинників дуже значний. Утворення зародків у рідкому металі за описаним механізмом називається самовільним (або спонтанним). Воно може відбуватися тільки у високочистому рідкому металі (гомогенне затвердіння). У технічних металах завжди є велика кількість різноманітних домішок (оксиди, неметалічні включення тощо), що за певних умов поліпшує утворення зародків. Зокрема, домішок повинен мати вищу температуру плавлення, ніж основний метал. Структурна подібність між поверхнями спряження зародків і частинок сторонніх домішок призводить до зменшення розміру критичного зародка і роботи його утворення. Тому на включеннях, які відповідають цим вимогам, порівняно легко виникають зародки, і затвердіння рідини починається при меншому переохолодженні, ніж при самовільному зародженні. Чим більше домішок, тим більше центрів кристалізації, тим дрібнішим утворюється зерно. Таке утворення зародків називають гетерогенним. Розчинені у рідкому металі домішки також можуть подрібнювати зерно і змінювати його форму. У цьому випадку домішки при затвердінні осаджуються у вигляді тонкого шару на поверхні кристала, який росте, а це призводить до зменшення поверхневої енергії. Такі домішки називають поверхнево-активними. Температура, яка відповідає перегріву металу, значно вища його температури плавлення; при цьому утворюється велике зерно. Це пояснюється розчиненням і дезактивацією домішок, які могли б відігравати роль готових поверхонь поділу при кристалізації. Підстужування перегрітого металу до нижчих температур і витримка при них призводить до виділення з рідкого металу розчинених домішок, які знову можуть стати активними зародками. У цьому випадку зерно металу буде дрібнішим. Модифікування - використання спеціально введених у рідкий метал домішок (модифікаторів) для одержання дрібного зерна. Ці домішки, практично не змінюючи хімічного складу сплаву, викликають при кристалізації подрібнення зерна, що поліпшує механічні властивості. Так, при модифікуванні магнієвих сплавів зерно зменшується від 200…300 до 10…20 мкм. При литті злитків і фасонних виливків модифікування найчастіше проводиться введенням у розплав добавок, які утворюють тугоплавкі з’єднання (карбіди, нітриди, оксиди), що кристалізуються в першу чергу. Виділяючись у вигляді дрібних часток, ці з’єднання служать зародками кристалів, які утворюються при затвердінні Будова металевого злитка Кристали, що утворюються при затвердінні металу, можуть мати різну форму в залежності від швидкості охолодження, характеру та кількості домішок. Найчастіше в процесі кристалізації утворюються розгалужені, або деревоподібні, кристали - дендрити (рис.2.4). Їхній розвиток відбувається, переважно, в перпендикулярних площинах з максимальною щільністю упаковування атомів. Це призводить до того, що спочатку утворюються довгі гілки (рис.2.4, а), так звані осі першого порядку (І - головні осі дендрита). Одночасно з подовженням осей першого порядку на їхніх ребрах зароджуються і ростуть перпендикулярні до них такі ж гілки другого порядку (ІІ). У свою чергу на осях другого порядку зароджуються і ростуть осі третього порядку (ІІІ) тощо. Так утворюються кристали у формі дендритів.
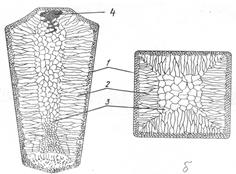
Рис.2.4. Схеми дентритного кристала (а) і росту дентритів (б) Кристали дендритної форми іноді можна бачити безпосередньо на поверхні злитка у вигляді характерного рельєфу. Проте найчастіше дендритна будова виявляється тільки після спеціального травлення макрошліфів. Оскільки всі проміжки між гілками дендритів заповнені, то видно лише місця стиків дендритів у вигляді меж зерен. Правильна форма дендритів спотворюється у результаті зіткнення і зрощення часток на пізніх стадіях процесу кристалізації. Гілки дендритів розділені дуже тонкими прошарками нерозчинних домішок, дрібними порожнинами і порами, які виникли в результаті зменшення об’єму при переході металу з рідкого стану у твердий. Отже, за механізмом утворення зерна металу являють собою, переважно, дендритні кристали, які виросли з одного зародка і мають однакову орієнтацію кристалічної гратки. В залежності від швидкості охолодження рідкого металу, зерна можуть мати рівновісну (глобулярну) і стовпчасту (витягнуту) форму. В злитку метала можна розрізнити три зони з різноманітною структурою (рис.2.5). Кристалізація рідкого металу починається на поверхні форми, яка більш холодна і відбувається спочатку, переважно в тонкому шарі сильно переохолодженої рідини, яка дотикається до її поверхні. Внаслідок великої швидкості охолодження це призводить до утворення на поверхні злитка дуже вузької зони 1 порівняно дрібних рівновісних кристалітів. За нею, в глибині злитка, розташована зона 2 подовжених дендритних кристалітів (зона стовпчастих кристалів). Ріст цих кристалітів відбувається в напрямку, протилежному напрямку відведення тепла, тобто перпендикулярно до стінок виливниці. Послідовний ріст дендритів від її стінки забезпечується просуванням у глибину розплаву гілок першого порядку і їхнього розгалуження. У середній частині злитка розташована зона 3 великих рівновісних кристалітів. Утворюється така зона внаслідок ще більшого уповільнення процесу охолодження метала і відсутності певного напрямку з переважним тепловідведенням.
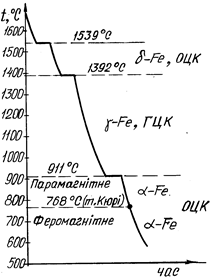
Рис.2.5. Схема будови стального злитка: а – поздовжній переріз; б – поперечний переріз; 1 – зона дрібних рівновісних кристалів; 2 – зона стовпчастих кристалів; 3 – зона великих рівновісних кристалів; 4 – усадочна раковина. При сильному перегріванні металу, швидкому охолодженні, високій температурі лиття і спокійному заповненні форми зона подовжених дендритних кристалів може повністю заповнити весь об’єм злитка. При низькій температурі лиття, дуже повільному охолодженні (наприклад, у серединних шарах великих виливків) створюються умови для виникнення зародків кристалів у середній частині злитка. Це призводить до утворення у внутрішній частині виливка структурної зони, яка складається з рівновісних, по-різному орієнтованих дендритних кристалітів, розміри яких залежать від ступеня перегріву рідкого металу, швидкості охолодження, наявності домішок тощо. Тугоплавкі частки, які знаходяться в рідкому металі, сприяють розвитку зони дрібних рівновісних кристалітів Зона стовпчастих кристалів має високу щільність, тому що в ній майже немає газових пухирів і раковин. Проте в місцях стикання стовпчастих кристалітів, які ростуть від різних поверхонь, метал має понижену міцність, і при наступній обробці тиском (куванні, прокатуванні тощо) в них можуть виникнути тріщини. Тому для малопластичних металів (зокрема, сталі), розвиток стовпчастих кристалітів небажаний. Навпаки, для одержання більш щільного злитка в пластичних металах (наприклад, міді та її сплавів) бажано поширення зони стовпчастих кристалітів по всьому обсязі злитків; внаслідок високої пластичності таких сплавів виключається руйнування злитка при обробці тиском. При фасонному литті прагнуть одержати дрібнозернисту рівновісну структуру. Рідкий метал має більший питомий об’єм, ніж твердий, тому в тій частині злитка, що застигає в останню чергу, утворюється порожнина - усадочна раковина (4), яка оточена найбільш забрудненою частиною металу. В ній також після кристалізації залишаються мікро- і макропори та пухирі. Поліморфні перетворення Багато металів, в залежності від температури, можуть існувати в різних кристалічних формах (модифікаціях). У результаті поліморфного перетворення атоми кристалічного тіла, що мають гратки одного типу, перебудовуються, утворюючи кристалічні гратки іншого типу. Поліморфну модифікацію, стійку при низькій температурі, прийнято позначати буквою α, при більш високій - β, потім - γ тощо. Відомі такі поліморфні перетворення: Feα↔Feγ, Coα↔Coβ, Tiα↔Tiβ, Snα↔Snβ, Мnα↔Мnβ↔Мnγ↔Мnδ. Метали Сa, Li, Nа, Сs, Sr, V і велике число рідкоземельних металів також мають модифікації. Поліморфне перетворення протікає в тому випадку, якщо при даній температурі може існувати метал з іншою кристалічною граткою і меншим рівнем вільної енергії. Н рис.2.6. наведена температурна залежність вільних енергій α-Fe, γ-Fe, а на рис.2.7. – крива охолодження чистого заліза. З рис.2.6 видно, що в інтервалі температур 911…1392 оС стійким є γ-залізо (Feγ) (К12), яке має меншу вільну енергію, ніж α-залізо (Feα), а при температурах нижче 911 і вище 1392 °С стійким є α-залізо (Feα) (К8), тому що його вільна енергія менша, ніж γ-залізо (Feγ). Перехід чистого металу з однієї поліморфної модифікації в іншу відбувається при постійній температурі (при критичній точці) (рис.2.7) і супроводжується виділенням тепла (якщо перетворення йде при охолодженні) чи його поглинанні (при нагріванні). Як і при кристалізації з рідкої фази, для того щоб поліморфне перетворення відбувалося, потрібно деяке переохолодження (або перенагрівання) відносно рівноважної температури – для того, щоб виникла різниця вільних енергій між вихідною і новою модифікаціями. В твердому металі, на відміну від рідкого, можна досягнути великих ступенів переохолодження. Поліморфне перетворення за своїм механізмом - кристалізаційний процес і здійснюється шляхом утворення зародків і наступного їхнього зростання. Зародки нової модифікації найчастіше виникають на межах зерна вихідних кристалітів або в зонах з підвищеним рівнем вільної енергії. Кристали, що знову утворюються, закономірно орієнтовані відносно кристалів вихідної модифікації.
Рис.2.6. Температурна залежність енергії Гіббса поліморфних модифікацій заліза
Рис.2.7. Крива охолодження чистого заліза. У результаті поліморфного перетворення утворюються нові кристалічні зерна, які мають інший розмір і форму. Тому таке перетворення називають перекристалізацією. Якщо нагрівання металу проведено до температури, що трохи перевищує температуру поліморфного перетворення (критичної точки), утворюється дуже дрібне зерно. Це використовують для подрібнення великого зерна, отриманого при кристалізації з рідкого стану чи попереднього нагрівання до високих температур. Поліморфні перетворення відбуваються не тільки в чистих металах, але й у сплавах. Поліморфне перетворення супроводжується стрибкоподібною зміною властивостей металів і сплавів: питомого об’єму, теплоємності, теплопровідності, електропровідності, магнітних, механічних і хімічних тощо.
|
||||
|
Последнее изменение этой страницы: 2016-04-08; просмотров: 459; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.149.251.22 (0.008 с.) |