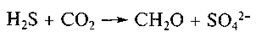Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Геохимию кислорода и водорода в биосфереСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Основная масса кислорода на периферии Земли находится в кристаллическом силикатном веществе земной коры. Кислород также составляет большую часть (86 %) массы гидросферы. Но для биосферы исключительно важное значение имеет свободный молекулярный кислород, аккумулированный в атмосфере и растворенный в гидросфере. Будучи продуктом процессов жизни, кислород в то же время служит одним из основных условий существования ее главных форм и определяет самые важные реакции в биосфере. Живое вещество состоит из углерода, кислорода, водорода. Уже поэтому распределение и динамика этих элементов в биосфере неразрывно связаны. Образование свободного кислорода связано со световой энергией Солнца и поэтому может осуществляться только на поверхности Земли либо абиогенно, путем фотолиза паров воды, либо в процессе биологического фотосинтеза. Исходным «сырьем» для образования кислорода посредством реакций фотолиза и фотосинтеза служит вода. Связывание 1 г углерода в органическое вещество при реакции фотосинтеза сопровождается выделением примерно 2,7 г кислорода в результате расщепления молекул воды. Как упоминалось ранее, наличие органического вещества установлено в древних осадочных отложениях, имеющих возраст до 3,8 млрд лет. Следовательно, выделение кислорода при фотосинтезе продолжалось на протяжении огромного отрезка времени. Согласно данным А.Б.Ронова и А.А.Яро-шевского (1976) можно считать, что в осадочной оболочке Земли содержится около 15×1015 т Сорг (см. табл. 7.1). Этому количеству соответствует 40×1015т О2. В настоящее время в атмосфере содержится порядка (1,1—1,2)×1015 О2. Следовательно, более 38×1015 т O2 было израсходовано на процессы окисления. Исходя из продуктивности растительного покрова Мировой суши, не нарушенного человеком, выделение кислорода можно оценить в 220×109 т/год. В настоящее время, после вырубки части лесов и уничтожения природной растительности на большой площади продуктивность растительности сократилась примерно на 25 % и выделение кислорода составляет около 165×109 т/год. Фотосинтез в океане (продукция Сорг от 40×109 до 60×109 т/год) поставляет в атмосферу от 110×109 до 160×109 Сорг, в среднем 130- 109 т/год О2. Суммарное выделение кислорода фотосинтетиками суши и океана составляет около (300 — 350)×109 т/год. Приведенные значения близки к расчетам Дж. Уолкера (1980), согласно которому основные черты глобального цикла кислорода намечаются следующими процессами: выделение кислорода растительностью Мировой суши — 150×1015 т/год, фотосинтезирующими организмами океана — 120×1015 т/год, поглощение кислорода процессами аэробного дыхания — 210×1015 т/год, биологическая нитрификация и другие процессы — 70×1015 т/год. Количество кислорода в атмосфере равно 1,185×1015 т. При выделении кислорода (280 — 300)×109 т/год указанное количество может быть удвоено примерно за 4000 лет. Но этого не происходит, так как на протяжении года разными путями разлагается количество органического вещества, почти равное образованному при фотосинтезе, и при этом поглощается почти весь выделившийся кислород. Тем не менее благодаря сохранению части органического вещества свободный кислород постепенно накапливался в атмосфере. Второй миграционный цикл свободного кислорода связан с массообменом в системе тропосфера — природные воды. В 1 л воды растворено от 2 до 8 см3 О2. Следовательно, в воде океана находится от 3×109 до 10×109 м3 растворенного кислорода. Холодная вода высоких широт поглощает О2; поступая с океаническими течениями в тропический пояс, она выделяет О2. Поглощение и выделение кислорода происходят также при смене теплых и холодных сезонов года. По подсчетам А.П.Виноградова (1967), в годовой массообмен между атмосферой и океаном вовлекается около 0,5 % атмосферного кислорода, т.е. 5900×109 т. Это почти в 20 раз больше биогенного продуцирования кислорода. Водород — один из двух химических элементов, которые благодаря ничтожной массе их ядер могут диссипировать — уходить из поля тяготения Земли. Транзит водорода и гелия проходит через биосферу. Гелий как инертный газ не образует химических соединений, а водород под влиянием жизнедеятельности организмов вступает в соединения и вследствие этого задерживается в биосфере. Водород в свободной (молекулярной) форме и в составе химических соединений активно дегазируется из мантии. Значительные массы Н2 поступают на поверхность Земли при вулканических извержениях и поствулканических процессах, выделяются в результате жизнедеятельности водородных бактерий, участвующих в преобразовании органического вещества в анаэробных условиях, образуются при разложении воды при электрохимических реакциях и под воздействием продуктов распада радиоактивных элементов. В то же время в атмосфере находится всего 0,18×109 т Н2 благодаря его диссипации. Скорость диссипации водорода 25×103 т/год. За время существования Земли общая потеря элемента составила 0,1×1015 т (Заварзин Г. А., 1984). На ранних стадиях истории Земли ведущую роль в геохимии водорода играл процесс фотолиза паров воды с последующей диссипацией атомов водорода. В дальнейшем все большее значение стало приобретать связывание водорода в составе органического вещества. Для создания массы растительности Мировой суши, существовавшей до вмешательства человека, было расщеплено примерно 1,8×1012 т воды и соответственно связано 0,3×1012 т водорода. В настоящее время в процессе фотосинтеза природной растительностью на суше и фотосинтетиками в океане на протяжении года расщепляется около 0,2×1012 т воды и в органическом веществе связывается примерно (0,03 — 0,035)×1012 т водорода. Как было показано на примере углерода, многократно повторяющиеся циклические процессы миграции химических элементов способствуют дифференциации изотопов. Один из наиболее мощных циклических процессов, существующий на поверхности Земли с момента образования атмосферы и океана — круговорот воды. Именно цикл массообмена воды наиболее заметно сказывается на разделении изотопов водорода и кислорода. Водород представлен двумя стабильными изотопами: 1Н (протий) и 2Н (D — дейтерий). Распространенность 1Н — 99,984%, 2Н — около 0,0156 %. Кислород состоит из трех стабильных изотопов со следующей распространенностью:
Изотоп.................................... 1бО 17О 18О Распространенность, %........99,759 0,0374 0,203 Изотопный состав водорода и кислорода природных вод выражают по значению d относительного прироста, аналогично приведенной выше формуле для d13С. В качестве международного стандарта используется средний изотопный состав океанической воды, для которой dD и d18О равны нулю. В процессе круговорота воды в биосфере происходит однонаправленное фракционирование изотопов кислорода и водорода: возрастание дейтерия сопровождается возрастанием тяжелого изотопа кислорода 18О согласно линейной зависимости X. Крейга: dD = = 8d18О + 10 (Крейг X., 1954). Пары воды при испарении обогащаются легкими изотопами, поэтому атмосферные осадки, поверхностные и грунтовые воды имеют отрицательные значения dD и d18О. Активность разделения изотопов кислорода усиливается при понижении температуры. В итоге влияния всех факторов наиболее легкая вода содержится в материковых льдах Арктики и Антарктиды. Океанические воды характеризуются устойчивым изотопным составом водорода и кислорода. В термальных водах dD слабо меняется, а d18О возрастает. Таким образом, непосредственное участие живых организмов во фракционировании изотопов водорода и кислорода не обнаружено. В то же время биогенные образования отражают изотопный состав среды их обитания. Это можно использовать при палеогеографических и палеобиогеохимических реконструкциях. Например, известны попытки на основании определения изотопного состава кислорода в карбонатных скелетах моллюсков реконструировать температуру древних морей. Организмы не только непосредственно закрепляют водород в биосфере, связывая его в органическом веществе, но также оказывают сильное влияние на взаимодействие водорода с минеральным веществом педосферы. В почвенных растворах в результате диссоциации кислотных продуктов метаболизма образуется ион Н+, играющий важную роль в процессах трансформации кристал-лохимических структур гипогенных силикатов в структуры минералов глин. По этой причине интенсивность продуцирования кислотных продуктов метаболизма биотой суши является важным фактором гипергенного преобразования кристаллических горных пород и образования коры выветривания. Глобальный цикл серы
Сера — характерный представитель группы активно дегазируемых элементов. В то же время поступление серы в атмосферу по сравнению с инертными газами или СО2 сильно затруднено. Это связано со следующими обстоятельствами. Среди газообразных соединений серы, выделяющихся с вулканическими газами, наиболее обычными являются диоксид cepы (IV) и сероводород. В процессе активного дегазирования мантии и прохождения через толщи горных пород газы растворяются в подземных водах. При этом H2S активно восстанавливает тяжелые металлы, образуя труднорастворимые сульфиды, главным образом дисульфид железа (пирит), a SO2 частично связывается в составе также плохо растворимых сульфатов кальция, бария, стронция. В результате указанных реакций значительная часть дегазируемых соединений серы трансформируется в твердые минералы, среди которых наиболее распространен пирит FeS2. Средняя концентрация сульфидной (в основном пиритной) серы в гранитном слое континентального блока земной коры 0,064%, сульфатной — 0,04%. Исходя из данных А.Б.Ронова и А. А.Ярошевского (1976), можно считать, что в гранитном слое масса сульфидной серы равна 5,3×1015 т, сульфатной серы — 3,3×1015 т. В процессе фракционирования элементов при магматическом процессе сера вместе с металлами отщепляется от силикатного расплава и уходит в пневматолитово-гидротермальные флюиды, из которых затем выпадает в виде скоплений сульфидов железа, меди, цинка, свинца и некоторых других металлов. Заметим, что месторождения сульфидных руд составляют всего лишь тысячные доли процента от массы сульфидов металлов, рассеянных в верхней части гранитного слоя земной коры континентов мощностью 1 км. Часть диффундирующих через земную кору газообразных соединений серы, а также сернистые газы вулканических выбросов и газово-жидких выделений наземных и подводных гидротерм поступает в систему Мирового океана и педосферу. При этом значительная часть газов захватывается бактериями в своеобразный микробиологический круговорот. Таким образом, дегазируемые соединения серы по пути в атмосферу должны преодолеть двойной фильтр: физико-химический в земной коре и биогеохимический на поверхности суши и на дне океана. Глобальный массоперенос серы в биосфере не ограничен миграцией газообразных соединений и включает также миграцию водорастворимых соединений этого элемента в поверхностных и грунтовых водах. Образование водорастворимых форм серы связано с гипергенной трансформацией нерастворимых сульфидов, содержащихся в горных породах, в хорошо растворимые сульфаты. Сульфиды металлов в зоне гипергенеза подвергаются гидролизу и окислению, в результате чего образуется серная кислота, нерастворимые гидроксиды железа(Ш), марганца(IV) и легкорастворимые сульфаты. Образование сульфатов также происходит в почвах в результате микробиологических процессов. Водорастворимые сульфаты выщелачиваются из выветривающихся горных пород и выносятся с поверхности суши с речным стоком. Концентрация ионов [SO4]2- в морской воде 2,7 г/л. В системе Мирового океана аккумулировано 3,7×1015 [SO4]2-, в том числе 1,2×1015 т S. Сера — обязательный компонент живого вещества: она входит в состав белков, в молекулярной структуре которых играет важную роль. В составе живого вещества Мировой суши, образованного в основном высшими растениями, концентрация серы невелика — по данным X. Боуэна, 0,34 % сухой биомассы. В животных и бактериях из-за большого содержания в биомассе белков концентрация серы значительно выше. Отношение С: S в белках около 16, в углеводах — 80, в наземных растениях — более 200, в животных — около 70. В живом веществе океана среднее содержание серы составляет 1,20 % сухого вещества. Отношение С: S в морских растениях около 50, почти такое же, как у наземных животных. Количество серы, находящейся в биомассе суши, равно 8,5×109 т, в фотосинтетиках океана — 0,07×109 т, в консументах океана — 0,09×109 т. Концентрация серы в неживом органическом веществе суши (лесных подстилках, торфе, гумусе почв), очевидно, близка к 0,5 % сухого вещества. Если эта цифра верна, то масса серы, находящаяся в органическом веществе педосферы, близка к 25×109 т. Несмотря на интенсивное дегазирование серы из недр Земли, природные уровни концентрации сернистых газов в атмосфере весьма незначительны: благодаря активному связыванию рассматриваемого элемента в земной коре, гидросфере и живом веществе концентрация и H2S, и SO2 около 2- 10-8 %. Содержание H2S и SO2 в атмосфере очень непостоянно. С учетом вклада антропогенных факторов концентрация каждого из газов оценивается около 2×10-8 %, суммарное количество серы в атмосфере — 14×105 т. Как следует из изложенного, своеобразие глобального цикла серы в биосфере обусловлено следующими причинами. Во-первых, способностью этого элемента под влиянием микробиологических процессов образовывать газообразные соединения (SO2, H2S и некоторые другие) и благодаря этому активно участвовать в массообмене между сушей и океаном, с одной стороны, и атмосферой — с другой. Во-вторых, трансформацией сернистых газов в хорошо растворимые сульфаты и заменой газовой миграции серы на водную. Это происходит благодаря быстрому окислению восстановленных и недоокисленных сернистых газов кислородом атмосферы и образованием хорошо растворимых сульфатов, легко вымывающихся из атмосферы и включающихся в водную миграцию. В-третьих, широким развитием сульфатредуцирующих бактериальных процессов в водных бассейнах и гидроморфных ландшафтах, куда поступают с водой растворенные сульфаты. Образующийся при разрушении сульфатов сероводород переводит растворенные в воде железо и другие металлы в форму труднорастворимых сульфидов, которые уходят в осадки морей и надолго прочно связывают крупные массы серы. Благодаря постоянному выводу серы в осадочной оболочке накоплено огромное количество этого элемента. Согласно данным А. Б. Ронова (1976), средняя концентрация сульфидной серы в осадочной оболочке составляет 0,183%, масса — 4,1×1015 т. Масса сульфатной серы — 5,2×1015 т, общее количество серы — 9,3×1013 т. В то же время во всем гранитном слое земной коры содержится 8,5×10'5 т серы. Если же учесть растворенную в океане сульфатную серу (1,2×1015 т), то очевидно, что в биосфере этого элемента имеется больше, чем его могло быть извлечено из гранитного слоя континентального блока земной коры даже при его полном разрушении. Распределение масс серы в биосфере убедительно свидетельствует, что они не выщелочены из гранитного слоя при выветривании, а привнесены в биосферу в результате дегазации мантии: Резервуар Масса, 109 т Атмосфера, S............................................................................ 0,0014 Мировая суша: биомасса растительности.............................................................. 8,5 органическое вещество педосферы........................................... 25,0 Океан: биомасса фотосинтетиков............................................................ 0,06 биомасса консументов.................................................................. 0,09 растворенные неорганические ионы.....................................1200000 Земная кора: -^ осадочная оболочка: S-сульфидная.........................................................................4 100 000 S-сульфатная...........................................................................5200000 гранитный слой континентального блока: S-сульфидная..........................................................................5 300000 S-сульфатная...........................................................................3300000
Значение живого вещества для глобальной геохимии серы в биосфере не менее велико, чем для углерода, хотя проявляется совершенно иначе. Если в биогеохимическом цикле углерода на суше главную роль играет сопряженная жизнедеятельность высших растений и почвенных микроорганизмов, то в биогеохимическом цикле серы основное значение имеет взаимодействие разных групп бактерий. Бактерии, синтезирующие органическое вещество, могут рассматриваться как продуценты, а разлагающие — как деструкторы (Заварзин Г. А., 1984). Взаимодействие таких групп способствует функционированию малых биогеохимических циклов. Так, фототрофные пурпурные серные бактерии окисляют сероводород с образованием сульфата в качестве метаболита:
Условием для продолжения деятельности серных бактерий является удаление главного продукта обмена — сульфат-ионов; удаление обеспечивается деятельностью вторичных анаэробных бактерий, для которых субстратом служит сульфат, а метаболитом — сероводород. Этой реакцией заканчивается малый цикл серы. Но анаэробный цикл серы, как все биогеохимические циклы, полностью не замкнут. Образующийся сероводород удаляется двумя путями. Во-первых, происходит связывание серы в виде черных гидратированных сульфидов железа — гидротроилита (мельниковита), в дальнейшем эволюционирующего в пирит и марказит. Во-вторых, сероводород мигрирует в атмосферу. По мнению Г.А.Заварзина (1984), вторичные аэробные бактерии серного цикла продуцируют большую часть сероводорода, поступающего в атмосферу. Поступление этого газа из вулканических источников значительно меньше. Определить микробиологическое продуцирование сернистых газов весьма сложно. По данным Дж. Фрейда (1976), в результате Деятельности микроорганизмов из океана в атмосферу выделяется 48×106 т/год серы. Одна ее часть в виде недоокисленных газов типа SO2 растворяется в воде (25×106 т), другая полностью окисляется до сульфатов и вымывается атмосферными осадками. По Мнению Дж. Фрейда, почвенные бактерии на суше выделяют в атмосферу в виде газов 58×106 т/год серы, из которых 15×106 т поглощаются растительностью, а 43×106 т окисляются в атмосфере до сульфатов и выпадают с атмосферными осадками. Кроме того, с поверхности континентов ветром захватывается значительная масса сульфатов в виде дисперсных твердых частиц, которые входят в состав аэрозолей и затем выпадают на поверхность. Оценить эту массу в настоящее время можно лишь очень приблизительно. Поданным А. Ю.Лейн и соавторов (1988), в эоловой эмиссии в атмосферу с последующим осаждением участвует масса серы, равная 8×106 т/год. Одно из наиболее интересных открытий биогеохимии заключается в установлении эффекта фракционирования изотопов живыми организмами. Компоненты живой клетки и внеклеточные метаболиты, как правило, обогащены легкими изотопами. Это явление, рассмотренное в разделе о биогеохимическом цикле углерода, не менее ярко выражено в биогеохимии серы. В природе известны четыре стабильных изотопа серы. Самый легкий из них 32S имеет распространенность (%) 95,1, другие: 33S — 0,74; 34S — 4,2; 35S — 0,016. Практический интерес представляет соотношение двух изотопов: 32S и 34S. Относительную распространенность этих изотопов можно определить по формуле
В качестве стандарта принята сера троилита из метеорита Каньон Диаболо, имеющая отношение 34S: 32S = 0,0450045. Любое соотношение двух изотопов серы в природных объектах может быть выражено через значение d34S, которое будет иметь знак плюс в! случае возрастания соотношения по сравнению с эталоном и знак минус при уменьшении этого соотношения. Установлено, что биогенные соединения серы — твердые и газообразные — обогащены легким изотопом. Наибольший эффект характерен для реакции биохимического восстановления сульфата до сероводорода, производимого бактериями Desulfovibrio desulphuricans. При этом в H2S увеличивается содержание легкого изотопа 32S, а не охваченные биогеохимическими процессами ионы [SO4]2- остаточно обогащаются изотопом 34S. В результате очень распространенного процесса микробиологической редукции сульфатов в биосфере произошло разделение серы на две части: серу биогенных сернистых газов и их производных (сульфидов), обогащенную легким изотопом, и серу сульфатов, в которых вследствие потери легкого изотопа произошло возрастание относительного содержания тяжелого изотопа 34S. Так как сульфаты аккумулированы в морях и океанах, то в океанической воде и эвапоритах значение d34S равно соответственно 20 и 17, а в осадочных породах, где, как отмечено ранее, присутствует значительное количество биогенного сульфида железа, d34S имеет значение -12. Сера H2S, продуцируемого сульфатредуцирующими микроорганизмами, имеет d34S до -43. Оценка масс серы, участвующих в массообмене в системах суша —тропосфера —суша и океан—тропосфера—океан, у разных авторов сильно различается. Так, выделение серы с поверхности океана в виде биогенных сернистых газов Дж.Френд (1976) и А.Цендер (1980) оценивают в 48×106 т/год, а А. Ю.Лейн и соавторы (1988) — в 7×106 т/год. Это связано с большими трудностями экспериментального определения масс сернистых газов, поступающих из разных источников. В то же время сернистые газы в атмосфере быстро окисляются и переходят в сульфатную форму, легко вымываемую атмосферными осадками. Следовательно, определив массу сульфатов, выпадающих на протяжении года с атмосферными осадками на поверхность океана, можно получить представление о суммарном количестве серы, поступающей в атмосферу в разных формах и из разных источников. Аналогичный прием можно применить по отношению к Мировой суше. Исходя из годового количества атмосферных осадков, выпадающих на поверхность Мирового океана (411×1015 л), и их средней минерализации (10 мг/л), можно считать, что на поверхность океана выпадает растворенных солей 4,1×109 т/год плюс 20 % от этой массы солей в форме сухих осаждений — 0,8×109 т/год S, всего 4,9×109 т солей в год, в том числе серы 0,28×109 т/год. Кроме того, как отмечено в разд. 3.3, 10 % от всей массы солей, находящихся над акваторией Земли, переносится с воздушными массами на сушу. Следовательно, можно считать, что разными путями (захват брызг морской воды, испарение, выброс пленок газовых пузырьков, выделение биогенных и вулканических SO2 и H2S) в атмосферу над океаном поступает около 0,31×109 т/год S, которая переходит в сульфатную форму и в количестве 0,83×109 т/год [SO4]2" или 0,28×109 т/год S выпадает на поверхность океана, а немногим менее 0,08×109 т/год [SO4]2- или 0,03×109 т/год S переносится на сушу. Большая часть Мировой суши (117×106 км2) дренируется реками, стекающими в систему Мирового океана. С этой территории испаряется 62×1015л/год воды, которая вновь выпадает в виде атмосферных осадков. Средняя концентрация [SO4]2~ в атмосферных осадках суши около 5 мг/л. Следовательно, с поверхности рассматриваемой территории ежегодно поступает в атмосферу и вновь возвращается 0,310×109 т [SO4]2- или 0,103×109 т S с осадками плюс 20 % в форме сухих осаждений серы 0,02- 109 т, всего 0,123×109 т S. Кроме того, на поверхность суши выпадает 44×1015л атмосферных осадков, принесенных воздушными массами с акватории, а вместе с этими осадками 0,03×109 т/год S. Территория площадью 32×106 км2 не имеет стока в океан. Здесь происходит замкнутый круговорот 7,5×10|5 л воды в год со средней концентрацией [SO4]2- около 30 мг/л. В этом круговороте принимает участие 0,225×109 т/год [SO4]2-, в том числе 0,75×109 т S. Итак, с поверхности Мировой суши на протяжении года поступает 0,198×109 т серы, а выпадает на 0,03×109 т больше за счет переноса с океана. В то же время с речным стоком выносится в океан в форме растворимых сульфатов 0,163×109 т S в год. На дне морей и океанов происходят интенсивные процессы редукции сульфатов, содержащихся в морской воде, и образование сульфидов железа. Количественная оценка образующихся масс сульфидов проблематична, данные авторов различаются в 100 раз: от 7×106 т S в год (Цендер А., 1980) до 100×106 т S в год и более. Согласно данным А.Ю.Лейн и соавторов (1988), осаждения сульфидной серы в океане составляют 0,111×109 т/год, сульфатной серы значительно меньше — 0,028×109 т/год. Интенсивность бактериальной сульфатредукции в явно восстановленных морских и океанических донных осадках изменяется в очень широких пределах — от 0,001 до 1,8 мг H2S на килограмм осадка в сутки. Возвращаясь к оценке различных источников поступления сернистых газов в биосфере, отметим, что выделение H2S с поверхности суши и океана измеряется десятками миллионов тонн серы в год. Эмиссия сероводорода особенно активно происходит на участках морских прибрежных мелководий и в ландшафтах болот. Как уже отмечалось, H2S и SO2 в атмосфере быстро окисляются и трансформируются в сульфатную форму. Но имеются сведения о том, что некоторая часть SO2 может растворяться в морской воде, а также поглощаться наземными растениями и почвой. Необходимо отметить значительное количество различных соединений серы, поступающих через гидротермы. Это количество А.Цендер и соавторы (1980) определили в 129×109 т/год серы в сульфатной форме. Эмиссия серы при собственно вулканических извержениях значительно меньше и разными авторами определяется от 2 т/год (Френд Дж., 1976) до 28 т/год (SCOPE - 21, 1983). Как ни важна роль хемолитотрофных бактерий в системе глобального массообмена серы, значение фотосинтезирующих организмов остается весьма существенным. На основании данных о продукции наземной растительности до ее нарушения хозяйственной деятельностью человека и среднем содержании серы в сухой биомассе наземной растительности, равном 0,34 %, можно полагать, что в биологическом круговороте на суше ежегодно участвовало 0,59×109 т серы. Средняя концентрация серы в фотосинтезирующих организмах океана значительно выше, чем в растениях суши, а именно 1,2% (Боуэн X., 1966). Соответственно в биологическом круговороте в океане участвует 1,32×109 т/год серы. Основные черты существующего массообмена серы, по-видимому, сложились более 0,5 млрд лет назад. Как показано в настоящем разделе, глобальный цикл серы в биосфере в значительной мере обусловлен биогеохимическими процессами. В то же время структура глобального цикла и распределение масс серы изменялись по мере того, как шло преобразование окружающей среды под воздействием деятельности живых организмов. Интересные данные получены при изучении изотопного состава серы отложений разного возраста. Установлено, что в отложениях, имеющих возраст более 2 млрд лет, существенного изменения в соотношении 32S и 34S не происходило. Это указывает на небольшой размах деятельности сульфатредуцирующих и серобактерий. Но в более поздних отложениях обнаруживаются сильные колебания в соотношении изотопов, что связано с избирательным поглощением живыми организмами легкого изотопа 32S. Около 1,7 млрд лет назад началось отложение мощных толщ морских сульфатов — гипсов и ангидритов. По-видимому, это было связано с нарастающим поступлением кислорода благодаря деятельности цианобактерий в интервале 2,8— 1,7 млрд лет назад. Согласно М. Шидловскому (1980), 38 % всего кислорода, поступившего на протяжении геологической истории, было связано в мощных толщах осажденных сульфатов (гипсов и ангидритов). Отложенные гипсы обогащены тяжелым изотопом 34S, что указывает на высокую активность бактерий, захвативших значительную массу легких изотопов, в том числе 32S. Благодаря этому гипсы оказались достаточно обогащенными тяжелым изотопом 34S. В глобальном цикле серы ярко выражена его сильная незамкнутость, проявляющаяся в непрерывном выведении из миграционных потоков крупных «избыточных» масс серы в виде сульфидов железа и сульфатов кальция (и отчасти магния). Благодаря выведению серы в океане и атмосфере поддерживается очень невысокое содержание сернистых газов. В то же время сера — один из главных компонентов газов, выделяющихся из недр Земли. Учитывая массы серы, содержащиеся в разной форме в осадочной оболочке и Мировом океане, можно заключить, что за время существования биосферы в нее поступило не менее 10,5×1015 т серы. Поступление соединений серы, образованных в результате хозяйственной деятельности людей, в атмосферу, педосферу и природные воды является одним из наиболее сильных проявлений воздействия человечества на окружающую среду. Основной техногенный поток серы в атмосферу связан с эмиссией сернистых газов, образующихся при сжигании минерального топлива и выплавке металлов. Главными путями загрязнения природных вод растворимыми соединениями серы являются смыв удобрений в гидрографическую сеть и сточные воды предприятий химической промышленности. Более 95 % выбросов техногенных сернистых газов приходится на SO2 и ее производные — SO3 и H2SO4, которые способствуют активизации коррозии металлов, оказывают поражающее действие на растения, животных и человека. Согласно И.И.Альтшулеру (1980), в середине 70-х годов прошлого столетия из разных источников в атмосферу ежегодно поступало 120×10б т SO2 и (4—5) ×106 т H2S. Это количество в начале XXI в. должно существенно возрасти. В атмосфере происходит быстрая трансформация SO2 в SO3 и затем в H2SO4. При взаимодействии с постоянно присутствующим в тропосфере аммиаком образуется сульфат аммония. В определенных условиях часть SO2 вымывается атмосферными осадками, поглощается растениями и почвой. Большая часть SO2 окисляется до [SO4]2-, который является самым распространенным ионом атмосферных осадков. Общее количество серы, поступающей в атмосферу из индустриальных источников, составляет около (100 — 110×106т/год. Определенный вклад в движение масс водорастворимых соединений серы, в частности в водный сток с континентов, вносит смыв минеральных удобрений — около (20 — 30)×106 т/год. Примерно такое же количество серы поступает со сточными водами промышленных предприятий химической, горной и металлургической промышленности. Как следует из данных табл. 7.3, техногенные выбросы соединений серы в окружающую среду не нарушают баланса масс, мигрирующих в глобальном цикле серы. В то же время соединения серы в индустриальных и бытовых отходах оказывают губительное воздействие на биоту обширных территорий, создавая опасность для нормального функционирования самого главного звена биосферы. Массированная эмиссия SO2 в атмосферу порождает так называемые кислотные дожди, распространяющиеся далеко за пределы индустриальных районов. Растворимые соединения серы в промышленных и бытовых стоках поражают экосистемы крупных внутриконтинентальных водоемов и шельфовых морей, не считаясь с государственными границами. Таблица 7.3
|
||||
|
Последнее изменение этой страницы: 2016-04-07; просмотров: 742; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.14.125.137 (0.012 с.) |