
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Чрезвычайным ситуациям и ликвидации последствий стихийных бедствийСодержание книги
Поиск на нашем сайте
Министерство Российской Федерации по делам гражданской обороны, Чрезвычайным ситуациям и ликвидации последствий стихийных бедствий ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ «УРАЛЬСКИЙ ИНСТИТУТ ГОСУДАРСТВЕННОЙ ПРОТИВОПОЖАРНОЙ СЛУЖБЫ»
ТЕОРИЯ ГОРЕНИЯ И ВЗРЫВА Методические указания и задания для выполнения контрольной работы слушателями II курса факультета заочного обучения По специальности 280104.65 – Пожарная безопасность Екатеринбург ТЕОРИЯ ГОРЕНИЯ И ВЗРЫВА. Методические указания и задания для выполнения контрольной работы слушателями II курса заочного обучения. – Екатеринбург: УрИ ГПС МЧС России, 2007. – 57 с.
Составители: Беззапонная О.В. – доцент кафедры химии и процессов горения, к.т.н. Вайтнер Е.В. – старший преподаватель кафедры химии и процессов горения, к.т.н. Русинова Е.В. – профессор кафедры химии и процессов горения, д.х.н.
Рецензенты: Баранова О.Ю. – доцент кафедры физики и теплообмена УрИ ГПС МЧС, к.т.н. Терзиян Т.В. – доцент кафедры высокомолекулярных соединений УрГУ им. А.М. Горького, к.х.н.
В заданиях и методических указаниях для выполнения контрольной работы слушателями факультета заочного обучения приведены условия задач контрольной работы, даны рекомендации по выбору варианта контрольной работы и разобраны примеры решения типовых задач.
Методические указания рассмотрены и одобрены на заседании Методического совета Уральского института ГПС МЧС России 20 декабря 2007 г.
© УрИ ГПС МЧС России, 2007 ВВЕДЕНИЕ
Изучение дисциплины «Теория горения и взрыва» на факультете заочного обучения слагается из цикла установочных и обзорных лекций, выполнения контрольной работы в межсессионный период, практических и лабораторно-практических занятий и сдачи итогового экзамена или зачёта. Начинать самостоятельное изучение дисциплины в межсессионный период необходимо с анализа рабочей программы курса и подбора рекомендуемой литературы. После изучения каждой темы рекомендуется составлять краткий конспект. При записи формул необходимо приводить принятые обозначения и размерности, входящих в расчётные формулы величин. Усвоив основные теоретические положения отдельных тем курса, слушатель может переходить к решению задач и выполнению контрольной работы по этой дисциплине. При самостоятельном изучении дисциплины «Теория горения и взрыва» в межсессионный период слушатели выполняют одну письменную контрольную работу. Вариант контрольной работы определяется в соответствии с номером зачётной книжки слушателя. В контрольную работу включены семь задач по основным темам дисциплины. При решении каждой задачи необходимо внимательно прочитать текст задачи, полностью переписать в тетрадь её условие, указать, что нужно рассчитать и привести ход решения задачи со всеми математическими преобразованиями. Ход решения задач должен сопровождаться краткими пояснениями. Должны быть записаны формулы, уравнения реакций, указаны соответствующие справочные пособия, которыми пользовался слушатель. В конце решения задачи следует сделать соответствующий вывод. Работа должна быть выполнена аккуратно, разборчивым почерком. В ней необходимо отвести поля для замечаний преподавателя, рецензирующего контрольную работу. В помощь слушателям при самостоятельном выполнении контрольной работы в методических указаниях приведены примеры решения типовых задач. Приступая к самостоятельному решению задачи контрольной работы, необходимо обдумать план её решения, сравнивая её с предложенным вариантом типовой задачи. В случае появления неясностей при выборе решения следует обратиться к теоретическому материалу той темы, на которую построена задача. Для удобства слушателей при выполнении контрольной работы в приложении к методическим указаниям даны некоторые необходимые справочные данные. ВЫБОР ЗАДАНИЯ И ВАРИАНТА ДЛЯ ВЫПОЛНЕНИЯ КОНТРОЛЬНОЙ РАБОТЫ 1. Номер контрольного задания выбирается в соответствии с предпоследней цифрой номера зачётной книжки. Соответствующие ему номера задач для решения указаны в таблице 1. 2. Номер варианта каждой из задач выбирается в соответствии с последней цифрой номера зачётной книжки из таблицы к условию соответствующей задачи. Пример. Номер зачётной книжки 02817. По предпоследней цифре зачётной книжки выбираем номер задания – задание № 1. По табл. 1 находим, что следует решать задачи 1, 3, 5, 7, 11, 12, 13. Для этих задач выбираем вариант, соответствующий последней цифре зачётной книжки (т.е. вариант № 7). Таблица 1
Работы, выполненные не в соответствии с данными указаниями, к проверке не принимаются.
Задача 1. Рассчитать объём воздуха и продуктов горения (в об. %), образующихся при сгорании 10 кг вещества (табл. 2), если горение происходит при заданных условиях (табл. 2) и коэффициенте избытка воздуха a (табл. 2). Объём продуктов горения привести к заданным условиям. Таблица 2
Задача 2. Рассчитать объём воздуха и продуктов горения при сгорании горючего газа (табл. 3) объёма V при заданных условиях (табл. 3), если горение происходит при избытке воздуха a. Таблица 3
Задача 3. Определить объём и состав продуктов горения (в об. %) смеси газов (табл. 4), если горение происходит при коэффициенте избытка воздуха a. Таблица 4
Задача 4. Определить, какое количество вещества (табл. 5) может выгореть в закрытом помещении объёмом Vп, если известно, что горение прекращается при содержании кислорода в помещении, равном
Таблица 5
Задача 5. Методом последовательных приближений рассчитать адиабатическую температуру горения для стехиометрической смеси горючего вещества с воздухом (табл. 6) Таблица 6
Задача 6. Вычислить температуру горения горючего вещества (табл. 7), если горение протекает при коэффициенте избытка воздуха a, а доля потерь тепла излучением составляет h. Таблица 7
Задача 7. Рассчитать, какое минимальное количество горючей жидкости (табл. 8) должно испариться в закрытом помещении объёмом Vп при нормальных условиях, чтобы создалась взрывоопасная концентрация горючих паров. Условно принять, что пары горючей жидкости равномерно распределены в объёме помещения. Нижний концентрационный предел распространения пламени рассчитать по предельной теплоте сгорания. Таблица 8
Задача 8. Рассчитать концентрационные пределы распространения пламени сложного состава при заданных условиях среды (табл. 9). Таблица 9
Задача 9. Рассчитать минимальную флегматизирующую концентрацию инертного разбавителя, об. %, исходя из минимальной адиабатической температуры горения паровоздушной смеси вещества А при разбавлении её флегматизатором Ф (табл. 10), а также минимальное взрывоопасное содержание кислорода и безопасную концентрацию кислорода.
Таблица 10
Задача 10. Рассчитать температурные пределы распространения пламени горючего вещества (табл. 11) по его концентрационным пределам распространения пламени, значения которых рассчитать по аппроксимационной формуле. Таблица 11
Задача 11. Рассчитать температуру вспышки или температуру воспламенения горючей жидкости (табл. 12) по формуле В.И. Блинова. Сравнить найденное значение с экспериментальным, взятым из справочника. Таблица 12
Задача 12. Рассчитать стандартную температуру самовоспламенения вещества (табл. 13) по средней длине углеродной цепи, определив число концевых групп и число цепей. Таблица 13.
Задача 13. Сферический заряд ТНТ (тринитротолуол) массой W (табл. 14) взрывается при стандартных атмосферных условиях. Найти параметры падающей и нормально отражённой от препятствия взрывной волны на расстоянии R (табл. 14) от центра взрыва. Таблица 14.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ К ИЗУЧЕНИЮ ТЕОРЕТИЧЕСКОГО МАТЕРИАЛА ДИСЦИПЛИНЫ И РЕШЕНИЮ ЗАДАЧ
Приступая к изучению курса, необходимо представлять, что горение – основной процесс на пожаре. Знание сути явления, законов горения, механизмов и способов его прекращения необходимы для успешной работы инженера пожарной безопасности в любой области его деятельности.
Решение. Сгорает индивидуальное горючее вещество, находящееся в газообразном состоянии. 1. Запишем уравнение реакции горения пропана в воздухе: С3Н8 + 5×(О2 + 3,76N2) = 3 CО2 + 4 Н2О + 3,76×5 N2
4. Рассчитаем состав продуктов горения:
Ответ: на сгорание 4 м3 пропана необходимо 95,2 м3 воздуха, при этом образуется 103,2 м3 продуктов горения, из которых СО2 – 11,6 %, Н2О – 15,5 %, N2 – 72,9 %.
Пример 2. Сгорает 100 кг ацетона. Рассчитать действительные объёмы воздуха и продуктов горения, если коэффициент избытка воздуха равен 2. Условия нормальные. Решение. Сгорает индивидуальное химическое соединение в конденсированном состоянии. 1. Составляем уравнение реакции горения ацетона в воздухе: С3Н6О + 4(О2 + 3,76 N2) = 3 CО2 + 3 Н2О + 4×3,76 N2 2. Объём воздуха, необходимый для сгорания 1 кг ацетона рассчитываем по формуле (7), учитывая при этом, что масса одного киломоля ацетона составляет 58 кг/кмоль:
3. Действительный объём воздуха, пошедшего на сгорание 1 кг ацетона рассчитывается с учётом коэффициента избытка воздуха a:
3. Избыток воздуха составит:
4. Теоретический объём продуктов горения рассчитываем по формуле (14):
5. Действительный объём продуктов горения составит:
7. Объём воздуха теоретически необходимого для сгорания 100 кг ацетона составит соответственно 740 м3 (7,4 × 100), при этом выделится 1 550 м3 продуктов сгорания. Ответ: При сгорании 100 кг ацетона объём воздуха при нормальных условиях составит 1 480 м3, а объём продуктов горения – 1 550 м3.
Примечание. Если в процессе горения была задана другая температура, то объём продуктов горения и воздуха рассчитывается с учётом объёма, который занимает один кмоль газа при этой температуре:
где Р0 =101,3 кПа; Т0 = 273 К; Т и Р заданные температура и давление.
Пример 3. Газовая смесь объёмом 10 м3, состоящая из 30 % ацетилена, 40 % пропана, 20 % углекислого газа и 10 % сгорает с 40 %-ным избытком воздуха. Вычислить объём воздуха, принимающего участие в горении, если процесс протекает при нормальных условиях. Решение. 1. Составляем уравнения реакций горения горючих газов смеси в воздухе: С2Н2 + 2,5 (О2 + 3,76 N2) = 2 СО2 + Н2О + 2,5 3,76 N2 С3Н8 + 5 (О2 + 3,76 N2) = 3 СО2 + 4 Н2О + 5×3,76 N2 2. Рассчитаем теоретические объёмы воздуха и продуктов горения при полном сгорании 1 м3 газовой смеси (формулы 8 и 15):
3. Рассчитаем действительные объёмы воздуха и продуктов горения с учётом 40 % - ного избытка воздуха (a = 1,4).
4. Поскольку объём горючей смеси составлял 10 м3, действительные объёмы воздуха и продуктов горения составят 176,7 и 192,9 м3 соответственно.
Пример 4. Определить объёмы воздуха и продуктов горения при сжигании 2 кг горючего вещества, имеющего элементный состав: С = 50 %; Н = 10 %; N = 10 %; золы = 12 %; влаги = 18 %. Считать, что воздух и продукты горения находятся при нормальных условиях. Решение. 1. Для решения задачи воспользуемся формулами (9) и (16).
2. При сгорании 2 кг горючего вещества образуется соответственно 14,34 и 16,14 м3 воздуха и продуктов горения. Ответ: При сгорании 2 кг горючего вещества образуется соответственно 14,34 и 16,14 м3 воздуха и продуктов горения.
Номограмма №2
ПРИЛОЖЕНИЕ Список принятых обозначений n – число молей вещества; Р - давление газа, Па; Р0 - исходное (атмосферное) давление, Па; Рs – давление падающей ударной волны, Па; Рr – давление отражённой ударной волны, Па; Т – температура вещества, К; Q – количество теплоты, Дж Vi – объём i-того газообразного вещества, м3, кмоль a - коэффициент избытка воздуха Тсвп – температура самовоспламенения, К Твсп – температура вспышки, К m – масса вещества, кг W – масса взрывчатого вещества, кг R – расстояние от эпицентра взрыва до точки наблюдения, м М – масса одного кмоля вещества, кг/кмоль Qн – низшая теплота сгорания вещества, кДж/моль, кДж/кг Нi – энтальпия i-го вещества, кДж/моль, кДж/м3 Тг – температура горения, К
h - коэффициент теплопотерь jн(в) - нижний (верхний) концентрационные пределы распространения пламени, % Тн(в) - нижний (верхний) температурные пределы Мр – число концевых функциональных групп li – длина i-той углеродной цепи. Тs – время прихода ударной волны, с; tа – время за которое давление в точке прихода взрывной волны возвращается к исходному (атмосферному) давлению, с;
Таблица I. Список литературы 1. Демидов П.Г., Саушев В.С. Горение и свойства горючих веществ / П.Г. Демидов, В.С. Саушев. - М.: М.: ВИПТШ МВД СССР, 1975. - 280 с. 2. Варнатц Ю., Маас У., Диббл Р. Горение. Физические и химические аспекты, моделирование, эксперименты, образование загрязняющих веществ. / Ю.Варнатц,У. Маас, Р. Диббл. - М.: Физматлит, 2003.- 352 с. 3. Демидов П.Г., Шандыба В.А., Щеглов П.П. Горение и свойства горючих веществ / П.Г. Демидов, В.А. Шандыба, П.П. Щеглов.- М.: Химия, 1981.-272 с. 4. Физика взрыва / Под ред. Л.П.Орленко.- 3-е изд.- В 2 т. М.: Физматлит, 2004. 5. Баратов А.Н. и др. Пожаровзрывоопасность веществ и материалов и средства их тушения.: Справ. / А.Н. Баратов и др.- М.: Химия, 1990.- Ч.1-2. 6. Кремпович Г.М., Прокофьев А.И., Восковский В.М. Специальная химия. Сборник задач / Г.М. Кремпович, А.И. Прокофьев, В.М. Восковский.- М.: МССШМ МВД СССР, 1988.- 106 с. 7. Баратов А.Н. Горение − Пожар − Взрыв − Безопасность: Моногр./ А.Н. Баратов; ФГУ ВНИИПО МЧС России- Москва, 2003.- 364 с.
СОДЕРЖАНИЕ
Министерство Российской Федерации по делам гражданской обороны, чрезвычайным ситуациям и ликвидации последствий стихийных бедствий ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ «УРАЛЬСКИЙ ИНСТИТУТ ГОСУДАРСТВЕННОЙ ПРОТИВОПОЖАРНОЙ СЛУЖБЫ»
ТЕОРИЯ ГОРЕНИЯ И ВЗРЫВА Методические указания и задания для выполнения контрольной работы слушателями II курса факультета заочного обучения
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-07; просмотров: 397; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.89.89 (0.011 с.) |

 . Для расчёта коэффициента избытка воздуха рекомендуется воспользоваться формулой (11).
. Для расчёта коэффициента избытка воздуха рекомендуется воспользоваться формулой (11). –СН2 – СН2 – СН2 – СН3
|
СН3
–СН2 – СН2 – СН2 – СН3
|
СН3
 –СН2 – СН2 – СН3
–СН2 – СН2 – СН3
 |
СН3
|
СН3
 (м3/м3);
(м3/м3); (м3/м3);
(м3/м3); (м3);
(м3); (м3).
(м3).
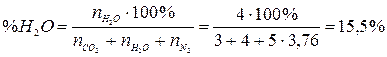
 .
.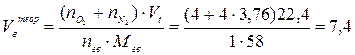 (м3/кг)
(м3/кг)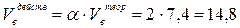 (м3/кг)
(м3/кг)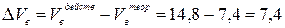 (м3/кг)
(м3/кг) (м3/кг)
(м3/кг) (м3/кг)
(м3/кг) (19)
(19) (м3/м3)
(м3/м3)
 (м3/м3)
(м3/м3) (м3/м3)
(м3/м3) (м3/кг)
(м3/кг)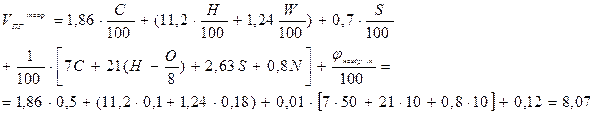 (м3/кг)
(м3/кг)
 - теплоёмкость i-го газа при постоянном давлении, кДж/моль×К; кДж/м3
- теплоёмкость i-го газа при постоянном давлении, кДж/моль×К; кДж/м3 


