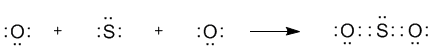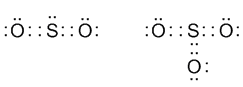Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Элементы с переменной валентностью.Содержание книги
Поиск на нашем сайте
До сих пор мы не объясняли причину переменной валентности некоторых элементов на основе строения их атомов. Давайте сделаем это на примере элемента 16S (серы). Действительно, почему сера в одних соединениях двухвалентна, в других - четырехвалентна, а в третьих - шестивалентна? Наконец, откуда именно такие, а не другие значения валентности - II, IV, VI? Теперь мы знаем достаточно для того, чтобы ответить на эти вопросы. Рассмотрим три реакции, в которых сера проявляет разные валентности: 2 H + S = H2S (валентность серы II), 2 O + S = SO2 (валентность серы IV), 3 O + S = SO3 (валентность серы VI). Сера располагает свои 16 электронов на 1-м, 2-м и 3-м уровнях: 1s2 2s2 2p6 3s2 3p4 Как обычно, нас интересуют только валентные электроны последнего уровня: ...3s2 3p4 В основном (не возбужденном) состоянии сера двухвалентна. В реакции с атомами водорода она образует соединение H2S потому, что у нее на двух p-орбиталях (из трех имеющихся) находится по одному электрону, и остается место для спаривания еще с двумя "чужими" электронами водородных атомов.
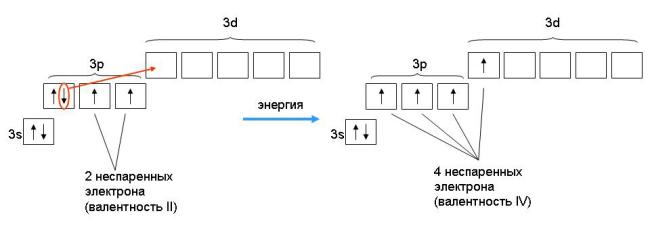
Однако, в отличие от атомов водорода или кислорода, у которых валентные электроны находятся на 1-м и 2-м уровнях (где нет d-подуровней), валентная оболочка серы имеет пустой 3d-подуровень. Этот 3d-подуровень находится достаточно близко по энергии к внешнему 3p-подуровню атома серы. При поглощении даже небольшой порции энергии один из 3p-электронов может переходить на 3d-подуровень (рис. 3-5). Затрата энергии при этом с лихвой покрывается выигрышем при образовании дополнительных ковалентных связей.
Рис. 3-5. Переход атома серы из основного состояния с валентностью II в первое возбужденное состояние с валентностью IV. Таким образом, на внешнем уровне возбужденного атома серы оказывается уже 4 неспаренных электрона. Эти 4 электрона могут быть предоставлены двум атомам кислорода для образования молекулы SO2.
Дальнейшее возбуждение атома серы (которое требует уже гораздо больше энергии) ведет к переходу одного из 3s-электронов на 3d-уровень (рис. 3-6). В результате атом серы получает шесть неспаренных электронов, которые предоставляются уже трем атомам кислорода для образования молекулы SO3.
Рис. 3-6. Переход атома серы во второе возбужденное состояние с валентностью VI.
Возникает вопрос: соблюдается ли правило октета в молекулах SO2 и SO3? На первый взгляд, у атома серы оказывается избыток (10 и 12) электронов и такие молекулы не должны быть стабильными. В чем же дело?
Объяснение заключается в большой разнице электроотрицательностей серы (X = 2,58) и кислорода (X = 3,44) - у кислорода она значительно выше. Можно предположить, что в молекуле SO2 кислород оттягивает с внешней оболочки атома серы именно столько электронов, сколько нужно для того, чтобы сделать ее похожей на октетную оболочку. Это можно показать даже с помощью структурных формул:
В каждой из таких "крайних" структур одна "лишняя" электронная пара всегда целиком сдвинута к одному из атомов кислорода. Реальная молекула, как полагают, является чем-то средним между этими двумя крайними структурами. Аналогичная ситуация в молекуле SO3, но ее строение описывается уже не двумя, а тремя крайними структурами (заметьте, что все они октетные):
Почему же не существует таких соединений, как H4S и H6S, где сера тоже проявляет валентность (IV) и (VI)? Вероятно, в этом случае правило октета для серы действительно оказалось бы нарушенным, поскольку водород недостаточно электроотрицателен, чтобы оттянуть "лишние" электроны с внешней оболочки атома серы. Поэтому такие соединения до сих пор не получены. Эти вещества должны быть чрезвычайно неустойчивы. Зато изначально "октетная" молекула сероводорода H2S вполне устойчива. Таким образом, сера может проявлять валентность IV и VI только в соединениях с более электроотрицательными элементами, чем она сама. Действительно, не существуют соединений K6S, Ca2S, и других подобных веществ, но вполне устойчив, например, газообразный фторид серы SF6. Электроотрицательность дает ответ и еще на один вопрос: почему в орбитальных диаграммах на рис. 3-5 и 3-6 мы не рисуем 4s-подуровень, который по энергии тоже близок к 3p- и 3d-подуровням? Из главы 2 мы знаем, что 4s-подуровень в большинстве атомов заполняется электронами даже раньше 3d-подуровня - сразу следом за 3p-подуровнем. Почему же его нет на орбитальных диаграммах? Вероятно, 4s-подуровень можно включать в орбитальные диаграммы, но это ровным счетом ничего не изменит, потому что при соединении серы с кислородом этот подуровень всего лишь будет выполнять роль "электрического провода", по которому электроны перетекают от атома серы к более электроотрицательным атомам кислорода или фтора.
К счастью, молекулярные орбитали в соединениях серы (IV) и (VI) не полностью повторяют электронные оболочки инертных газов, а всего лишь подобны им. Вспомним, что до сих пор не удается вовлечь неон и аргон в химические реакции. Если бы вещества SO2, SO3, SF4, SF6 оказались такими же устойчивыми, как инертные газы, мы бы просто не смогли получать из них другие полезные соединения, с которыми познакомимся позже. ** В этом параграфе вам встретились не совсем обычные "крайние" структуры оксидов серы SO2 и SO3. Например, в наборе крайних структур для SO2 у атома четырехвалентной серы только 3 валентных штриха, и в каждой из формул есть какой-то странный "одновалентный" кислород. Чтобы устранить эти противоречия, можно атому серы в "крайних" структурах приписать положительный заряд, а "одновалентным" атомам кислорода - отрицательные заряды. Кстати, это будет соответствовать реальному распределению зарядов в молекуле SO2, если помнить при этом, что заряды здесь на самом деле не полные, а частичные.
Соседство зарядов "+" и "-" на соседних атомах в данном случае заменяет недостающую простую связь между серой и кислородом. Важно понимать, что каждая из этих структур не существует в отдельности. Это как бы «чертеж» молекулы. Представьте чертеж какого-нибудь знакомого предмета - например, собачьей будки. Его можно начертить в трех проекциях: вид спереди, вид сбоку, вид сверху. Согласитесь, что нельзя изготовить для собаки один только «вид сверху» и заставить ее там жить.
Точно так же нельзя синтезировать каждую из крайних структур в отдельности. Они потому и называются крайними, что электроны в них смещены в крайние из возможных положений. В реальной молекуле такая ситуация никогда не реализуется полностью и она представляет собой нечто среднее между двумя или несколькими крайними структурами. Другое их название - резонансные структуры. Они находят широкое применение в органической химии для описания строения таких соединений, как бензол и его производные. Например, вот так можно показать, что существуют не два разных 1,2-дихлорбензола, а только один, молекула которого представляет собой нечто среднее между двумя крайними структурами, соединенными обоюдоострыми стрелками (атомы водорода в кольце здесь не показаны):
Такие обоюдоострые стрелки - это ни в коем случае не химическое равновесие между реальными молекулами, а знак перемещения электронов в гипотетические "крайние" положения одной молекулы. Задачи. 3.16. Изобразите структурные формулы хлорида фосфора (III) и хлорида фосфора (V). Объясните переменную валентность фосфора с точки зрения строения его атома. Будут ли, по вашему мнению, устойчивы соединения фосфора (III) и фосфора (V) с водородом? 3.17. (ФМШ). Изобразите структурные формулы следующих соединений хлора: HClO4, HClO3, HClO2, HClO (в этой молекуле нет связи H-Cl), HCl, Cl2. Объясните валентность хлора в этих соединениях с помощью орбитальных диаграмм. Может ли фтор образовывать подобные соединения? Ответ обоснуйте приложении. Предложите свое объяснение экспериментальным фактам.
*§3.6 Пространственная форма молекул. Формулы Льюиса многое говорят об электронном строении и устойчивости молекул, но пока ничего не могут сказать об их пространственном строении. В теории химической связи существуют два хороших подхода к объяснению и предсказанию геометрии молекул. Они хорошо согласуются между собой.
Первый подход называется теорией отталкивания валентных электронных пар (ОВЭП). Несмотря на “страшное” название, суть этого подхода очень проста и понятна:
|
|||||||
|
Последнее изменение этой страницы: 2017-02-22; просмотров: 300; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.185.202 (0.01 с.) |