
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Электронная конфигурация. Электронные формулы. Орбитальные диаграммы. Правило октета.
Наша задача - разобраться в том, как заполняются электронные уровни, подуровни и орбитали по мере усложнения атома. Существует условное изображение электронных уровней и подуровней, называемое орбитальной диаграммой. На такой диаграмме орбитали условно изображаются квадратиками, а электроны - стрелочками. Если стрелочки направлены в разные стороны, это означает, что электроны различаются между собой особым свойством, которое назывется спином электрона. В данный момент для нас не важна суть этого свойства. Требуется лишь понимать, что электроны могут чем-то отличаться друг от друга.
На схеме вверху вы видите орбитальную диаграмму атома водорода, у которого единственный электрон размещается на самом близком к ядру 1-м уровне. На этом уровне только одна s-орбиталь (на схеме она показана квадратиком). Собственно, квадратик с изображением внутри электрона-стрелочки и является орбитальной диаграммой. Теперь рассмотрим атом гелия:
В атоме гелия (2 протона в ядре) уже два электрона, причем оба еще могут поместиться на 1-м уровне. Значит, "адрес" этих электронов такой же, как у водорода: 1s. Но чтобы показать, что здесь находится уже не 1, а 2 электрона, пишут “адрес” с указанием количества “жильцов”-электронов: 1s2. Эта короткая запись описывает электронное строение атома гелия. Поэтому такие записи называют электронными формулами. 1s1 - электронная формула атома водорода. 1s2 - электронная формула атома гелия. Рассмотрим атом лития:
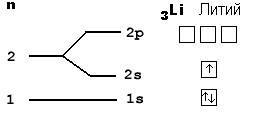
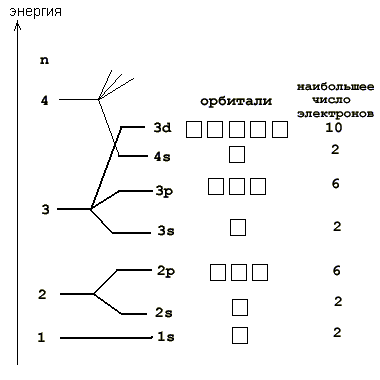
У него три протона в ядре, поэтому литий содержит в своем электронном облаке 3 электрона, для чего занимает электронами сначала весь 1-й уровень (там помещается только 2 электрона), а оставшийся электрон вынужден переместиться на более высокий 2-й уровень, где займет ближайшую к ядру свободную 2s-орбиталь. "Адрес" трех электронов этого элемента таков: 1s2 2s1. Мы записали электронную формулу для лития. Из этих простых примеров становится ясен принцип минимума энергии - при заполнении электронных оболочек в первую очередь заполняются более низкие, ближайшие к ядру уровни и подуровни. На рис. 2-8 показана более подробная орбитальная диаграмма для первых электронных уровней большинства атомов.
Рис. 2-8. Порядок заполнения орбиталей на первых, наиболее близких к ядру электронных уровнях в многоэлектронных атомах. Заполнение электронами происходит снизу вверх. Справа показано наибольшее количество электронов, способных разместиться на орбиталях данного подуровня. 4-й уровень показан не полностью. Чем дальше от ядра располагаются уровни и подуровни, тем выше их энергия. Для атомов, у которых мало электронов (например, 3Li) уровни и подуровни распределяются по энергии вполне логично: 1s, затем 2s, 2p, затем 3s, 3p, 3d, затем 4s, 4p, 4d, 4f … и т.д. Правда, об этом редко вспоминают, потому что у «легких» атомов 3-й и 4-й уровни пусты. Но с возрастанием числа электронов в многоэлектронных атомах все электроны начинают заметно взаимодействовать не только с ядром, но и друг с другом. В частности, электроны нижних уровней «заслоняют» электроны верхних уровней от влияния ядра (в физике это называется экранированием). Чем дальше от ядра, тем меньше становится разница между соседними уровнями и подуровнями. В результате некоторые верхние подуровни начинают «наезжать» друг на друга. Уже в атоме углерода 6С (у него 6 электронов) 3d-подуровень оказывается чуть выше по энергии, чем 4s. Такие аномалии еще чаще встречаются на более высоких уровнях. Вот как выглядит порядок заполнения уровней и подуровней в многоэлектронных атомах (это атомы большинства элементов):
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d,... Нет никакой необходимости запоминать эту последовательность. В главе 4 мы научимся легко извлекать ее из Периодической таблицы Д. И. Менделеева. Если говорить более строго, то относительное расположение подуровней обусловлено не столько их большей или меньшей энергией, сколько требованием минимума полной энергии атома. Исходя из этого требования, минимум энергии достигается у большинства атомов тогда, когда их подуровни заполняются в показанной выше последовательности. Но есть и исключения, которые вы можете найти в таблицах "Электронные конфигурации элементов" (см. меню слева). Однако эти исключения редко приходится принимать во внимание при рассмотрении химических свойств элементов. Пользуясь рис. 2-8, мы можем приступить к заполнению электронных уровней атомов многих элементов. Как нам уже известно, атом каждого элемента содержит строго определенное число электронов, равное числу протонов в его ядре (то есть заряду ядра). Правила заполнения электронных оболочек следующие:
1. Сначала выясняем, сколько всего электронов содержит атом интересующего нас элемента. Для этого достаточно знать заряд его ядра, который, как мы увидим в главе 4, всегда равен порядковому номеру элемента в Периодической таблице Д.И.Менделеева. Порядковый номер (число протонов в ядре) в точности равен и числу электронов во всем атоме. 2. Последовательно заполняем орбитали, начиная с нижней 1s-орбитали, имеющимися электронами (рис. 2-8). При этом нельзя располагать на каждой орбитали более двух электронов. 3. Записываем электронную формулу элемента. Электронная формула описывает распределение электронов по энергетическим уровням, существующим в электронном облаке. Такое распределение называется также электронной конфигурацией атома. Запись электронной формулы проще показать на конкретном примере. Допустим, нам надо выяснить электронную формулу элемента с порядковым номером 7. В атоме такого элемента должно быть 7 электронов. Заполним орбитали семью электронами, начиная с нижней 1s-орбитали. Итак, 2 электрона расположатся на 1s-орбитали, еще 2 электрона - на 2s-орбитали, а оставшиеся 3 электрона смогут разместиться на трех 2p-орбиталях.
Электронная формула элемента с порядковым номером 7 (это элемент азот, имеющий символ “N”) выглядит так:
Существует правило (оно называется правилом Гунда), по которому электроны предпочитают расселяться на одинаковых по энергии орбиталях (например, на трех p-орбиталях) сначала по одиночке, и лишь когда в каждой такой орбитали уже находится по одному электрону, начинается заполнение этих орбиталей вторыми электронами. Когда орбиталь заселяется двумя электронами, такие электроны называют спаренными. Посмотрим действие правила Гунда на примере элемента азота (1s2 2s2 2p3). На 2-м электронном уровне есть три одинаковых p-орбитали: 2px, 2py, 2pz. Электроны заселят их так, что на каждой из этих p-орбиталей окажется по одному электрону. Объясняют это тем, что в соседних ячейках электроны меньше отталкиваются друг от друга, как одноименно заряженные частицы.
Рис. 2-9. Правильная (а) и неправильная (б) орбитальная диаграмма азота. В соответствии с правилом Гунда орбитали заселяются сначала одиночными, а не спаренными электронами. По правилу Гунда при заполнении электронами одинаковых по энергии орбиталей электроны располагаются в первую очередь по одиночке на каждой орбитали, и лишь потом начинается заселение этих орбиталей вторыми электронами. Полученная нами электронная формула азота несет очень важную информацию: 2-й (внешний) электронный уровень азота заполнен электронами не до конца (на нем 2 + 3 = 5 электронов) и до полного заполнения не хватает трех электронов. Внешним уровнем атома называется самый далекий от ядра уровень, на котором еще есть электроны. Именно эта оболочка соприкасается при столкновении с внешними уровнями других атомов в химических реакциях. При взаимодействии с другими атомами азот способен принять 3 дополнительных электрона на свой внешний уровень. При этом атом азота получит завершенный, то есть максимально заполненный внешний электронный уровень, на котором расположатся 8 электронов.
Завершенный уровень энергетически выгоднее незавершенного (о том, как это выяснилось, вы узнаете уже в этом параграфе). Поэтому атом азота должен легко реагировать с любым другим атомом, способным предоставить ему 3 дополнительных электрона для завершения его внешнего уровня. Другой пример: элемент с порядковым номером 18. Действуя так же, как и в первом случае, мы с помощью рис. 2-8 расположим 18 электронов в следующую электронную формулу: 1s2 2s2 2p6 3s2 3p6 Элемент с порядковым номером 18 - это аргон (знакомый нам по предыдущей главе). Он уже имеет полностью завершенный внешний уровень и, следовательно, не склонен реагировать с другими элементами. Действительно, химическое поведение аргона настолько выделяется своей пассивностью среди других элементов, что он получил название инертного газа или благородного газа (последнее, вероятно, за свою "химическую лень"). Аргон (в переводе с греческого "недеятельный") не реагирует ни с одним химическим элементом. В свободном состоянии он существует не в виде двухатомных молекул (как другие газы), а в виде отдельных атомов (вот мы и ответили на один из вопросов параграфа 2.1 этой главы!) Инертность аргона такова, что до сих пор, несмотря на все попытки, не удалось получить ни одного его устойчивого соединения. ** Аргон является не единственным благородным или инертным газом. Существуют также элементы гелий (He, заряд ядра 2), что означает "солнечный" (впервые обнаружен на Солнце спектральными методами и только потом - в минерале клевеите); неон (Ne, "новый", заряд ядра 10); криптон (Kr, "скрытный", заряд ядра 36); ксенон (Xe, "странный", заряд ядра 54). Существует также радиоактивный благородный газ радон (Rn, заряд ядра 86), медленно выделяющийся из горных пород. Все эти газы в небольших количествах имеются в атмосфере. Из-за своей химической инертности благородные газы долго не были известны химикам. Аргон был открыт первым благодаря наблюдательности английского ученого Джона Уильяма.Рэлея. В 1892 году Рэлей столкнулся с загадочным фактом, который было трудно объяснить: газ азот, полученный из атмосферы, оказывался неизменно "тяжелее" азота, полученного путем его выделения из химических соединений. Если 1 л азота, полученного из воздуха, весил 1,2572 г, то 1 л азота, полученного разложением азотистых соединений, весил 1,2505 г!
Спустя два года они осуществили эксперимент по поглощению азота раскаленным магнием при пропускании искрового электрического разряда и выделили оставшийся в сосуде таинственный газ, который оказался в 20 раз тяжелее водорода. Это и был аргон. Впоследствии У. Рамзай провел эксперименты по дробной перегонке жидкого воздуха и открыл еще три инертных газа: неон, ксенон и криптон. Гелий также впервые был выделен Рамзаем в опыте по обработке минерала клевеита горячей серной кислотой. Многочисленные попытки химиков заставить благородные элементы вступать в химические реакции увенчались успехом лишь сравнительно недавно: начиная с 60-х годов известно несколько десятков соединений ксенона и криптона с наиболее "агрессивным" из всех химических элементов - фтором, а также с кислородом. Однако до сих пор неизвестно ни одного стабильного соединения гелия, неона и аргона. В 2000 г. появилось сообщение о получении гидрофторида аргона HArF, однако «подержать в руках» это соединение не удается: уже при очень низких температурах оно распадается. Зато вы можете подержать в руках сам аргон - им заполняют электрические лампочки накаливания (только не надо ломать лампочку - можно пораниться!). Аргон не реагирует с раскаленным металлическим волоском лампочки и хорошо отводит от него тепло. Мы получили электронную формулу аргона. Рассмотрим электронные формулы двух других благородных элементов с зарядом ядра 10 и 36 - неона и криптона. В их атомах содержится соответственно 10 и 36 электронов. Используя рис. 2-8 и правила заполнения электронных уровней получим:
Итак, электронные формулы этих благородных газов показывают, что неон имеет заполненный 2-й внешний уровень (n = 2), а криптон - заполненный 4-й внешний уровень (n = 4). На каждом таком полностью заполненном уровне находится по 8 электронов. ** Внимательный читатель может возразить, что внешняя оболочка криптона 36Kr, строго говоря, не является заполненной, поскольку свободны 4d- и 4f-орбитали. Действительно, правильнее говорить только о завершенных 4s и 4p-подуровнях криптона. Чтобы полностью заполнить 4-й уровень, следующие за криптоном элементы вынуждены перед 4d- и 4f-орбиталями заполнить сначала более "низкие" (по энергии) 5s- и 6s-подуровни. В результате элемент, имеющий, например, полный набор 4d-электронов, должен обязательно иметь еще и 5s-электроны. Такой элемент имеет пока незавершенный 5-й уровень. Причины необычайной устойчивости атомов с полностью заполненными s- и p-подуровнями до сих пор не совсем ясны. Нам полезно воспринять этот очень важный факт как известный химикам из природы, из опыта. В дальнейшем завершенность или незавершенность внешних уровней атомов позволит нам оценить многие химические
Отметим, что каждый заполненный внешний электронный уровень благородных элементов содержит (s2 + p6) то есть 8 электронов. Логично предположить, что именно заполненные внешние электронные уровни являются причиной химической инертности благородных элементов, поскольку все другие элементы имеют частично незаполненные внешние (s + p) электронные уровни. Но тогда логично выглядит и другое предположение: химические свойства "не благородных" элементов связаны с их стремлением завершить свои внешние электронные оболочки. Это предположение подтверждается многочисленными фактами и получило название правила октета (восьмерка - октет). Образно говоря, атомы элементов "любят" наряжаться в электронные одежды благородных газов. Они стремятся создавать завершенные внешние электронные уровни (оболочки) из 8 электронов, отдавая свои электроны другим атомам или, наоборот, принимая электроны других атомов. Такой обмен электронами и вызывает все многообразие химических реакций. Более строгая формулировка правила октета может выглядеть так: Атомы элементов стремятся к наиболее устойчивой электронной конфигурации. Устойчивой является электронная конфигурация с завершенным внешним электронным уровнем из (s2 + p6), т.е. из октета электронов. Только в одном случае завершенная оболочка может включать не 8, а 2 электрона. Благородный газ гелий (порядковый номер 2) имеет завершенную внешнюю оболочку из 2-х электронов (1s2). Причина этого исключения вполне понятна: на самом нижнем уровне помещается только одна s-орбиталь, на которой можно разместить не более двух электронов. Физический смысл правила октета при этом не меняется. Суть его в том, что только завершенная электронная оболочка наиболее выгодна для атома, поскольку в этом случае электронная конфигурация обладает наименьшей энергией. Впрочем, иногда правило октета называют и "правилом октета-дублета". С правилом октета тесно связаны донорные и акцепторные свойства атомов. Атомы - доноры электронов - склонны достигать октета, отдавая "лишние" электроны со своих внешних электронных уровней. Это атомы, у которых внешние электронные уровни только начинают застраиваться. Наоборот, атомы - акцепторы электронов легче достраивают свои внешние уровни до октета, принимая на них электроны других атомов. Обычно это элементы с уже почти завершенными внешними электронными уровнями. Как мы уже знаем, принимая или отдавая электроны, атомы могут превращаться в ионы. Например: 11Na (металл натрий: 1s2 2s2 2p6 3s1) - e- = 11Na+ (ион натрия: 1s2 2s22p6 - октет) 9F(газ фтор: 1s2 2s2 2p5) + e- = 9F- (ион фтора: 1s2 2s22p6 - октет) Для атомов со сходными электронными оболочками донорные и акцепторные свойства - при прочих равных условиях - зависят еще и от удаленности внешнего уровня от ядра. У маленьких атомов с небольшим числом уровней внешний уровень подвергается заметному влиянию ядра (электроны удерживаются крепче), а у больших (тяжелых) элементов внешние уровни как бы отделены от ядра "экраном" из нижних электронных уровней, поэтому электроны внешнего уровня удерживаются слабее. При прочих равных условиях - то есть при одинаковом строении внешних уровней, более акцепторные свойства проявляют более "легкие" элементы. Например, два близких по свойствам газа - фтор (порядковый номер 9) и хлор (порядковый номер 17) - имеют одинаковое строение внешних электронных уровней: Фтор (F): 1s2 2s22p5; Хлор (Cl): 1s2 2s2 2p6 3s23p5 Акцепторные свойства фтора выше, потому что его внешний электронный уровень находится ближе к ядру, чем у хлора. Это означает, что фтор (по сравнению с хлором) в химических реакциях ведет себя более "агрессивно" и легче заполняет свой внешний уровень до октета, забирая недостающий электрон у какого-либо другого элемента. Подтверждение этому факту мы уже знаем: существуют соединения фтора даже с благородными элементами ксеноном и криптоном, но до сих пор не известно соединений благородных газов с хлором. Может возникнуть вопрос: почему наиболее акцепторные свойства проявляет все-таки фтор, а не водород? Ведь атом водорода самый маленький, он имеет наименьшее расстояние от ядра до электронной оболочки, а для ее завершения тоже нужен всего один электрон. Дело в том, что отсутствие электронов (как в ионе H+) можно рассматривать как частный случай "завершенной" электронной оболочки. Поэтому частицы H+ относительно устойчивы. Например, они присутствуют в растворах кислот (хотя и не в свободном виде, а в окружении молекул растворителя) и придают таким растворам кислый вкус. Следовательно, атому водорода часто выгоднее "отдать" свой единственный электрон, чем "забирать" чужой. Впрочем, акцепторные свойства атомов водорода все-таки заметно выше, чем, например, у атомов натрия. Мы еще вернемся к донорным и акцепторным свойствам в следующей главе при рассмотрении химической связи и окислительно-восстановительных свойств элементов. Донорные и акцепторные свойства относительны. Донорные свойства элементов проявляются обычно в присутствии акцепторов, а акцепторные - в присутствии доноров. Задачи к главе 2 (кроме § 2.7) 2.8. Напишите электронные формулы для следующих элементов: 6C, 12Mg, 16S, 21Sc. 2.9. Элементы имеют следующие электронные формулы: а) 1s2 2s2 2p4. б) 1s2 2s2 2p6 3s2 3p1. в) 1s2 2s2 2p6 3s2 3p6 3d6 4s2. Какие это элементы? Напишите их латинские символы и названия на латинском и русском языках. 2.10. Элемент имеет внешний электронный уровень такого строения:...3p3. Что это за элемент? 2.11. Заполните пропуски в таблице:
2.12. Заполните пропуски в таблице:
2.13. Напишите электронную формулу для элемента с зарядом ядра Z = 12. 2.14. Какие из перечисленных атомов и ионов имеют электронные конфигурации, одинаковые с атомом 18Ar: Ca2+, Cl-, K, Na+, S2-, As3-, Al3+? 2.15. Какие из перечисленных подуровней не существуют: 2s, 4f, 2p, 3d, 1p, 2d, 1s, 3f? 2.16. Сколько электронов и протонов содержит молекула аммиака NH3? 2.17. Даны элементы с зарядами ядер Z = 3 и Z = 19. Который из них лучший донор электронов? 2.18. Перечисленные элементы разделите на доноры и акцепторы электронов. Сколько электронов нужно отдать или принять каждому из них, чтобы приобрести электронную оболочку благородного газа неона? Напишите символы соответствующих ионов этих элементов: O, Na, Al, Mg, F. 2.19. Атом превращается в ион, если принимает или отдает электроны с внешней оболочки. Напишите электронные формулы элементов с зарядами ядер Z = 3 и Z = 9. Руководствуясь правилом октета, ответьте на вопрос: какой из этих элементов склонен образовывать отрицательно заряженные, а какой - положительно заряженные ионы? 2.20. Даны элементы с зарядами ядер Z = 7 и Z = 15. Который из них лучший акцептор электронов? ** 2.21. Напишите электронную формулу элемента с зарядом ядра Z = 23. Нарисуйте орбитальную диаграмму последней (внешней) электронной оболочки. ** 2.22. Даны два элемента - с зарядами ядер Z = 17 и Z = 18. Один из них - ядовитый газ с резким запахом. Другой не ядовит, лишен запаха, не поддерживает дыхания. Напишите электронные формулы обоих элементов. Какой из них ядовит? ** 2.23. Нарисуйте орбитальную диаграмму для углерода (заряд ядра Z = 6). Сколько неспаренных электронов на внешней электронной оболочке углерода? ** 2.24. На основании строения атома выберите из двух частиц более сильный акцептор электронов: а) атом F, б) ион Na2+. ** 2.25. Представьте, что у вас имеются точнейшие весы, на которых можно взвешивать атомы элементов. Укажите, какая из частиц в каждой паре будет тяжелее: а) F и F- б) Na и Na+ в) F- и Ne
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-22; просмотров: 496; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.12.1 (0.048 с.) |

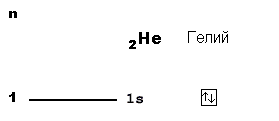


 Менее аккуратный исследователь либо не заметил бы такую маленькую разницу, либо отнес ее за счет погрешности измерений. Но Рэлей многократно повторил свои опыты и выяснил, что это не случайность. Вместе с другим британским ученым - Уильямом Рамзаем - он пришел к выводу, что в атмосферном азоте, очищенном от других известных газов, может скрываться какой-то новый, неизвестный ранее “тяжелый” газ.
Менее аккуратный исследователь либо не заметил бы такую маленькую разницу, либо отнес ее за счет погрешности измерений. Но Рэлей многократно повторил свои опыты и выяснил, что это не случайность. Вместе с другим британским ученым - Уильямом Рамзаем - он пришел к выводу, что в атмосферном азоте, очищенном от других известных газов, может скрываться какой-то новый, неизвестный ранее “тяжелый” газ.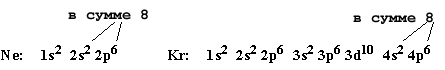
 свойства элементов.
свойства элементов.


