
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Предмет химии. Физические и химические превращения.Стр 1 из 18Следующая ⇒
Глава №1 Вещество. Вы уже изучали физику и привыкли к понятию "физическое тело". Физическое тело - это любой предмет, имеющий объем, массу, плотность, температуру, твердость, вязкость, электропроводность и многие другие подобные свойства, называемые физическими. Допустим, этот предмет - кусочек свинца. В физическом эксперименте можно, например, бросать свинцовый предмет с разной высоты, чтобы определить ускорение свободного падения. В другом опыте можно измерить объем этого кусочка и определить плотность свинца. Можно нагреть свинец, чтобы расплавить его и определить температуру плавления. Можно измерить электропроводность свинца. А можно погрузить в воду и измерить выталкивающую силу. Во всех этих опытах будут проявляться разные физические свойства предмета. Но если в первом опыте с бросанием предмета не так уж и важно, из чего он сделан - из свинца, резины или железа, то во всех остальных опытах исследователь получит совершенно разные результаты для свинцового, резинового и железного физического тела. Значит, во многих случаях важно, из какого вещества сделан тот или иной предмет. То, из чего состоят физические тела, то есть окружающие нас предметы, называется веществом.
Но если измерять температуру плавления или электропроводность предмета, сделанного из того же натрия, то эти опыты, скорее всего, окончатся благополучно, хотя результаты будут отличаться от опытов с физическими телами из какого-нибудь другого вещества.Вы можете посмотреть видеоопыт из "Единой коллекции цифровых образовательных ресурсов". Если при взаимодействии натрия с водой и происходит взрыв, то взрывается не натрий, а газ водород, выделяющийся в реакции. Смесь водорода с кислородом (или воздухом) не зря называют «гремучим газом». Другой продукт реакции – щелочь NaOH. Её присутствие в растворе можно обнаружить с помощью индикатора фенолфталеина (раствор становится малиновым). В опыте, который вы увидите, кусочек натрия достаточно мал и взрыв гремучего газа, к счастью, не происходит.
К химическим явлениям относят такие явления, при которых одни вещества превращаются в другие. Химические явления называют иначе химическими реакциями. Физические явления не сопровождаются превращением одних веществ в другие. Наш исследователь, сам того не желая, проделал типичную химическую реакцию между натрием и водой. Натрий и вода при этом превратились в другие вещества. К счастью, лишь немногие химические превращения протекают так же бурно. При изучении химии в школе мы будем иметь дело со "спокойными" и давно изученными превращениями. А вот профессиональным химикам часто приходится быть настороже: даже тогда, когда впервые изучаемые химические превращения идут без взрывов, нужно помнить о том, что в эксперименте могут получаться новые, неизвестные ранее вещества, обладающие какими-нибудь необычными свойствами. Задачи 1.1. Среди окружающих вас предметов многие состоят из веществ, не существующих в природе в готовом виде и полученных на химических производствах. Назовите хотя бы пять из них. 1.2. Придумайте ситуацию: с помощью какого-нибудь предмета совершается действие, и при этом совершенно неважно, из какого вещества состоит этот предмет (учтите, придумать такую ситуацию довольно сложно). 1.3. В городе работают три электростанции: тепловая (на угле), ветряная и гидроэлектростанция. В каком случае для получения электричества используется энергия химического превращения? 1.4. Завод производит: а) железо из железной руды; б) железо из металлолома; в) железную проволоку из железных заготовок; г) щебень из гранита. Какие химические и физические превращения здесь перечислены? 1.5. Среди определений различных предметов укажите те, которые дают его химическую характеристику:
а) черная тяжелая железная гиря; б) красное пластмассовое ведро; в) длинный гнутый ржавый гвоздь; г) холодная разменная медная монета. Найдите среди определений указание на протекание химической реакции. 1.6. Разделите явления на физические и химические: - вода превращается в пар, - вода превращается в лед, - желудок переваривает пищу, - брусок дерева нагревается трением, - брусок дерева дымится от трения, - кусок стекла раскалывается в костре, - дрова сгорают в костре. Таблица 1-1. Состав атмосферного воздуха в сосновом лесу.
В таблице 1-1 азот, кислород, аргон и т.д. - это отдельные вещества. Вещество азот состоит из молекул азота, всем известное вещество вода - из молекул воды, терпинеол состоит из молекул терпинеола. Молекулы веществ могут быть очень разными - от простейших, состоящих из двух-трех атомов (азот, кислород, озон, углекислый газ) - до молекул, состоящих из многих атомов (такие молекулы встречаются в живых организмах). Например, терпинеол, который образуется в хвойных деревьях и придает воздуху запах свежести. Это означает, что веществ, как и видов молекул, может быть бесконечное множество. Никто не может назвать точное число веществ, известных людям сегодня. Можно лишь ориентировочно сказать, что таких веществ - более семи миллионов. Атомы в молекулах разных веществ связаны друг с другом в строго определенном порядке, установление которого - одно из самых интересных занятий в работе химика. Устройство и состав молекул можно описывать разными способами, например так, как это сделано на рис. 1-1, где атомы имеют вид шариков. Размеры шариков имеют физический смысл и примерно соответствуют относительным размерам атомов. Те же самые вещества могут быть изображены иначе - с помощью химических символов. Издавна за каждым видом атомов в химии закреплен символ из латинских букв. В таблице 1-2 приведены символические записи веществ, изображенных на рис. 1-1. Такие символические записи называются химическими формулами.
Таблица 1-2. Химические формулы веществ из рис. 1-1. Цифра ниже символа показывает, сколько атомов данного вида содержится в молекуле. Эта цифра называется индексом. По традиции индекс "1" никогда не пишут. Например, вместо С1О2 пишут просто: СО2.
Часто физическое тело состоит из молекул нескольких разных веществ. Такое физическое тело называется смесью. Например, воздух - смесь нескольких простых и сложных веществ. Не нужно путать сложное вещество со смесью. Сложное вещество, если оно состоит из молекул только одного вида, смесью не является.
Задачи. 1.7. Представьте, что у вас в руках волшебная палочка и вы превращаете: а) камень в песок; б) кислород в озон; в) лед в пар. В каком случае вы проводите химические превращения? 1.8. Найдите простые вещества среди перечисленных веществ: воздух, вода, озон, мед, морская вода, кислород, азот. 1.9. Из перечисленных веществ два являются смесями. Найдите их: а) кислород, б) озон, в) вода в реке, г) вода в облаке, д) поваренная соль, е) воздух, ж) сахар. Смеси. Разделение смесей. Абсолютно чистое вещество, не содержащее примесей других молекул, получить чрезвычайно трудно. Поэтому на практике чистым называют вещество, состоящее из молекул одного вида, в котором других молекул настолько мало, что они не влияют на его свойства. ** Например, воду из родника мы считаем вполне чистой и пригодной для питья, потому что мельчайшие примеси в ней для нас просто неощутимы. Но для некоторых научных и технических целей такая вода совершенно непригодна. Например, в замкнутых контурах атомных электростанций нужна еще более чистая вода, иначе трубы, по которым она циркулирует, быстро выйдут из строя. Но иногда бывает нужна еще более чистая вода! Для получения и хранения такой сверхчистой воды даже стеклянная посуда уже не подходит, потому что из стекла в воду попадают другие молекулы. Годится только кварцевая посуда, а над поверхностью воды не должно быть воздуха, потому что многие газообразные вещества (углекислый газ, азот, кислород) растворимы в воде и "загрязняют" ее. Реальные вещества всегда содержат какие-то примеси. Даже лекарственные вещества (например, аспирин - рис. 1-2), к чистоте которых предъявляются особые требования, Рис. 1-2. Модель молекулы аспирина (ацетилсалициловой кислоты) C9H8O4. Серые шары - атомы углерода, белые - водорода, красные - кислорода. Не нужно думать, что чистые вещества абсолютно во всех случаях лучше смесей. Например, нельзя дышать чистым кислородом. Если бы из атмосферы вдруг по каким-то причинам исчез азот, “разбавляющий” кислород до безопасного уровня, все живые организмы на суше погибли бы в течение нескольких часов, а растительность на всех континентах была бы полностью уничтожена чудовищным пожаром
Многие лекарства являются смесями. Провизоры в аптеках приготовляют из чистых лекарственных веществ микстуры, что в переводе с латинского означает именно смеси. Особым случаям смесей являются растворы. Если смесь глины с песком можно на глаз отличить от песка и глины, то растворив поваренную соль в воде, мы получим прозрачную жидкость, по внешнему виду неотличимую от воды. Однако в этой смеси частицы, составлявшие ранее кристаллы соли, равномерно распределены в толще молекул растворителя (воды). Если позволить воде испаряться, то соль выпадет на дно сосуда в виде тех же кристаллов. Химического превращения не происходит - соль и вода остаются самими собой. ** Если даже лекарства не бывают абсолютно чистыми, то что же тогда можно называть (в широком смысле) чистым веществом, а что - смесью? К счастью, есть такие физические свойства вещества, которые перестают изменяться после того, как количество примесей уменьшается до определенного предела. Для очень многих целей вещество с такими неизменными свойствами можно считать чистым. Эти физические свойства - точка плавления и точка кипения. Если плавление образца какого-нибудь вещества не растягивается на несколько градусов, а происходит в пределах одного градуса - то такое вещество химик обычно называет чистым. Если вещество кипит при одной температуре, которая не изменяется по мере испарения образца - то это тоже, скорее всего, чистое вещество. Конечно, из этих правил бывают исключения, поэтому окончательный вывод о чистоте вещества можно сделать только на основании анализа. Что такое химический анализ - об этом мы поговорим позже. Как же выделяют чистые вещества из смесей? Для этого существует несколько способов. Опишем некоторые из них. Чтобы задача выглядела полезной с практической точки зрения, рассмотрим очистку воды. Допустим, в нашем рапоряжении есть около полулитра загрязненной воды. В любом населенном пункте найти такую воду - не проблема (можно взять воду из лужи или пруда). Приступим к ее очистке сначала простыми, а потом все более сложными методами. 1. ОТСТАИВАНИЕ. а) Нальем грязную воду в химический стакан и дадим спокойно постоять:
б) Тот же стакан через 30 минут. Наиболее крупные частицы примесей осели на дно. Жидкость в верхней части стакана стала светлее. Если на поверхности имеется тонкая радужная пленка - значит, вода загрязнена не только частичками почвы, ила, но и нефтепродуктами:
2. ФИЛЬТРОВАНИЕ. Осторожно сольем жидкость с осадка в воронку, в которую вставлен фильтр из пористой бумаги. Воронка находится в другом сосуде, в котором скапливается уже гораздо более чистая вода. На фильтре оcтаются мелкие частицы примесей. Полученная вода еще не пригодна для питья, так как в ней содержатся бактерии, а также растворенные органические вещества и соли. Но полученная нами вода уже вполне пригодна для того, чтобы помыть доску или полить цветок:
. ПЕРЕГОНКА или ДИСТИЛЛЯЦИЯ. Соберем прибор, показанный на рисунке, перельем загрязненную воду в перегонную колбу, поместим туда же кипелки (мелкие кусочки фарфора или кирпича, которые нужны для спокойного кипения жидкости), включим стеклянный холодильник (охлаждается водопроводной водой) и нагреем жидкость в колбе до кипения. Вода превращается в пар, который через стеклянную насадку попадает в холодильник и конденсируется. Термометр в верхней части колбы должен показывать 100 градусов - температуру кипения воды. Первые 1-2 мл дистиллята следует отбросить, потому что в воде могут находиться примеси легких нефтепродуктов (бензина). Когда перегонка подходит к концу, следует быть внимательным и оставить немного жидкости в колбе, чтобы не перегонялись другие, более высококипящие примеси (следы тяжелых нефтепродуктов). Остаток в колбе содержит все ранее растворенные в воде соли, остатки механических загрязнений и выглядит не очень привлекательно. Зато воду, собранную на выходе из прибора, можно безбоязненно пить.
А так лабораторная установка для перегонки выглядит на фотографии:
** С помощью перегонки можно очищать не только воду, но и другие жидкости. Если это летучие, пахучие, боящиеся влаги или токсичные жидкости (а таких немало среди органических веществ), то обязательно используют закрытый приемник (как на верхней схеме), а аллонж соединяют с атмосферой через специальную защитную трубку с подходящим наполнителем. Установку собирают не на лабораторном столе, а в вытяжном шкафу. По показаниям термометра во время перегонки можно судить о том, какая именно жидкость перегоняется в данный момент. Таким образом, не только неоднородные смеси (вода с частицами почвы), но и однородные смеси (растворы) могут быть разделены с помощью перегонки. Отстаиванием и фильтрованием однородные смеси (растворы) разделить невозможно. ЗАДАЧИ К ГЛАВЕ 1. 1.10. Придумайте опыт, в котором можно было бы выяснить, не пробуя на язык, что в колбе находится раствор поваренной соли, а не чистая вода. 1.11. Одно из следующих выражений не имеет смысла. Найдите его: а) "молекула аспирина", б) "молекула воздуха", в)"молекула терпинеола", г) "молекула азота". 1.12. Среди перечисленных явлений только одно - химическое. Найдите его: а) сахар расплавили на огне, б) сахар растворили в воде, в) соль растворили в воде, г) сахар обуглили на огне, д) смешали соль и сахар. 1.13. Среди перечисленных простых, сложных веществ и смесей только одно можно назвать сложным веществом. Найдите его: а) раствор углекислого газа в воде, б) углекислый газ, в) кислород, г) раствор кислорода в воде, д) озон. 1.14. Азот растворили в воде под давлением. Назовите полученное физическое тело. 1.15. В параграфе 1.4 была изображена молекула лекарственного вещества аспирина C9H8O4. Ответьте на следующие вопросы: а) Каким веществом является аспирин - простым или сложным? б) Аспирин, как и многие другие вещества, состоящие в основном из атомов углерода (обозначение атома углерода - символ "С"), сгорает в кислороде без остатка с образованием углекислого газа СО2 и воды Н2О. Если мысленно разобрать молекулу аспирина на атомы и добавить к ним некоторое количество атомов кислорода, то сколько молекул Н2О и СО2 получится из одной молекулы аспирина? в) Сколько молекул кислорода О2 потребуется для превращения одной молекулы 2) Нашего неудачливого исследователя из параграфа 1.1, который пытался погрузить натрий в воду, зовут Юх (от слов "юный химик"). Если бы в замечательной сказке Николая Носова "Приключения Незнайки и его друзей" был коротышка, который любил всё смешивать и смотреть, что получится, то его, вероятно, звали бы именно так. Правда, химию он знал пока не очень хорошо, но зато очень любил химические опыты. Однажды Юх нашел кусок какого-то металла и расплавил его на электрической печке. Сняв с печи щипцами тигель (это чашечка из тугоплавкого материала), в котором булькал расплавленный металл, Юх поставил его на деревянный стол и вышел за своим рабочим журналом, в который всегда старался аккуратно записывать результаты опытов. Когда через минуту он вернулся, то обнаружил, что стол горит, а на стенах комнаты оседает черная копоть. Не растерявшись, Юх вылил на стол ведро воды. Раздалось шипение, комната наполнилась паром, тигель треснул на несколько осколков, а бесформенный кусок металла упал на пол. Убирая комнату, Юх задумался над тем, какие явления он наблюдал и пришел к выводу, что происходили только физические явления. На самом деле он ошибся. Найдите в тексте задачи вещество (или вещества), которое (или которые) образовались в результате химического превращения.
Глава №2 Атомы. Атомы не сразу вошли в научный обиход, хотя само слово "атом" появилось еще в сочинениях древнегреческих философов. В переводе с греческого оно означает "неделимый". Философы объясняли окружающий мир доступными средствами, среди которых не было современных приборов, но были наблюдательность и логика. Чисто логическим путем можно прийти к выводу, что дробление вещества не может происходить бесконечно. В конце концов должна остаться некая мельчайшая и неделимая крупинка вещества или атом вещества. Если бы таких неделимых крупинок не оставалось, то любую вещь можно было бы уничтожить до конца. А раз так, то новые вещи (и даже животные, растения) создавались бы из ничего. По мнению древнегреческих философов Левкиппа и Демокрита, это противоречило бы здравому смыслу. О том, каким образом атомы соединяются в более крупные физические тела, люди того времени не имели представления. Было много и других неясностей, поэтому учение об атомах практически не развивались долгие два тысячелетия. Но постепенно накапливалось все больше и больше фактов, которые в конце концов привели к тем представлениям, с которыми вы уже коротко познакомились в первой главе. Строение веществ начали описывать с помощью молекул, составленных из атомов одного или нескольких видов. В предыдущей главе было показано устройство молекул некоторых простых и сложных веществ. Эти очень разные по своим свойствам вещества состоят из молекул, "построенных" из атомов только пяти видов. Но атомы взяты в разных количествах и соединены по-разному. Чем отличаются атомы разных видов друг от друга? Почему атомы в этих молекулах соединились именно так, а не иначе? Почему атомы азота и кислорода соединились по два, но атом аргона остается в одиночестве? Можно ли в молекуле углекислого газа соединить тот же набор атомов по-иному? Как атомы "прикрепляются" друг к другу? Ответы на эти и многие другие вопросы, которые встретятся нам дальше, невозможно получить, не разобравшись в устройстве атома. Дело в том, что знание внутреннего устройства атома позволяет объяснять и даже предсказывать многочисленные свойства окружающих нас веществ. Конечно, выяснить строение такого необычного, невидимого глазу объекта было чрезвычайно трудно. Однако изобретательный человеческий ум справился даже с такой сверхтрудной задачей. О том, как это удалось осуществить, коротко рассказывается в следующем параграфе (а более подробно - в параграфе 2.7). Те из вас, кому не терпится узнать - что же именно удалось выяснить в строении атома, могут перейти к параграфу 2.3. Но если вам интересно разобраться в том, как это происходило, мы советуем сначала прочитать. Таблица 2-2. Символы, названия, атомные веса и природный изотопный состав некоторых химических элементов.
Названия элементов на латинском и русском языке и латинские символы этих элементов приведены для того, чтобы мы постепенно начинали знакомиться со всеми элементами. ** Обратите внимание: все изотопы какого-нибудь одного элемента обозначаются одним и тем же символом. Например, О - любой изотоп кислорода, N - любой изотоп азота и т.д. Меняются только массовые числа в верхней части символа. Единственное исключение - изотопы водорода 21H и 31H, которые удостоились в науке собственных названий и символов: D (дейтерий) и T (тритий) за особую роль, которую они играют в ядерной физике и в химии при изучении механизмов химических реакций. Тритий радиоактивен и в природе его исчезающе мало. Чтобы отличать от дейтерия и трития "обычный" водород 11H, его иногда называют протием. Однако всё это - один и тот же элемент водород (Hydrogenium). Из приведенной таблицы видно, что средний измеренный атомный вес найденного в природе элемента зависит от того, сколько в нем содержится разных изотопов. Итак, в первой колонке таблицы 2-2 приведено русское название элемента. Ниже - латинский символ элемента, связанный обычно с его латинским названием. Слева вверху от символа элемента указываются массовое число (сумма протонов и нейтронов в ядре), а слева внизу - заряд ядра атома (количество протонов). Например:
Как видно из таблицы 2-2, атомные веса элементов, найденных в природе в виде единственного изотопа (например, натрия), в точности равны атомному весу этого изотопа. Иначе обстоит дело с элементами, которые существуют на Земле в виде нескольких изотопов (например, хлор, кислород): их атомный вес зависит от того, какой изотоп этого элемента наиболее распространен и сколько в нем "примесей" других изотопов этого элемента. Атомный вес элемента равен среднему значению из атомных весов всех его природных изотопов с учетом их распространенности. ** Например, элемент хлор в природе находится в виде двух изотопов: хлор-35 и хлор-37. Их содержание составляет 75,53% и 24,47% (см. табл. 2-2). Если общее содержание двух изотопов хлора в сумме принять за единицу, то одного из них - примерно 0,75 и другого - примерно 0,25 (в долях единицы). Тогда атомный вес природной смеси двух изотопов хлора округленно равен: 34,97× 0,75 + 36,96× 0,25 = 35,5. Можно решать и обратную задачу. Допустим, точно известно, что природный хлор состоит из двух изотопов 35Cl и 37Cl. Найденный в эксперименте атомный вес природного хлора составил 35,5. Сколько каждого изотопа содержится в природном хлоре? Если принять сумму изотопов за единицу, а содержание, например, 35Cl за x, то содержание изотопа 37Cl составит (1 - x). Тогда: 35x + 37(1 - x) = 35,5. Решив это простое уравнение, получим содержание изотопа 35Cl равным 0,75 или 75%. Есть еще один важный фактор, влияющий (хотя и в меньшей степени) на атомный вес элемента - дефект массы. Внимательный читатель мог заметить некоторые "странности" в табл. 2-2. Например, атомная масса единственного изотопа натрия 2311Na немного меньше, чем 23 а.е.м. Но нам уже известно, что массы протона и нейтрона чуть больше 1 а.е.м. Почему же атом натрия, содержаший в своем ядре 11 протонов и 12 нейтронов имеет массу меньше 23 (22,9898 а.е.м.)? То же явление хорошо заметно для изотопов кислорода и хлора (см. табл. 2-2). Дело в том, что связывание между собой одноименно заряженных протонов в ядрах атомов требует больших затрат энергии. Нейтроны тоже участвуют в этом связывании, выполняя роль своеобразного ядерного "клея". При этом часть массы протонов и нейтронов переходит в энергию связывания нуклонов в ядре. Такая потеря массы протонов и нейтронов, возникающая в результате их связывания, называется дефектом массы. Таблица 2-3. Названия и символы некоторых элементов.
Задачи 2.1. Сколько протонов и сколько нейтронов содержится в ядре атома кислорода 168О? 2.2. Сколько протонов, нейтронов и электронов содержится в атоме элемента бора 115B? 2.3. Сколько электронов содержится в электронной оболочке иона натрия 2311Na+1 ? 2.4. В атоме элемента кальция 20 протонов и 20 нейтронов. Какой заряд несет ион кальция с 18 электронами в электронной оболочке? Напишите латинский символ этого иона. ** 2.5. Элемент сурьма (51Sb) состоит из двух изотопов: 12151Sb (масса атома 120,9) - 57,3%, и 12351Sb (масса атома 122,9) - 42,7%. Какова относительная атомная масса (атомный вес) природной сурьмы? ** 2.6 (НГУ). В каком соотношении находятся природные изотопы меди: 63Cu и 65Cu? Относительная атомная масса (атомный вес) природной меди 63,5. Каков состав ядра атома каждого из этих изотопов (сколько в ядрах их атомов протонов и нейтронов)? 2.7. Заполните пропуски в таблице:
Электронное строение атома. В этом и в следующем параграфах рассказывается о моделях электронной оболочки атома. Важно понимать, что речь идет именно о моделях. Реальные атомы, конечно, более сложны и мы пока знаем о них далеко не все. Однако современная теоретическая модель электронного строения атома позволяет успешно объяснить и даже предсказать многие свойства химических элементов, поэтому широко используется в естественных науках. Для начала рассмотрим более подробно "планетарную" модель, которую предложил Н. Бор (рис. 2-3 в).
Рис. 2 3 в. "Планетарная" модель Бора. Как уже рассказывалось в этой главе, датский физик Н. Бор в 1913 году предложил модель атома, в которой электроны-частицы вращаются вокруг ядра атома примерно так же, как планеты обращаются вокруг Солнца. Бор предположил, что электроны в атоме могут устойчиво существовать только на орбитах, удаленных от ядра на строго определенные расстояния. Эти орбиты он назвал стационарными. Вне стационарных орбит электрон существовать не может. Почему это так, Бор в то время объяснить не мог. Но он показал, что такая модель позволяет объяснить многие экспериментальные факты (подробнее об этом рассказывается в параграфе 2.7). Электронные орбиты в модели Бора обозначаются целыми числами 1, 2, 3, … n, начиная от ближайшей к ядру. В дальнейшем мы будем называть такие орбиты уровнями. Для описания электронного строения атома водорода достаточно одних только уровней. Но в более сложных атомах, как выяснилось, уровни состоят из близких по энергии подуровней. Например, 2-й уровень состоит из двух подуровней (2s и 2p). Третий уровень состоит из 3-х подуровней (3s, 3p и 3d), как показано на рис. 2-6. Четвертый уровень (он не поместился на рисунке) состоит из подуровней 4s, 4p, 4d, 4f. В параграфе 2.7 мы расскажем, откуда взялись именно такие названия подуровней и о физических опытах, которые позволили "увидеть" электронные уровни и подуровни в атомах.
Рис. 2-6. Модель Бора для атомов более сложных, чем атом водорода. Рисунок сделан не в масштабе - на самом деле подуровни одного уровня находятся гораздо ближе друг к другу. В электронной оболочке любого атома ровно столько электронов, сколько протонов в его ядре, поэтому атом в целом электронейтрален. Электроны в атоме заселяют ближайшие к ядру уровни и подуровни, потому что в этом случае их энергия меньше, чем если бы они заселяли более удаленные уровни. На каждом уровне и подуровне может помещаться только определенное количество электронов. Подуровни, в свою очередь, состоят из одинаковых по энергии орбиталей (на рис. 2-6 они не показаны). Образно говоря, если электронное облако атома сравнить с городом или улицей, где "живут" все электроны данного атома, то уровень можно сравнить с домом, подуровень - с квартирой, а орбиталь - с комнатой для электронов. Все орбитали какого-нибудь подуровня имеют одинаковую энергию. На s-подуровне всего одна "комната"-орбиталь. На p-подуровне 3 орбитали, на d-подуровне 5, а на f-подуровне - целых 7 орбиталей. В каждой "комнате"-орбитали могут "жить" один или два электрона. Запрещение электронам находиться более чем по двое на одной орбитали называют запретом Паули - по имени ученого, который выяснил эту важную особенность строения атома. Каждый электрон в атоме имеет свой "адрес", который записывается набором четырех чисел, называемых "квантовыми". О квантовых числах будет подробно рассказано в параграфе 2.7. Здесь мы упомянем лишь о главном квантовом числе n (см. рис. 2-6), которое в "адресе" электрона указывает номер уровня, на котором этот электрон существует. В 20-е годы прошлого века на смену модели Бора пришла волновая модель электронной оболочки атома, которую предложил австрийский физик Э. Шредингер. К этому времени было экспериментально установлено, что электрон имеет свойства не только частицы, но и волны. Например, видимый нашими глазами свет представляет собой электромагнитные волны. Ряд свойств таких волн есть и у электрона. Шредингер применил к электрону-волне математические уравнения, описывающие движение волны в трехмерном пространстве. Однако с помощью этих уравнений рассчитывается не траектория движения электрона внутри атома, а вероятность найти электрон-волну в той или иной точке пространства вокруг ядра. Общее у волновой модели Шредингера и планетарной модели Бора в том, что электроны в атоме существуют на определенных уровнях, подуровнях и орбиталях. В остальном эти модели не похожи друг на друга. В волновой модели орбиталь - это пространство около ядра, в котором можно обнаружить заселивший ее электрон с вероятностью 95%. За пределами этого пространства вероятность встретить такой электрон меньше 5%. Полученные с помощью математического расчета такие "области вероятности" нахождения в электронном облаке s- и p-электронов показаны на рис. 2-7.
Рис. 2-7. Примерно такую форму в волновой модели атома имеют "области вероятности" существования электронов: s- и p-орбитали (d-орбитали имеют более сложную форму). ** Почему вообще пришлось вводить такое понятие, как вероятность нахождения электрона в той или иной точке пространства около ядра? Немецкий физик Гейзенберг в 1927 году сформулировал принцип неопределенности, являющийся одним из важнейших физических принципов для описания движения микрочастиц. Этот принцип вытекает из фундаментального отличия микрочастиц от обычных физических тел. В чем же это отличие? В классической механике предполагается, что человек может наблюдать явление, не нарушая его естественного хода. Например, можно наблюдать движение небесных тел в телескоп, и это никак не отразится на их движении. Астроном может произвести измерения и составить точное математическое описание движения объекта. Используя полученные формулы, можно предсказать, куда движется данный объект и где он будет находиться в любой момент времени.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-22; просмотров: 625; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.219.22.169 (0.074 с.) |
 Если взять не свинец, а мягкий серебристый металл натрий, то с таким физическим телом лучше не проводить опытов по измерению выталкивающей силы в воде. На глазах у исследователя, который решится проделать такой эксперимент, погруженный в воду кусочек натрия всплывет и начнет бурно пузыриться, бегая по поверхности воды расплавленной каплей. Затем вокруг того, что осталось от натрия, появятся красные всполохи огня и, наконец, если кусочек натрия был достаточно велик, раздастся оглушительный взрыв. Даже если взрыва не последует, после окончания опыта наш исследователь обнаружит, что натрий исчез! Он превратился в какое-то другое вещество!
Если взять не свинец, а мягкий серебристый металл натрий, то с таким физическим телом лучше не проводить опытов по измерению выталкивающей силы в воде. На глазах у исследователя, который решится проделать такой эксперимент, погруженный в воду кусочек натрия всплывет и начнет бурно пузыриться, бегая по поверхности воды расплавленной каплей. Затем вокруг того, что осталось от натрия, появятся красные всполохи огня и, наконец, если кусочек натрия был достаточно велик, раздастся оглушительный взрыв. Даже если взрыва не последует, после окончания опыта наш исследователь обнаружит, что натрий исчез! Он превратился в какое-то другое вещество! Рис. 1-1. Модели молекул и названия веществ, входящих в состав лесного воздуха: 1 - азот, 2 - кислород, 3 - аргон, 4 - углекислый газ, 5 - вода, 6 - озон, 7 - терпинеол (последние два вещества находятся в воздухе в следовых количествах).
Рис. 1-1. Модели молекул и названия веществ, входящих в состав лесного воздуха: 1 - азот, 2 - кислород, 3 - аргон, 4 - углекислый газ, 5 - вода, 6 - озон, 7 - терпинеол (последние два вещества находятся в воздухе в следовых количествах).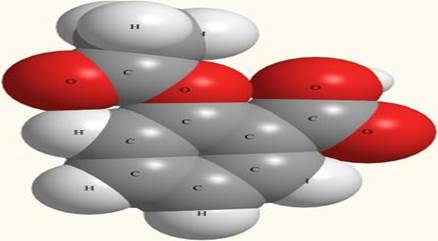 всегда содержат незначительные примеси других веществ. Но этих примесей так мало, что наш организм их просто не замечает. В то же время лекарство с истекшим сроком годности может стать неактивным или даже оказать побочное действие, поскольку количество примесей в нем накопилось выше определенного предела.
всегда содержат незначительные примеси других веществ. Но этих примесей так мало, что наш организм их просто не замечает. В то же время лекарство с истекшим сроком годности может стать неактивным или даже оказать побочное действие, поскольку количество примесей в нем накопилось выше определенного предела.




 аспирина в углекислый газ СО2 и воду Н2О?
аспирина в углекислый газ СО2 и воду Н2О?






