
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Структурные особенности воздухоносных путей и легкихСодержание книги
Поиск на нашем сайте
Физиология дыхания Для нормального протекания окислительных процессов, которые сопровождаются образованием энергоемких молекул АТФ, клетки животных нуждаются в постоянном поступлении кислорода и удалении конечного продукта метаболизма – углекислого газа. Совокупность всех последовательно протекающих процессов, обеспечивающих потребление организмом кислорода и выделение углекислого газа, называется дыханием. Процесс дыхания включает в себя следующие последовательные стадии: 1. Обмен газов между воздухом внешней среды и легких (внешнее дыхание или вентиляция легких); 2. Обмен газов между альвеолярным воздухом и кровью; 3. Транспорт газов кровью ко всем тканям организма; 4. Обмен газов между кровью в капиллярах и клетками тканей; 5. Биологическое окисление в митохондриях клеток (внутреннее дыхание). Изучением первых четырех процессов занимается физиология. Рассмотрим их более детально. Внешнее дыхание Биомеханика дыхания Чтобы обеспечить поглощение кислорода и выделение углекислого газа, свежий воздух должен постоянно доставляться к альвеолам с помощью дыхательного насоса. Понимание механизма его действия требует рассмотрения ряда положений: 1. Дыхательные мышцы. Работа дыхательных мышц обеспечивает поток газов в дыхательной системе. 2. Эластические свойства легких и грудной стенки, определяющие объемы перемещающихся газов и достигаемые при этом объемные скорости потока. 3. Свойства воздухоносных путей, паренхимы легких и грудной стенки, определяющие сопротивление потоку воздуха. 4. Неравномерность вентиляции. 5. Работа дыхания, выполняемая дыхательными мышцами. Дыхательные мышцы При спонтанном дыхании активность инспираторных мышц необходима для преодоления импеданса (реактивного сопротивления) дыхательной системы. Важнейшей мышцей вдоха является диафрагма – куполообразная скелетная мышца, разделяющая грудную и брюшную полости. При спокойном дыхании диафрагма является единственной активной инспираторной мышцей. При необходимости увеличения вентиляции, например, при физической нагрузке, активизируются и другие мышцы: основные инспираторные (наружные межреберные) и вспомогательные (лестничные и грудино-ключично-сосцевидные мышцы). В отличие от вдоха, выдох в нормальных условиях в состоянии покоя происходит пассивно. Эластическая отдача легких и грудной стеки обеспечивает возникновение градиента давления, достаточного для экспираторного потока. При обструкции воздухоносных путей выдох становится активным процессом, требующим работы экспираторных мышц, к которым относят внутренние межреберные и брюшные (наружную и внутреннюю косую, поперечную брюшную и прямую брюшную) мышцы. Кроме того, дополнительными мышцами выдоха являются мышцы голосовой щели и диафрагма. Активность дыхательных мышц обеспечивает вентиляцию путем изменения конфигурации грудной клетки. В частности, во время спокойного вдоха опущение диафрагмы (уплощение ее купола) вызывает расширение нижней части грудной клетки в поперечном и переднезаднем направлениях. В результате этого внутригрудное давление падает, становясь отрицательным, и легкие расправляются воздухом, поступающим в грудную полость под воздействием отрицательного градиента давления. По мере снижения внутригрудного давления растет внутрибрюшное давление, поскольку движение диафрагмы книзу сжимает содержимое брюшной полости. Поток воздуха в легких определяется рядом давлений: · давлением на входе воздухоносных путей. При открытых воздухоносных путях и отсутствии потока воздуха (в конце вдоха и выдоха) это давление равно нулю; · давлением атмосферы на поверхность тела; · плевральным давлением (давление внутри плевральной полости). Величина этого давления зависит от величин и направлений сил, создаваемых эластической паренхимой легких и грудной стенкой; · давлением эластической отдачи, которое создается эластической паренхимой легкого; · альвеолярным давлением (давление внутри альвеол). Это давление отрицательно во время вдоха, положительно во время выдоха и равно нулю, когда поток воздуха отсутствует и голосовая щель открыта. Это давление представляет собой сумму давления эластической отдачи и плеврального давления; · транспульмональным давлением, которое составляет разницу между альвеолярным и плевральным давлениями. Оно необходимо для возникновения воздушного потока и поддержания данного уровня расправления легких; · трансмуральным давлением, представляющее собой разницу между плевральным давлением и давлением на поверхности тела; · трансторакальным давлением, которое является разницей между альвеолярным давлением и давлением на поверхности тела.
Неравномерность вентиляции Легкие довольно разнородны с точки зрения региональных механических свойств воздухоносных путей и паренхимы. Такая гетерогенность является причиной неравномерного распределения воздуха в легких. У здорового человека в положении стоя имеется градиент плеврального давления между верхушкой и основанием легкого (рис). Плевральное давление наибольшее (т.е. наиболее отрицательное) у верхушки легких и наименьшее у снования. Градиент составляет около 0,25 см вод. ст. на каждый сантиметр высоты. Транспульмональное давление больше на верхушке легких, чем у их основания. Это обстоятельство обусловливает большую степень растяжения альвеол на верхушке легкого. Работа дыхания Когда дыхательные мышцы развивают силу, приводящую в движение легкие и грудную стенку, выполняется определенная работа. Эта работа может быть выражена как функция давления и объема: W = W – работа, P – давление, dV – изменение объема легких. Во время вдоха внутриплевральное давление падает, и объем легких становится выше FCR. Работа представляет собой произведение давления и объема (рис.). Из этого следует, что работа, затраченная на наполнение легких, представлена площадью фигуры OABCDO. Она состоит из двух компонентов: один необходим для преодоления эластических сил и представлен площадью OAECDO; другой – для преодоления сопротивления дыхательных путей и представлен площадью ABCEA. Работа выдоха показана площадьюAECFA. Поскольку последняя находится внутри площади OAECDO, эта работа выполняется за счет энергии, накопленной эластической паренхимой легких в процессе растяжения во время вдоха. Вентиляция легких Вентиляция легких – непрерывный регулируемый процесс обновления газового состава воздуха, содержащегося в легких. Вентиляция легких обеспечивается введением в них атмосферного воздуха, богатого кислородом и выведением при выдохе газа, содержащего избыток углекислого газа.
Легочные объемы и емкости Для характеристики вентиляционной функции легких и ее резервов большое значение имеет величина статических и динамических объемов и емкостей легких (емкостью называют сумму двух и более объемов). К статическим объемам относятся величины, которые измеряют после завершения дыхательного маневра без ограничения скорости (времени) его выполнения. К статическим показателям относят следующие объемы и емкости: · Дыхательный объем (ДО) – объем воздуха, поступающий в легкие с каждым дыхательным циклом при спокойном дыхании. В норме ДО составляет около 0,5 л. · Резервный объем вдоха (РОВД) – максимальный объем воздуха, который человек дополнительно может вдохнуть после спокойного вдоха. В норме РОВД составляет около 1,5-1,8 л. · Резервный объем выдоха (РОВЫД) – максимальный объем воздуха, который человек дополнительно может выдохнуть после спокойного выдоха. Данный показатель выше у человека, находящегося в вертикальном положении, чем у человека в горизонтальном положении. В норме РОВЫД составляет около 1,0-1,4 л. · Остаточный объем (ОО) – объем воздуха, который остается в легких после максимального выдоха. С возрастом ОО увеличивается из-за изменения механических свойств легких. В норме ОО составляет около 1,0-1,5 л. · Жизненная емкость легких (ЖЕЛ) – максимальный объем воздуха, который можно выдохнуть после максимально глубокого вдоха. ЖЕЛ = РОВД + ДО + РОВЫД. В норме ЖЕЛ составляет около 3,5-5 л для мужчин и 3-4 л для женщин. · Емкость вдоха (ЕВД) – это сумма РОВД и ДО. В норме составляет около 2,0-2,3 л. · Функциональная остаточная емкость (ФОЕ) – объем воздуха в легких после спокойного выдоха. ФОЕ = РОВЫД + ОО. На величину ФОЕ существенно влияет уровень физической активности человека и положение тела. ФОЕ в горизонтальном положении тела меньше, чем в положении сидя или стоя. В норме ФОЕ составляет около 2,5 л. · Общая емкость легких (ОЕЛ) – объем воздуха, находящийся в легких по завершении максимального вдоха. ОЕЛ = ОО + ЖЕЛ = ФОЕ + ЕВД. В норме ОЕЛ составляет 4-6 л. Динамические величины характеризуют объемную скорость воздушного потока. Их определяют с учетом времени, затраченного на выполнение дыхательного маневра. К динамическим показателям относятся: объем форсированного выдоха за первую секунду (ОФВ1); форсированная жизненная емкость (ФЖЕЛ); пиковая объемная скорость выдоха (ПОСВЫД). Объемы и емкости легких здорового человека определяет ряд факторов: рост, масса тела, возраст, расовая принадлежность, конституциональные особенности человека; эластические свойства легочной ткани и дыхательных путей; сократительные характеристики инспираторных и экспираторных мышц. Для определения легочных объемов и емкостей используются методы спирометрии, спирографии, пневмотахометрии и бодиплетизмографии. Для сопоставимости результатов измерений легочных объемов и емкостей полученные данные должны соотноситься со стандартными условиями: температуры тела 37 °С, атмосферного давления 101 кПа (760 мм рт. ст.), относительной влажности 100%. Эти стандартные условия обозначают аббревиатурой BTPS (от англ. body temperature, pressure,saturated). Альвеолярная вентиляция Газовая смесь, поступившая в легкие при вдохе, распределяется на две неравные по объему и функциональному значению части. Одна из них не принимает участия в газообмене, так как заполняет воздухоносные пути (анатомическое мертвое пространство) и неперфузируемые кровью альвеолы (альвеолярное мертвое пространство). Сумма анатомического и альвеолярного мертвых пространств называется физиологическим мертвым пространством. Объем анатомического мертвого пространства составляет в среднем 2 мл на 1 кг массы тела. Объем анатомического мертвого пространства является частью ДО и участвует в вентиляции дыхательных путей. Отношение величины данного объема к ДО составляет примерно 0,33. Другая часть ДО поступает в респираторный отдел легкого, в состав которого входят альвеолярные протоки, альвеолярные мешочки и собственно альвеолы. В этом отделе легкого воздух участвует в газообмене. Эта часть ДО называется альвеолярным объемом. Именно она обеспечивает вентиляцию альвеолярного пространства. Не весь вдыхаемый воздух участвует в газообмене, поэтому альвеолярная вентиляция всегда меньше легочной вентиляции. Обмен и транспорт газов Транспорт кислорода Кислород может транспортироваться к тканям в двух формах: · в химически связанной с гемоглобином эритроцитов (98,5 %); · в физически растворенной в плазме крови (1,5 %). Клеточная мембрана эритроцита обладает свойствами, позволяющими ему эффективно переносить кислород. Гибкость мембраны способствует прохождению эритроцита через узкие капилляры, а ее прочность обеспечивает устойчивость к действию турбулентного потока в крупных кровеносных сосудах. Наиболее важным внутриклеточным белком (эритроцита) для транспорта кислорода и углекислого газа является гемоглобин (Hb). Каждая молекула гемоглобина состоит из белка глобина и гемма, представляющего собой комплексное соединение железа и порфирина. Глобин представляет собой тетрамер полипептидной цепи. Гемоглобин А (HbA), основной гемоглобин взрослых, содержит две α- и две β-цепи (α2β2). Неосновной гемоглобин взрослых, HbA2, содержит две α- и две δ-цепи (α2δ2). Гем состоит из одного иона железа (Fe2+), встроенного в порфириновое кольцо. Кислород связывается непосредственно с половиной гема, встроенной в спиральную структуру каждой глобиновой полипептидной цепи. Ион железа гема обратимо присоединяет одну молекулу кислорода. С одной молекулой гемоглобина связываются максимально четыре молекулы кислорода. Гемоглобин, полностью загруженный кислородом, называется оксигемоглобином, а гемоглобин без кислорода или присоединивший менее четырех молекул кислорода – деоксигенированным гемоглобином. Уникальное расположение гема и молекул протеина в гемоглобине человека имеет решающее значение для обратимого связывания кислорода. В изолированной ионной форме железосодержащий гем связывает кислород необратима, образуя окисленный гем (Fe3+), который не освобождает кислород на тканевом уровне. В интактной молекуле гемоглобина связывание кислорода с Fe2+-гемом вызывает значительные конформационные изменения как третичной, так и четвертичной структуры глобина, предотвращающие образование Fe3+ ионов. В результате происходит обратимое связывание кислорода гемоглобином, что имеет важное значение для высвобождения кислорода, его поглощения и утилизации в периферических тканях. Оксигемоглобин является основной формой транспорта кислорода. Каждый грамм гемоглобина может максимально связать 1,34 мл кислорода. Соответственно, кислородная емкость крови находится в прямой зависимости от содержания гемоглобина: у здоровых людей с содержанием гемоглобина 150 г/л кислородная емкость крови составляет 201 мл кислорода/л крови. Ключевым фактором, определяющим количество кислорода, связанного с гемоглобином, является насыщение артериальной крови кислородом (SaO2). Оно выражает отношение между количеством кислорода, связанного с гемоглобином, и кислородной емкостью крови: SaO2 = (О2, связанный с Hb)·100 % / (кислородная емкость крови). В соответствии с кривой диссоциации оксигемоглобина, которая соотносит SaO2 с РаО2*, SaO2 равно примерно 97 %, когда РаО2 – 100 мм рт.ст. (рис.). В смешанной венозной крови, где РО2 = 40 мм рт.ст., SaO2 достигает 75%. Кровь содержит незначительное количество кислорода, не связанного с гемоглобином, а растворенного в плазме. Растворимость кислорода в крови очень низка: только 0,0031 мл кислорода растворяется в 0,1 л крови на 1 мм рт.ст. Таким образом, при РаО2, равном 100 мм рт.ст., в 100 мл артериальной крови содержится только 0,31 мл растворенного кислорода. Правило Фика Существует тонкое сопряжение между артериальным содержанием кислорода, сердечным выбросом, тканевой утилизацией кислорода и содержанием кислорода в смешанной венозной крови. Некоторые заболевания (например, сепсис) сопровождаются нарушением сопряжения между утилизацией кислорода периферическими тканями и доставкой кислорода. Утилизация снижается, когда доставка падает ниже некоторого порога. Отношение между этими переменными выражается правилом Фика, которое устанавливает, что потребление кислорода (объем в 1 мин.) является произведением минутного сердечного выброса и артерио-венозной разницы кислорода: VO2 = Q · (CаО2 - CvО2), где VO2 – потребление кислорода в минуту, CаО2 – содержание кислорода в артериальной крови, CvО2 – содержание кислорода в смешанной венозной крови, Q – минутный сердечный выброс. Анализ уравнения Фика показывает, что возросшая кислородная потребность при фиксированном минутном сердечном выбросе вызывает увеличение артерио-венозной разницы кислорода. Напротив, снижение метаболических требований при фиксированном минутном сердечном выбросе влечет за собой уменьшение этой разницы. Отсюда содержание кислорода в смешанной венозной крови и, следовательно, ее насыщение кислородам и РО2 зависят от экстракции кислорода тканями и доставки к ним кислорода. Теоретически максимумом потребления кислорода (VO2) является доставка кислорода (DO2). Однако на практике ткани не могут использовать весь доставленный кислород, и среднее VO2 (как упоминалось выше) составляет около 250 мл/мин. Таким образом, в стабильном состоянии доставка кислорода примерно в 4 раза превышает его потребление. Примерно 25 % кислорода экстрагируется из артериальной крови тканями, и остальной кислород возвращается к сердцу в составе смешанной венозной крови. Транспорт углекислого газа Вдыхаемый воздух содержит незначительное количество СО2. Следовательно, практически весь углекислый газ крови является продуктом клеточного метаболизма. Углекислый газ легко диффундирует. Его способность к диффузии в 20 раз превышает таковую способность кислорода. По мере образования в процессе клеточного метаболизма СО2 диффундирует в капилляры и транспортируется к легким в трех основных формах: 1. в растворенном виде (5 %); 2. в виде аниона бикарбоната (90 %); 3. в виде карбаминовых соединений (5 %). Углекислый газ очень хорошо растворяется в плазме. Количество растворенного в плазме СО2 определяется произведением его парциального давления и коэффициента растворимости (a = 0,3 мл/(л крови · мм рт. ст.)). Таким образом, около 5 % общей двуокиси углерода в артериальной крови находится в форме растворенного газа. Преобладающей формой транспорта СО2 является анион бикарбоната. Этот анион является продуктом реакции СО2 с водой с образованием Н2СО3 и ее диссоциации на водород и ион бикарбоната: СО2 + Н2О ↔ Н2СО3 ↔ Н+ + НСО3- Реакция между СО2 и Н2О протекает медленно в плазме и очень быстро в эритроцитах, где присутствует внутриклеточный фермент карбоангидраза. Она облегчает реакцию между СО2 и Н2О с образованием Н2СО3; вторая фаза реакции протекает быстро без катализатора. По мере накопления НСО3- внутри эритроцита аниона диффундирует через клеточную мембрану в плазму. Мембрана эритроцита относительно непроницаема для Н+, как и вообще для катионов, поэтому ионы водорода остаются внутри клетки. Электрическая нейтральность клетки в процессе диффузии НСО3- в плазму обеспечивается притоком ионов хлора из плазмы в эритроцит, что формирует так называемый хлоридный сдвиг (рис). Часть ионов Н+, остающихся в эритроцитах, забуферивается, соединяясь с гемоглобином. В периферических тканях, где концентрация СО2 высока и значительные количества Н+ накапливаются эритроцитами, связывание Н+ облегчается деоксигенацией гемоглобина. Восстановленный гемоглобин лучше связывается с протонами, чем оксигенированный. Таким образом, деоксигенация артериальной крови в периферических тканях способствует связыванию Н+ посредством образования восстановленного гемоглобина. Это увеличение связывания СО2 с гемоглобином известно как эффект Холдейна. Третьей формой транспорта СО2 являются карбаминовые соединения, образованные в реакции СО2 с концевыми аминогруппами белков крови. Основным белком крови, связывающим СО2, является гемоглобин (особенно глобиновая часть молекулы). Этот процесс описывается следующей реакцией: Hb-NH2 + СО2 ↔ Hb-NH·COOH ↔ Hb-NHCOO- + Н+ Реакция СО2 с аминогруппами протекает быстро. Как и в случае более легкого СО2 связывания с восстановленным гемоглобином, образование карбаминовых соединений легче протекает с деоксигенированными формами гемоглобина. Карбаминовые соединения составляют около 5 % общего количества СО2, транспортируемого артериальной кровью. С точки зрения сравнительного вклада каждой из этих форм в артерио-венозную разницу по концентрации СО2, около 60 % принадлежит бикарбонатному аниону, карбаминовым соединениям – около 30 % и растворенной форме СО2 – около 10 %. Кривая диссоциации СО2-гемоглобин Присутствие в крови всех трех форм СО2 создает равновесие между растворенным СО2 (РСО2) и СО2, химически связанным с другими веществами. В отличие от S-образной кривой диссоциации оксигемоглобина, кривая диссоциации СО2-гемоглобина более линейна. Особое физиологическое значение имеет то, что общее содержание СО2 при любом уровне РСО2 зависит от степени оксигенации гемоглобина (эффект Холдейна). По мере того как в периферических тканях происходит отщепление О2 от гемоглобина, он присоединяет СО2 все более активно. Отсюда, общее содержание СО2 в крови больше при любом уровне тканевого РСО2. В этом можно убедиться, сравнивая кривы диссоциации СО2 для полностью деоксигенированной, полностью оксигенированной и частично оксигенированной крови с РО2, эквивалентным смешанной венозной крови (рис). В оксигенированной артериальной крови с РаСО2 в 40 мм рт. ст. содержание СО2 составляет около 480 мл/л. Так как О2 высвобождается в периферических тканях, кровь, прошедшая капилляры, насыщена кислородом на 75 %. При РСО2 около 46 мм рт. ст. содержание СО2 в смешанной венозной крови (т.е. крови, входящей в правый желудочек и представляющей смесь венозной крови от всех тканей тела) составляет приблизительно 530 мл/л. Повышенное сродство деоксигенированной крови с СО2 объясняет добавочные 20-30 мл СО2 /л сверх того, что могло бы быть поглощено без изменения насыщения оксигемоглобина.
О2-СО2-диаграмма Соотношения между связыванием и транспортом О2 и СО2 обобщает О2-СО2-диаграмма, представляющая собой график содержания О2 и СО2 в крови в зависимости от их парциальных давлений (рис). В качестве примера рассмотрим воздействие изменений в уровне РаСО2 на содержание О2 при 40 мм рт. ст. При выраженной гипокапнии (РаСО2 10 мм рт. ст.) и при РаО2 в 40 мм рт. ст. содержание в крови составляет около 180 мл/л. При РаСО2 40 мм рт. ст. та же самая величина РО2 обеспечивает содержание О2 только 150 мл/л (эффект Бора). теперь рассмотрим воздействие изменений в уровне РаО2 на содержание в крови СО2 при различных уровнях РаСО2. При РаСО2 40 мм рт. ст. и РаО2 80 мм рт. ст. (как в артериальной крови) содержание СО2 составит 500 мл/л. Когда же РаО2 равно 40 мм рт.ст., а РаСО2 – 46 мм рт.ст. (как в смешанной венозной крови), то содержание приблизится СО2 к 540 мл/л (эффект Холдейна). Регуляция дыхания Чтобы потребление кислорода и продукция углекислого газа соответствовали разнообразным требованиям организма, связанным с повседневной активностью, а величины РаО2 и РаСО2 сохранялись в узких физиологических пределах, необходимы приспособительные изменения минутной вентиляции. Для достижения этого гомеостатического эффекта существует сложная система регуляции дыхания. Подобно многим физиологическим системам контроля, система управления дыханием организована как контур отрицательной обратной связи (рис). Вдыхаемый газ поступает по воздухоносным путям к альвеолам, где он участвует в обмене газов на уровне альвеолярно-капиллярной мембраны. Рецепторы откликаются на информацию о механических явлениях (например, о наполнении легких) и гуморальных параметрах (например, РаО2 и РаСО2). Эта информация интегрируется в дыхательном центре продолговатого мозга, который модулирует нервный импульс к мотонейронам, иннервирующим дыхательные мышцы. Координированное возбуждение респираторных мотонейронов приводит к синхронному сокращению дыхательных мышц, создающему воздушный поток. Когда химические возмущения, подобные гипоксии или гиперкапнии, распознаются хеморецепторами, их сигналы в дыхательном центре реализуются повышенной нервной импульсацией к респираторным мотонейронам, что вызывает повышение минутной вентиляции. Артериальная гипокапния, напротив, вызывает уменьшение вентиляции. Центральные хеморецепторы Из нескольких хемосенсоров, контролирующих обмен газов, ответственность за обнаружение отклонений в гомеостазе углекислого газа лежит в основном на центральных хеморецепторах. Несмотря на то, что нейроны, частота импульсации и возбудимость которых модулируются отклонениями РСО2, обнаружены во многих областях центральной нервной системы, клетки, способные передавать информацию в дыхательный центр, расположены в продолговатом мозге. Центральные хеморецепторы располагаются вблизи вентральной поверхности продолговатого мозга, где корешки подъязычного нерва выходят из ствола мозга. Хотя их точное расположение, нервные контакты и нейрохимия изучены недостаточно, эти хемочувствительные клетки, вероятно, отличаются от соседних нейронов, которые обеспечивают дыхательный ритмогенез и составляют основу дыхательного цента. Хемочувствительные клетки реагируют на отклонения в концентрации ионов Н+ ([Н+]) и РСО2 во внеклеточной жидкости внутримозгового интерстициального пространства. Последние исследования с применением рН-чувствительных электродов показали, что увеличение минутной вентиляции тесно связано с повышением [Н+] именно во внеклеточной, а не в спинномозговой жидкости. Когда местная [Н+] увеличивается, что эквивалентно падению рН, дыхательный центр увеличивает вентиляцию по сигналу от центральных хеморецепторов. Однако отклонения во внеклеточной [Н+] – не единственный стимул для центральных хеморецепторов. Рост вентиляции в ответ на изолированное повышение внеклеточной [Н+] в отсутствие изменений РСО2 (изокапнический метаболический ацидоз) происходит медленнее. Кроме того, вентиляторная реакция меньше по величине, чем наблюдаемая при изолированном повышении РСО2 (дыхательный ацидоз). Одной из причин высокой скорости вентиляторного ответа на гиперкапнию является легкость диффузии углекислого газа через гематоэнцефалический барьер. Однако этот барьер относительно непроницаем для ионов Н+ и НСО3-. Более того, повышенное РСО2 вызывает расширение сосудов, особенно церебральных, способствуя тем самым усилению диффузии углекислого газа через гематоэнцефалический барьер. Диффузия углекислого газа представляет собой еще один важный механизм усиления связи отклонений в кислотно-основном состоянии организма с центральными хеморецепторами. При дыхательном ацидозе повышенное РаСО2 вызывает увеличение диффузии углекислого газа через гематоэнцефалический барьер. Повышенное содержание углекислого газа приводит к росту [Н+] около центральных хеморецепторов, которые обнаруживают это изменение и сигнализируют в дыхательный центр о повышении вентиляции, компенсирующем дыхательный ацидоз. Поскольку вентиляторный ответ на увеличение [Н+], обусловленное повышением РСО2, больше, чес ответ на идентичное отклонение [Н+] в отсутствии роста РСО2, то РСО2 и [Н+] должны представлять независимые стимулы для центральных хеморецепторов. Молекулярные механизмы рецепции остаются неизвестными: либо [Н+] и РСО2 образуют различные стимулы для единого сенсорного механизма, либо специфические стимулы для различных сенсорных механизмов. Поскольку закисление мозговой интерстициальной жидкости является важным этапом центральной хеморецепции, необходима выделить главные факторы, влияющие на этот процесс: · В отличие от крови, церебральная интерстициальная жидкость содержит очень мало белка. Без белков с их буферной способностью сдвиги рН во внутримозговой внеклеточной жидкости происходят быстрее, чем в крови. · Компенсаторный вентиляторный ответ на хроническое закисление мозговой внеклеточной жидкости наступает быстрее, чем при закислении крови. · Перемещение НСО3- из крови через гематоэнцефалический барьер в мозговую интерстициальную жидкость происходит в течение 24-48 ч. Задержка НСО3- в почках в ответ на закисление плазмы занимает 48-72 ч. Каротидные тельца В то время как мониторинг РСО2 происходит в стволе головного мозга, отслеживание РО2 является функцией исключительно каротидных телец (рис). Они расположены у бифуркации общих сонных артерий на внутреннюю и наружную. Несмотря на свой миниатюрный размер, каротидные тельца получают огромный кровоток – от 1,4 до 2,0 л/мин на 100 г ткани, что соответствует особой роли этого органа, как главного датчика, чувствительного к колебаниям кислорода в артериальной крови. Каротидные тельца состоят из нескольких типов клеток: 1. Главными из них являются гломусные клетки. Они содержат несколько медиаторов, включая большое количество дофамина и других катехоламинов, а также серотонин, ацетилхолин и некоторые нейропептиды. Гломусные клетки являются настоящими хемочувствительными клетками. 2. Группы гломусных клеток окружены поддерживающими клетками. На одну поддерживающую клетку приходится от трех до шести гломусных. Физиологическая роль поддерживающих клеток неизвестна. Считается, что эти клетки ультраструктурно и функционально связаны с глией центральной нервной системы. Группы гломусных клеток и окружающие их поддерживающие клетки снабжены богатой сетью капилляров, которые обеспечивают оптимальные условия для их хемосенсорной функции относительно кислорода. Гломусные клетки образуют синапсы с афферентными волокнами нерва каротидного синуса. Чувствительная ветвь языкоглоточного нерва и нерв каротидного синуса иннервируют каротидное тельце и барорецепторы каротидного синуса. Афферентные волокна языкоглоточного нерва берут свое начало в чувствительных нейронах каменистого ганглия. В ответ на артериальную гипоксемию гломусные клетки высвобождают дофамин пропорционально степени снижения РаО2. Высвобождение дофамина модулируется отклонениями рН, вызванными метаболическим или дыхательным ацидозом, и приводит к значительному повышению тонической активности афферентных чувствительных волокон каротидных телец. Эти афферентные волокна проявляют некоторую степень тонической активности в условиях нормоксии и даже гипероксии. Они «замолкают» только во время выраженной артериальной гипероксии и гипокапнии. Когда РаО2 падает ниже 60 мм рт. ст., активность афферентных нервов каротидного тельца возрастает экспоненциально. Поскольку частота импульсации единичного афферентного волокна каротидного тельца составляет от 5 до 25 импульсов в секунду, каротидное тельце быстро отвечает на изменения РаО2, происходящие в течение одного дыхательного цикла. Важнейшее значение каротидного тельца в регуляции оксигенации подтверждается тем, что после его двустороннего удаления или денервации гипоксический вентиляторный ответ у человека полностью исчезает. У некоторых других биологических видов подобные кислород-чувсвительные органы присутствуют также в дуге аорты. Этим аортальным тельцам свойственна реактивность функционально подобная реактивности каротидных телец. В отличие от решающей роли каротидных телец в регуляции оксигенации, их участие в формировании вентиляторного ответа на изменение РаСО2 сравнительно невелико. Несмотря на то, что частота импульсации афферентных нервов каротидного тельца четко варьирует в соответствии с изменением РаСО2, дополнительная афферентная активность в ответ на метаболические или дыхательные стимулы не влияет на степень повышения минутной вентиляции, вызываемой центральными хеморецепторами. Более того, денервация каротидного тельца снижает вентиляторный ответ на повышение РаСО2 не менее чем на 20 %. Это служит дополнительным доказательством того, что каротидное тельце играет небольшую роль в вентиляторной реакции на ацидоз. Нервная регуляция дыхания Дыхательный центр получает также проприоцептивные и болевые импульсы от легких. Эта информация передается легочными афферентными волокнами блуждающего нерва, чьи клеточные тела расположены в узловатом ганглии. Чувствительные окончания этих нервов локализованы в различных местах легких, в то время как центральные окончания – в синапсах ядра солитарного тракта в среднем мозге. Основные типы легочных вагусных афферентов включают: · медленно адаптирующиеся рецепторы растяжения; · быстро адаптирующиеся рецепторы растяжения; · С-волокна. С-волокна третьей главной группой легочных механорецепторов являются С-волокна – тонкие немиелинизированные волокна, представляющие собой медленно проводящие вагусные афференты. С-волокна оканчиваются в паренхиме легких, воздухоносных путей и кровеносных сосудах. Следовательно, они доступны для медиаторов, присутствующих в крови капилляров или бронхиальных артерий. Существуют два типа С-волокон: легочные и бронхиальные. Легочные С-волокна оканчиваются в паренхиме легких; и в эксперименте стимулируются веществами, вводимыми в легочную артерию. Бронхиальные С-волокна оканчиваются в крупных воздухоносных путях и кровеносных сосудах; в эксперименте стимулируются веществами, вводимыми в бронхиальную артерию. С-волокна могут активироваться экзогенными химическими агентами или эндогенными субстанциями (например, брадикинином). Активность С-волокон не зависит от фазы дыхания; им принадлежит небольшая роль при нормальных вдохе и выдохе. Эти волокна стимулируются вдыханием раздражающих агентов (токсичные газы или частицы), а также механическим раздражением воздухоносных путей. В общем, активация С-волокон приводит к частому поверхностному дыханию, которое ограничивает рассеивание потенциально вредных агентов по трахеобронхиальному дереву. С-волокна могут играть важную роль в передаче ощущения диспноэ в различных клинических ситуациях, таких как отек легких, пневмония или вдыхание токсических веществ. Их стимуляция вызывает брадикардию и секрецию слизи. Последняя может быть важной в патогенезе обструктивной болезни легких. В состав С-волокон входят J-рецепторы, которые оканчиваются в паренхиме легких, прилегающей к капиллярам, и стимулируются развитием интерстициального отека. Активация J-рецепторов вызывает закрытие гортани и апноэ, за которым следует частое поверхностное дыхание. J-рецепторы также могут иметь важное значение в передаче ощущения диспноэ не только при отеке легких, но и при пневмонии и легочной эмболии. Спирометрия Цель работы. Ознакомиться с методикой регистрации объемов воздуха, поступающего в легкие. Для работы необходимы: водяной или сухой спирометр, спирт, вата, прокипяченные стеклянные и пластмассовые наконечники. Количество воздуха, проходящего через легкие при вдохе, зависит от объема грудной клетки, подвижности диафрагмы и ребер, состояния дыхательных мышц и самой легочной ткани (ее эластичности, степени кровенаполнения и т.д.). Количество воздуха, проходящего через легкие, измеряется спирометором. При спокойном дыхании во время вдоха в легкие поступает 500 мл воздуха. Этот объем воздуха называется дыхательным. Если после обычного вдоха произвести максимальный вдох, то в легкие войдет дополнительный воздух. Его объем составляет 1500-2000 мл. Максимальное количество воздуха, выдыхаемого после спокойного выдоха, называется резервным воздухом. Его объем равен 1500-2000 мл. Количество воздуха, которое человек выдыхает при максимальном выдохе после максимального вдоха, называе
|
||||
|
Последнее изменение этой страницы: 2017-02-19; просмотров: 319; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.140.188.195 (0.014 с.) |

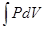 , где:
, где:


