
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Лекция 5. Химические реагенты.Содержание книги
Поиск на нашем сайте Существует 2 вида химических реагентов: 1. Неорганические (электролиты) – при попадании в воду диссоциируются с образованием катионов и анионов; 2. Органические – реагенты, которые получаются из веществ органического происхождения или путем синтеза на основе более низкомолекулярных органических соединений. Электролиты. Действие электролитов связано с их воздействием на двойной электрический слой и гидратную оболочку, находящиеся на гидратированной глинистой частице. При низких концентрациях электролита (до порога коагуляции) происходит увеличение заряда частицы за счет попадания в диффузный и адсорбционный слои катионов и анионов диссоциировавшего электролита. Это приводит к увеличению заряда, силы взаимодействия ослабевают, меняются структурные свойства раствора, поэтому при низких концентрациях электролит способствует усилению структурообразования. При увеличении концентрации электролита (выше порога коагуляции) происходит компенсация зарядов на поверхности глинистой частицы, диффузный слой сжимается, что приводит к коагуляции. При высокой концентрации электролита происходит сжатие диффузного и адсорбционного слоев, что вызывает коагуляцию глинистых частиц.
коагуляция
К выбору концентрации электролита нужно подходить осторожно. В каждом случае рациональная концентрация электролита подбирается экспериментально. Основные представители электролитов: KOH – гидроксид калия (едкий калий); NaOH – гидроксид натрия (едкий натр); Ca(OH)2 – гидроксид кальция; Na2CO3 – кальцинированная сода (бикарбонат кальция); NaHCO3 – гидрокарбонат натрия; BaCO3 – карбонат бария; Na2O∙nSiO2 – силикат натрия (жидкое стекло); NaCl – хлорид натрия; CaCl2 – хлористый кальций; K2CO 3 – бикарбонат калия (поташ). Na2Cr2O7 хромпик (двухромовокислый натрий, калий) K2Cr2O7 ярко-оранжевый цвет, пары являются токсичными. Действие электролитов на изменение параметров глинистого раствора, отражено на изменении показателя фильтрации (Ф30), условной вязкости (Т) и статического напряжения сдвига (θ) при увеличении концентрации в нем кальцинированной соды (Na2CO3): Ф30 Т Ф30 Q
Т
Q
2-5 13-15 Na2CO3, % 10 20 30 Рис.48. влияние концентрации Na2CO3 на параметры глинистого раствора. 1 область при концентрации Na2CO3 до 2-3% - область стабилизации Ф30↓; Т↓; θ↓ - все параметры снижаются. Это связано с тем, что диссоциируемые катионы Na+ и анионы CO3-2 насыщают поверхность глинистой частицы, заряд частицы возрастает, а силы взаимодействия ослабевают. Раствор разжижается, снижаются структурные свойства, показатель фильтрации уменьшается. 2 область при концентрации Na2CO3 до 13¸15% – область структурообразования, в которой Ф30↓; Т↑; θ↑, т.е. снижается показатель фильтрации, а условная вязкость и статическое напряжение сдвига увеличиваются. Усиление структурных свойств происходит за счет того, что попадая в диффузные слои Na+ и СО3-2 приводят к компенсации заряда глинистых частиц. Силы взаимодействия возрастают, что ведет к возрастанию структурных свойств. В этом случае глинистые частицы соединяются между собой краевыми частями и гранями зарядов. 3 область при концентрации Na2CO3 более > 15% - Ф30↑; Т↓; θ↓, т.е. возрастает показатель фильтрации, а условная вязкость и статическое напряжение сдвига увеличиваются. В этой области концентрация электролита увеличивается, а заряд глинистой частицы приближается к нулю. Выпадают из раствора агрегаты глинистых частичек. Падают структурные свойства раствора. Глинистые частички соединяются гранями и ребрами. К выбору оптимальной концентрации электролита необходимо подходить осторожно, так как в случае приближения ее к порогу коагуляции ухудшаются свойства глинистого раствора. Характеристика наиболее часто применяемых реагентов-электролитов приводится ниже: 1. Na2CO3 – кальцинированная сода (получается методом кальцинирования). Порошок белого цвета, хорошо растворяется в воде. Растворимость – до 320 кг/м3. Назначение: - улучшение качества глин местного производства; - повышения выхода раствора из глин смешанного состава (Na+ + Ca+2); - связывание катионов двухвалентных металлов; - повышения рН растворов. Са+2 – глина – наиболее часто присутстыует в местных глинах. Для их модернизации с целью улучшения качества глинистого раствора в состав его вводят кальцинированную соду:
Са-глина + Na2CO3 ® CaCO3 + Na-глина Na+ Ca+
Na+
Ca+ При этом Са+2 катионы связываются оксидом Кальциевая глина невысокого качества, так как имеет неразвитую гидратную оболочку, катионный обмен идет неэффективно, гидратация плохая. Поэтому образующаяся Na+-глина дает более высокое качество растворов. Натриевая глина более эффективно набухает, хорошо гидратирует. Предпочтительными являются натриевые глины. При перебуривании гипсов и ангидритов выделяющиеся из их состава катионы Са+2 вызывают коагуляцию глинистых растворов: Гипс – CaSo4∙2H2O (природный гипс, камень), ангидрит – CaSO4 При введении в состав глинистого раствора соды Na2CO3 катионы Са+2 связываются и вызывают коагуляцию глинистых частиц в растворе: CaSO4 + Na2CO3 → CaCO3 + Na2SO4
Хорошо растворимое вещество Слабо растворимое вещество При перебуривании цементов содирование тоже позволяет устранить коагуляцию частиц глины:
В случае притока минерализованных вод сода связывает жесткие катионы Са+2, устраняя коагуляцию глинистого раствора:
2. NaOH – гидроксид натрия (едкий натр). Растворимость 1040 кг/м3. Хорошо растворим в воде. Гигроскопичен. Хранится как 40%-60% водный раствор (синеватого цвета). Назначение: - повышение качества глин; - связывание сероводорода; - повышение рН среды. При диссоциации в составе глинистого раствора щелочь повышает его качество:
родственный анион для гидратной оболочки глинистых частиц В случае сероводородной агрессии добавки щелочи нейтрализуют сероводород.
При добавлении в раствор гидроксида натрия повышается рН за счет увеличения содержания катионов водорода. 3. СаCl2 - растворимость до 726 кг/м3 Назначение: - регулирование содержания Ca+2 в фильтрате бурового раствора; - усиление ингибирующего и крепящего действия. Применяются для приготовления хлоркальциевых и ингибированных растворов. 4. NaCl – растворимость до 300 кг/м3 Назначение: - структурообразователь для растворов, приготовленных из глин невысокого качества и также растворов с низким содержанием твердой фазы; - получение солевых растворов (применяются при бурении в многолетне мерзлых породах, при бурение глинистых породах, для получения минерализованных растворов). 5. Na2O ∙ nSiO2 – жидкое стекло (от светло-желтого до темно-бурого цвета) представляет собой водный раствор Назначение: - структурообразование в глинистых растворах при концентрации менее 5%; - разжижижение при концентрации до 2%-3%; - силикатизация глин – закрепление стенок скважин, сложенных глиносодержащими породами. Ca+2
Ca+2 + Na2O ∙ nSiO2
Ca+2 + SiO2-2 = CaSO2 цементирующее вещество
При вводе в состав глинистого раствора жидкого стекла можно модифицировать глины связывая катион Ca+2 анионом SiO2-2. 6. Na2Cr2O – хромпик (ярко-оранжевого цвета). Растворимость до 750 кг/м3. Назначение: - усиление ингибирующего действия при его концентрации в растворе до 3%-5%; - повышение термостойкости при концентрации 5%-7% растворов образованных КМЦ.
|
||
|
Последнее изменение этой страницы: 2017-02-19; просмотров: 1127; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.220 (0.006 с.) |

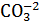 и образуется Na+-глина
и образуется Na+-глина безводный.
безводный.

 → улучшет гидратацию
→ улучшет гидратацию



