
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Лекция 1. Общие сведения о промывке скважин.Содержание книги
Поиск на нашем сайте
Лекция 1. Общие сведения о промывке скважин. Очистной агент – это та среда (жидкая, газообразная или их смесь – газожидкостная смесь), которая подаётся на забой в процессе бурения (разрушения горной породы), активно участвует в его разрушении и выполняет ряд технологических функций. Технологические функции очистного агента: 1. Охлаждение породоразрушающего инструмента; 2. Удаление частиц шлама с забоя; 3. Закрепление стенок скважины за счёт образования корки или физико-химических процессов; 4. Смазывание породоразрушающего инструмента; 5. И другие. Много проблем возникает при бурении сверхглубоких скважин. В СССР сверхглубокая скважина СГ-3 глубиной около 12100 м была пробурена на Кольском полуострове. Специально для бурения этой скважины была разработана буровая установка УралМАШ-15000. Проблемы, возникающие при бурении сверхглубоких скважин: 1. Высокие температуры на забое, достигающие 2500С÷3000С; 2. Агрессия солей растворимых пород и подземных вод; 3. Обрушения горных пород стенок скважин; 4. Ограниченное действие химических реагентов. Химические реагенты – вещества, регулирующие свойства промывочных жидкостей и тампонажных смесей. Промывка скважины – это комплекс технологических процессов, связанных с приготовлением очистного агента, контролем его качества, регулированием свойств и выбором параметров применительно к конкретным горно-геологическим условиям, очисткой его от частиц шлама, пополнением в процессе углубки скважины и закачиванием очистного агента в скважину для выполнения основных технологических функций. Промывка скважин – один из основных технологических процессов. Эффективность процесса бурения определяется видом, составом и свойствами выбранного очистного агента. Так как промывка – один из основных технологических процессов при бурении скважин, то схема промывки скважин даёт название способу бурения.
Классификация способов бурения в зависимости от схемы Промывки скважины. 1. Бурение с прямой промывкой; 2. а) Бурение с обратной промывкой; б) Обратной всасывающей промывкой; 3. Бурение с комбинированной промывкой; 4. Бурение с гидро- (пневмо-, пено-) транспортом керна. 1. Бурение с прямой промывкой Поток очистного агента нагнетается внутрь колонны бурильных труб.
1 – буровой станок; 2 – вращатель; 3 – ведущая труба (труба-квадрат); 4 – буровой сальник; 5 – колонна бурильных труб; 6 – колонковый набор; 7 – скважина; 8 – направляющая обсадная колонна; 9 – желоб; 10 – промежуточная ёмкость (отстойник); 11–приёмная ёмкость; 12–буровой насос; 13 – всасывающий рукав; 14 – храпок; 15 – подающая линия; 16 – вертикальная подающая линия; 17 – нагнетательный шланг высокого давления.
Вид АВид Б
Рг ст
Вид ВВид Г
Vт
Корка может быть глинистой, полимерной, полимерно-глинистой. По желобам раствор перемещается со скоростью υ = 1,8 ÷ 2,0 см/с. Расстояние между перегородками в жёлобе 1 ÷ 1,5 м. Жёлоб имеет уклон 10 ÷ 1,50 на 1 м. Содержание шлама (абразивных частиц) во вновь закачиваемой жидкости не должно превышать 2%. a)
2. а) С обратной нагнетательной промывкой Применяется при бурении в трещиноватых горных породах с целью увеличения выхода керна для повышения качества геологического опробования. В этом случае поток промывочной жидкости нагнетается не внутрь колонны бурильных труб, а в скважину.
Промывочная жидкость должна сохранять свойства и состав кернового материала. б) С обратной всасывающей промывкой Применяется при бурении в рыхлых песчаных отложениях, в основном в гидрогеологических скважинах и в том случае, когда статический уровень водоносных горизонтов не доходит до поверхности на 3-4 м, т.е. такой способ применяется в мощных отложениях песков, в обводненных песках.
3. Бурение с комбинированной промывкой
Такой способ бурения применяется в случае необходимости повышения выхода керна чаще при бурении менее глубоких скважин, чем при использовании способа бурения с обратной нагнетательной промывкой, которая применяется чаще при геологоразведочном бурении.
До пакера производится прямая промывка, под пакером производится обратная промывка скважины.
Для промывки скважин комбинированным способом могут применяться пакерные снаряды, эжекторные снаряды, двойные колонковые наборы с обратной циркуляцией (ДКН-О). 4. Бурение с гидро- (пневмо-, пено-) транспортом керна КГК-100÷600 (комплексы с гидротранспортом керна) Такой способ бурения применяется для бурения структурно-поисковых скважин на все виды полезных ископаемых, а также для поискового гидрогеологического бурения с целью поиска и оценки запасов подземных вод. Данный вид бурения применяется в рыхлых песчано-глинистых отложениях. Для реализации этого способа бурения разработана буровая установка: УРБ-2А-2.
Требования к составу промывочной жидкости 1. Основные требования. а) минимальная стоимость; б) соответствие свойств условиям бурения.
2. Дополнительные требования а) экологическая чистота всех компонентов, входящих в состав буровых растворов; б) недефицитность; в) доступность сырьевой базы; г) совместимость материалов; д) технологичность.
Свойства дисперсных систем 1. Устойчивость – это способность дисперсной системы сохранять свои свойства и пространственное расположение частиц дисперсной фазы в объеме дисперсионной среды. Факторы, обусловливающие устойчивость системы: а) Броуновское тепловое движение, которое обусловливает беспорядочное тепловое перемащение молекул дисперсионной среды и их соударение с частицами дисперсной фазы. б) диффузия – самопроизвольное выравнивание концентрации молекул, ионов дисперсной фазы. Разновидности устойчивости: а) Седиментационная – устойчивость против оседания частиц дисперсной фазы. Наиболее седиментационно устойчивыми системами являются истинные растворы. Наименее седиментационно устойчивыми являются грубодисперсные растворы – обрабатываются химическими реагентами. частицы шлама, распределяющиеся равномерно по объёму дисперсионной среды
б) Агрегативная – устойчивость против образования агрегатов частиц, сцепления частиц за счет потери этими частицами определенных свойств.
агрегатирование
Факторы, обусловливающие агрегативную устойчивость дисперсных систем: 1) эластичность, упругость слоев, образующихся вокруг глинистых частиц;
Суммарная кривая сил отталкивания и притяжения
Золь – это подвижная система (текучая), которая получается при значительном увеличении содержания в ней жидкой дисперсионной среды. Гель – малоподвижная система (твердообразная система).
- взаимодействие частичек слабое
- каркас
Переход золя в гель называется гелеобразованием. Энергетический барьер препятствует агрегатированию твёрдой фазы в составе дисперсионной среды. 2. Поверхностные явления Возникают при наличии реальной границы раздела, отделяющей одну часть системы от другой различных по составу и свойствам. На границе раздела существует избыточная поверхностная энергия, которая характеризуется определенной интенсивностью этой избыточной энергии, приходящейся на единицу границы площади - границы раздела.
газ
жидкость
Равнодействующая будет направлена внутрь собственной фазы. Модель к образованию поверхностной энергии изображается в виде системы блок-груз и возникновения стягивающих усилий (Т).
На границе раздела существует избыточная поверхностная энергия, характеризующаяся определённой интенсивностью, то есть величиной избыточной энергии, приходящейся на единицу площади границы раздела. Поверхностное натяжение – отношение работы к площади поверхности раздела. s Или: поверхностное натяжение – это работа, которую необходимо совершить для увеличения площади поверхности границы раздела на единицу. Раскроем размерность: s Это означает, что поверхностное натяжение – это сила, которую необходимо приложить для увеличения периметра границы раздела на единицу. С другой стороны: F=Ϭ×S Т.е. поверхностное натяжение – это коэффициент пропорциональности между работой, которую необходимо совершить для перевода молекул из объема в поверхностный слой и площадью поверхности раздела. ПАВ – вещества, способные изменять поверхностное натяжение, а также увеличивать свою концентрацию на границе раздела.
3. Сорбционные процессы: связаны с изменением концентрации вещества на границе раздела дисперсных систем Сорбция – любое изменение концентрации одного или нескольких компонентов в гетерогенной системе. Адсорбция – это самопроизвольный процесс, связанный с изменением концентрации растворённого вещества на границе раздела, приводящий к изменению поверхностного натяжения. Адсорбент – это более плотное вещество, которое адсорбирует растворенное вещество. Например, частица глины является хорошим адсорбентом. Адсорбция – физический процесс. Является обратимым процессом. Десорбция – процесс, обратный адсорбции. Проводится с целью регенерации химических реагентов или адсорбентов. Хемосорбция – это процесс, происходящий в объеме дисперсной системы с образованием новых химических веществ, то есть идут необратимые химические реакции взаимодействия адсорбата в объеме адсорбента. Поверхностные химические реакции – это взаимодействие адсорбата, происходящее в поверхностном слое адсорбента, которое происходит с образованием новых химических соединений. Примером поверхностных химических реакций является процесс силикатизации глин в стенках скважин, при котором Ca2+-катионы в глинах взаимодействуют с силикат ионами SiO2 в водном растворе жидкого стекла. При этом образуются соединения CaSiO2, которые являются цементирующим веществом, что способствует повышению устойчивости стенок скважины в глинистых породах.
Са+2 - глины
вода + жидкое стекло
CaSiO2 Na2O × nSiO2
силикат силикатион Са+2 - глины
Абсорбция – это процесс, связанный с адсорбцией газообразных веществ твёрдыми и жидкими веществами. Например, поглощение газа буровым раствором. 4. Строение мицеллы Мицелла – коллоидная частица. Так, например, добавление хлорного железа FeCl3 в воду при нагреве, идет процесс гидролиза с образованием ядра мицеллы, состоящего из нескольких тысяч гидроокиси Fe(OH)3. Кроме того, в растворе образуется соляная кислота NaCl и остаются не подвергшиеся гидролизу молекулы FeCl3, которые диссоциируют с образованием катионов Fe+3 и анионов Ca-. FeCl3 + H2O + Q (нагрев) ® гидролиз Fe (OH)3 + HCl + FeCl3 Û Fe+3 + Cl- При этом образуются мицеллы, состоящие из m молекул Fe(OH)3 – ядра, к которому примыкае адсорбционный [nFe+3(n-x)3Cl-] и диффузный диффузный слой
{ [mFe (OH)3] [nFe+3 (n-x) Cl- × 3] × 3xCl }
ядро (включает несколько адсорбционный слой тысяч частиц)
Схема коллоидных частиц хлорного железа (а) и глинистых частиц (б) показаны на Рис. 25.
Fe+3 Cl- Cl- m Fe(OH)3 n Fe+3 × 3 (n – x) Cl- 3x Cl- Fe+3 Cl- Cl-
ядро адсорбционный диффузный а) слой слой
Н+ OH- H2O Û H+ + OH-
Н+ OH-
Н+ OH- Алюмосиликатное ядро катионы Са++, Na++, K+ Наличие адсорбционного и диффузного слоёв обеспечивает устойчивость дисперсной коллоидной системы, которой является коллоидный раствор. 5. Двойной электрический слой Двойной электрический слой является причиной взаимодействия заряженных частиц, находящихся на границе раздела. Непосредственной причиной образования двойного электрического слоя является наличие в самой коллоидной системе адсорбционного и диффузного слоев. Двойной электрический слой образован двумя соприкасающимися слоями, состоящими из разноименных зарядов (но разных по величине). Двойной электрический слой образуется на межфазной поверхности и является результатом взаимодействия этих слоев благодаря избыточной поверхностной энергии
На Рис. 26. обозначено: С1; С2; С3 – концентрация электролита в растворе; δ – толщина адсорбционного слоя; λ – расстояние до поверхности скольжения, то есть до поверхности, по которой происходит разрыв диффузного слоя и правая часть его отделяется от левой; jδ1; jδ2; jδ3 – потенциал диффузного слоя; ξ1; ξ2; ξ3 – потенциал поверхности скольжения или дзета-потенциал, или электрокинетический потенциал; j0 – термодинамический потенциал или потенциал Нернста Потенциал Нернста j0 – это потенциал на поверхности коллоидной частицы. Он не зависит от минерализации среды. Является свойством самой глинистой частицы. Коагулянтами называются те электролиты, которые при попадании в водный раствор приводят к уменьшению дзета-потенциала. ПК – порог коагуляции. Это та концентрация электролита (коагулянта) в растворе, при котором начинается коагуляция – сцепление частиц, за счёт уменьшения заряда этих частиц. При коагуляции на поверхности частиц остаётся только адсорбционный слой, через который частицы взимодействуют друг с другом.
коагуляция
пептизация
Коагуляция – агрегатирование частиц за счёт потери ими зарядов. Пептизация – это процесс, обратный коагуляции. Порог коагуляции зависит от валентности коагулирующих катионов. Чем выше валентность коагулирующего катиона, тем ниже значение порога коагуляции: ПК % Na+ - 0,4 Ca++ - 0,06 Al++ - 0,009 6. Тиксотропия Тиксотропия – это свойство раствора изменять своё состояние при встряхивании, или изотермический переход золя в гель, обладающий свойствами твёрдого тела в состоянии покоя и обратимое разрушение структуры с переходом в текучее состояние при механическом воздействии.
золь - свойства гель - твёрдообразное жидкости вещество
тиксотропия «каркас»
подвижная дисперсная система 7. Структурообразование Структурообразование – это способность системы соединять между собой твердые частицы дисперсной фазы с образованием структуры, обладающей прочностью и закономерным пространственным расположением частиц твердой дисперсной фазы в дисперсионной среде. Факторы, обусловливающие структурообразование: а) Коагуляция – процесс агрегатирования частиц за счёт потери электрических зарядов. б) Тиксотропия – обусловливает структурообразование. Присуща частицам твердой фазы, имеющим продолговатую, вытянутую пластинчатую форму.
пластины чешуйки каркас
8. Электрокинетические явления Эти свойства обусловливают движение заряженных частиц в электрическом поле. Причиной этих явлений является наличие адсорбционного и диффузного слоёв вокруг глинистых частиц. а) Электрофорез – направленное движение частиц дисперсной фазы под воздействием электрического поля в неподвижной дисперсионной среде. При достижении электрокинетического потенциала между заряженными пластинами (+ и –) величины ξ2 наступает разрыв диффузного слоя коллоидной глинистой частицы, которая перемещается к полюсу +, а разорванный диффузный слой, являющийся носителем положительных зарядов, перемещается к полюсу –. Это явление электрофореза способствует в реальной скважине перемещению глинистых частиц к стенкам скважины, сложенным глино содержащими горными породами, что способствует возникновению на них сальников, которые являются причиной осложнений при бурении в таких условиях.
+ -
граница скольжения
а) ξ1 < ξ2 r б)
сальник (из глинистых частиц)
глинистый раствор
Рис. 27. Схема электрофореза, возникающего в глинистом растворе: а) отрыв диффузного слоя глинистой коллоидной частицы и движение его к – полюсу; движение глинистой частицы к + полюсу; б) возникновение разрыва диффузного слоя при электрокинетическом потенциале ξ1 < ξ2.
б) Электроосмос – направленное движение молекул дисперсионной среды к полюсу имеющему одноименный заряд с зарядом частиц дисперсной фазы. Сущность электроосмоса заключается в направленном движении молекул растворителя (воды) с целью выравнивания концентрации электролита. Скорость электроосмоса описывается уравнением:
где: ξ – электрокинетический потенциал; ε0 – электрическая константа; ε – относительная диэлектрическая проницаемость; Е – напряженность электрического поля; μп – вязкость дисперсионной среды.
Величина электрокинеического потенциала дисперсной системы описывается формулой Гельмгольца-Смолуховского:
Для исключения электроосмотического перетока вводим в буровой раствор электролит, который способствует насыщению отрицательных зарядов на стенках скважины, сложенных глино содержащими горными породами и приводит к снижению величины дзета потенциала, а, значит, и к уменьшению скорости электроосмотического перетока водной фазы бурового раствора (Рис. 28), что исключает поступление ее в стенки скважины.
электролита
r Рис. 28. Схема возникновения двойного электрического слоя на стенках скважины, сложенных глиносодержащими горными породами.
Для этих целей применяют полимерно-солевые растворы, которые эффективно используются для бурения в глинистых породах.
9. Адгезия (прилипание) Связана с избыточной поверхностной энергией соприкасающихся поверхностей различных или одинаковых по природе. Адгезия – результат стремления таких поверхностей к уменьшению избыточной поверхностной энергии. На границе сред: жидкость – жидкость, жидкость – твёрдое вещество, твёрдое вещество – твёрдое вещество возникает работа адгезии:
где: S – площадь контакта соприкасающихся поверхностей.
Работа адгезии описывается уравнением Дюпре:
исходное значение поверхностного натяжения
Работа адгезии тем больше, чем выше поверхностное натяжение исходных компонентов Модель адгезии в скважине показана на Рис. 29:
пустота буровой раствор
прижимающее усилие
пустота Рис. 29. Схема к модели адгезии бурильной колонны к стенкам скважины: 1 – стенки скважины; 2 – глинистая корка; 3 – бурильная труба; 4 – линия касания бурильной трубы со стенкой скважины.
Чтобы избежать желобообразования нужно уменьшить трение между бурильной колонной и стенками скважины необходимо добавлять полимеры и смазывающие вещества.
Электролиты. Действие электролитов связано с их воздействием на двойной электрический слой и гидратную оболочку, находящиеся на гидратированной глинистой частице. При низких концентрациях электролита (до порога коагуляции) происходит увеличение заряда частицы за счет попадания в диффузный и адсорбционный слои катионов и анионов диссоциировавшего электролита. Это приводит к увеличению заряда, силы взаимодействия ослабевают, меняются структурные свойства раствора, поэтому при низких концентрациях электролит способствует усилению структурообразования. При увеличении концентрации электролита (выше порога коагуляции) происходит компенсация зарядов на поверхности глинистой частицы, диффузный слой сжимается, что приводит к коагуляции. При высокой концентрации электролита происходит сжатие диффузного и адсорбционного слоев, что вызывает коагуляцию глинистых частиц.
коагуляция
К выбору концентрации электролита нужно подходить осторожно. В каждом случае рациональная концентрация электролита подбирается экспериментально. Основные представители электролитов: KOH – гидроксид калия (едкий калий); NaOH – гидроксид натрия (едкий натр); Ca(OH)2 – гидроксид кальция; Na2CO3 – кальцинированная сода (бикарбонат кальция); NaHCO3 – гидрокарбонат натрия; BaCO3 – карбонат бария; Na2O∙nSiO2 – силикат натрия (жидкое стекло); NaCl – хлорид натрия; CaCl2 – хлористый кальций; K2CO 3 – бикарбонат калия (поташ). Na2Cr2O7 хромпик (двухромовокислый натрий, калий) K2Cr2O7 ярко-оранжевый цвет, пары являются токсичными. Действие электролитов на изменение параметров глинистого раствора, отражено на изменении показателя фильтрации (Ф30), условной вязкости (Т) и статического напряжения сдвига (θ) при увеличении концентрации в нем кальцинированной соды (Na2CO3): Ф30 Т Ф30 Q
Т
Q
2-5 13-15 Na2CO3, % 10 20 30 Рис.48. влияние концентрации Na2CO3 на параметры глинистого раствора. 1 область при концентрации Na2CO3 до 2-3% - область стабилизации Ф30↓; Т↓; θ↓ - все параметры снижаются. Это связано с тем, что диссоциируемые катионы Na+ и анионы CO3-2 насыщают поверхность глинистой частицы, заряд частицы возрастает, а силы взаимодействия ослабевают. Раствор разжижается, снижаются структурные свойства, показатель фильтрации уменьшается. 2 область при концентрации Na2CO3 до 13¸15% – область структурообразования, в которой Ф30↓; Т↑; θ↑, т.е. снижается показатель фильтрации, а условная вязкость и статическое напряжение сдвига увеличиваются. Усиление структурных свойств происходит за счет того, что попадая в диффузные слои Na+ и СО3-2 приводят к компенсации заряда глинистых частиц. Силы взаимодействия возрастают, что ведет к возрастанию структурных свойств. В этом случае глинистые частицы соединяются между собой краевыми частями и гранями зарядов. 3 область при концентрации Na2CO3 более > 15% - Ф30↑; Т↓; θ↓, т.е. возрастает показатель фильтрации, а условная вязкость и статическое напряжение сдвига увеличиваются. В этой области концентрация электролита увеличивается, а заряд глинистой частицы приближается к нулю. Выпадают из раствора агрегаты глинистых частичек. Падают структурные свойства раствора. Глинистые частички соединяются гранями и ребрами. К выбору оптимальной концентрации электролита необходимо подходить осторожно, так как в случае приближения ее к порогу коагуляции ухудшаются свойства глинистого раствора. Характеристика наиболее часто применяемых реагентов-электролитов приводится ниже: 1. Na2CO3 – кальцинированная сода (получается методом кальцинирования). Порошок белого цвета, хорошо растворяется в воде. Растворимость – до 320 кг/м3. Назначение: - улучшение качества глин местного производства; - повышения выхода раствора из глин смешанного состава (Na+ + Ca+2); - связывание катионов двухвалентных металлов; - повышения рН растворов. Са+2 – глина – наиболее часто присутстыует в местных глинах. Для их модернизации с целью улучшения качества глинистого раствора в состав его вводят кальцинированную соду:
Са-глина + Na2CO3 ® CaCO3 + Na-глина Na+ Ca+
Na+
Ca+ При этом Са+2 катионы связываются оксидом Кальциевая глина невысокого качества, так как имеет неразвитую гидратную оболочку, катионный обмен идет неэффективно, гидратация плохая. Поэтому образующаяся Na+-глина дает более высокое качество растворов. Натриевая глина более эффективно набухает, хорошо гидратирует. Предпочтительными являются натриевые глины. При перебуривании гипсов и ангидритов выделяющиеся из их состава катионы Са+2 вызывают коагуляцию глинистых растворов: Гипс – CaSo4∙2H2O (природный гипс, камень), ангидрит – CaSO4 При введении в состав глинистого раствора соды Na2CO3 катионы Са+2 связываются и вызывают коагуляцию глинистых частиц в растворе: CaSO4 + Na2CO3 → CaCO3 + Na2SO4
Хорошо растворимое вещество Слабо растворимое вещество При перебуривании цементов содирование тоже позволяет устранить коагуляцию частиц глины:
В случае притока минерализованных вод сода связывает жесткие катионы Са+2, устраняя коагуляцию глинистого раствора:
2. NaOH – гидроксид натрия (едкий натр). Растворимость 1040 кг/м3. Хорошо растворим в воде. Гигроскопичен. Хранится как 40%-60% водный раствор (синеватого цвета). Назначение: - повышение качества глин; - связывание сероводорода; - повышение рН среды. При диссоциации в составе глинистого раствора щелочь повышает его качество:
родственный анион для гидратной оболочки глинистых частиц В случае сероводородной агрессии добавки щелочи нейтрализуют сероводород.
При добавлении в раствор гидроксида натрия повышается рН за счет увеличения содержания катионов водорода. 3. СаCl2 - растворимость до 726 кг/м3 Назначение: - регулирование содержания Ca+2 в фильтрате бурового раствора; - усиление ингибирующего и крепящего действия. Применяются для приготовления хлоркальциевых и ингибированных растворов. 4. NaCl – растворимость до 300 кг/м3 Назначение: - структурообразователь для растворов, приготовленных из глин невысокого качества и также растворов с низким содержанием твердой фазы; - получение солевых растворов (применяются при бурении в многолетне мерзлых породах, при бурение глинистых породах, для получения минерализованных растворов). 5. Na2O ∙ nSiO2 – жидкое стекло (от светло-желтого до темно-бурого цвета) представляет собой водный раствор Назначение: - структурообразование в глинистых растворах при концентрации менее 5%; - разжижижение при концентрации до 2%-3%; - силикатизация глин – зак
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-19; просмотров: 369; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.134.149 (0.01 с.) |


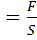 , [
, [ 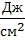 ]
] или размерность s
или размерность s  .
. Cl- слои.
Cl- слои.





 (1)
(1)

 [Дж/м2] (2)
[Дж/м2] (2) – полная работа обратимого разрыва (разрушения) адгезионных сил связи соприкасающихся поверхностей;
– полная работа обратимого разрыва (разрушения) адгезионных сил связи соприкасающихся поверхностей; (3)
(3)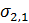 и
и 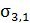 и чем выше конечное поверхностное натяжение
и чем выше конечное поверхностное натяжение 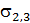 , являющееся результатом взаимодействия соприкасающихся поверхностей.
, являющееся результатом взаимодействия соприкасающихся поверхностей.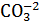 и образуется Na+-глина
и образуется Na+-глина безводный.
безводный.

 → улучшет гидратацию
→ улучшет гидратацию



