
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Линии мышей с генетическими дефектами, затрагивающими иммуннуюСодержание книги
Поиск на нашем сайте
ИНБРЕДНЫЕ ЖИВОТНЫЕ Для проведения фундаментальных исследований в иммунологии лучший объект - инбредные мыши. Инбредные животные - это животные, полученные путем инбридинга (in breed - выводить породу, разводить), т.е. последовательных близкородственных скрещиваний с целью получения гомозиготного и генетически идентичного потомства. Среди потомков для дальнейших скрещиваний сначала отбирают особей по признакам внешнего сходства, в последующих поколениях уже тестируют на совпадение групп крови и приживление кожных лоскутов. Через 20 поколений и более такой селекции получают мышей с весьма высокой степенью гомозиготности, обозначаемых как чистая линия, в пределах которой все животные генетически почти идентичны (например, как однояйцевые близнецы у человека). Главная цель выведения чистых линий мышей и исследований на них - получение возможности многократного повторения экспериментов на генетически одинаковых организмах, т.е. обеспечение воспроизводимости результатов исследований в высоком смысле этого понятия, что полностью исключено при решении многих иммунологических задач с использованием беспородных животных. Подобные проблемы существуют при оценке результатов иммунных процессов у человека. Мыши стали исключительными экспериментальным животными в иммунологии в силу ряда причин, главные из которых следующие: 1) короткий срок беременности (21 сут) и множественное потомство от каждой самки (5-8 детенышей в одни роды) позволяют весьма быстро вывести чистые линии, что важно по вышеназванным причинам; 2) себестоимость содержания мышей по сравнению с таковой других млекопитающих наименьшая; 3) структура и функция иммунной системы мыши и человека во многом сходны; 4) выведение чистых линий мышей показало, что, например, некоторые из них (несмотря на гомозиготность) весьма крепкие и здоровые, т.е. не всякий инбридинг приводит к вырождению. Кроме того, путем целенаправленного отбора тех или иных свойств созданы многочисленные линии мышей с точно заданными характеристиками, и это позволяет выбирать особей, необходимых для достижения конкретных научных целей. Характеристики животных разных линий занесены в соответствующие документы; на них ориентируются питомники по разведению чистолинейных мышей, имеющиеся во всех странах, где успешно занимаются проблемами экспериментальной иммунологии. Из наиболее прославленных питомников хотим упомянуть Джексоновскую лабораторию (The Jackson Laboratory) в США. Ежегодно она поставляет в университеты, медицинские институты и научно-исследовательские лаборатории всего мира приблизительно 2 млн животных 2500 разных линий, стоков и животных-моделей. Около 97% этих животных можно приобрести только в Джексоновской лаборатории. В каждом питомнике разводимые и поддерживаемые линии мышей имеют паспорт, систематизированы в соответствующих базах данных и доступны для широкого применения. Известен гаплотип (Н-2) мышей разных линий, их окрас, поведенческие характеристики, особенности функционирования иммунной системы и прочие свойства, необходимые не только для иммунологических исследований, но и исследований в других областях биологии и медицины (онкология, фармакология, экология и т.д.). Мы приводим характеристику некоторых наиболее известных линий мышей, которые экспериментаторы выбирают с теми или иными определенными целями (табл. 1.1). Таблица 1.1. Линии инбредных мышей, наиболее часто применяемые в исследованиях (Кондратьева И.А., Ярилин А.А., 2004)
C57B1/6 (рис. 1.2, см. также цв. вклейку) - черного цвета мыши, подвижные, агрессивного поведения. Balb/c (рис. 1.3) - белые мыши с хрупким здоровьем. Однако это самая востребованная линия для гибридомной биотехнологии, потому что линии миелом, на основе которых получают гибридомы, ведут свою «родословную» от перевивной линии лейкозных клеток МОРС- 21, происходящей от мышей Balb/c. Гибридомы хорошо растут в брюшной полости живых сингенных мышей в виде асцитных опухолей. Кроме собственно чистых линий мышей, генетики научились выводить так называемых конгенных мышей. Так называют линии, отличающиеся друг от друга небольшой областью генома (иногда одним геном).
В основе выведения конгенных линий мышей лежит генетический прием возвратного скрещивания - получение потомства в ряду поколений от скрещивания гетерозиготы (потомков гомозиготных родителей, генетически отличающихся между собой) с одним из исходных гомозиготных родителей. Смысл подобного скрещивания - внедрить комплекс Н-2 донорской линии А в генотип основной линии В. На рисунке 1.4 представлены донорская маркирующая линия А и основная линия В. От скрещивания гомозиготных особей этих двух линий получают гибриды первого поколения F1, (a/b; генерация 1). При дальнейшем скрещивании гибридов F1 с особями основной линии В получают потомство, состоящее как из гомозигот (b/b), так и гетерозигот (а/b) по комплексу Н-2. В последующих скрещиваниях отбираются только гетерозиготные особи, имеющие признак «а» (Н-2а), который определяется по приживлению кожного трансплантата от маркирующей линии A и положительной серологической реакции клеток крови с анти-А-сывороткой. По мере продолжения скрещиваний а-положительных особей с особями основной линии В доля генома линии А постоянно снижается, но при этом для дальнейшего размножения из потомства отбирают только тех особей, которые сохраняют признак «а» (H-2a). К двенадцатому поколению (генерация? 12) практически весь геном отбираемых после гибридизации мышей представлен основной линией В, за исключением признака «а», по которому шел отбор. Дальнейшая задача состоит в переводе признака «а» в гомозиготное состояние. Для этой цели гетерозигот (а/b) скрещивают между собой и отбирают для дальнейшего размножения только тех особей из потомства, которые отторгают кожный трансплантат, взятый от особей линии В, и не дают реакции с анти-В-сывороткой. Подобный отбор выявляет особей с отсутствием признака «b» (H-2b) и гомозиготность по признаку «а» (H-2a). Таким образом, в результате применения данной схемы скрещивания в геном основной линии В внедряется комплекс Н-2 маркирующей линии А (рис. 1.4). С момента перевода комплекса H-2a в гомозиготное состояние констатируется получение новой конгенной (по отношению к основной) линии В (Klein J., 1975). СИСТЕМУ SCID (англ. severe combined immunodeficiency) - мыши, страдающие тяжелым иммунодефицитом в результате мутации в генах RAG, ответственных за перегруппировку генов иммуноглобулинов и Т-клеточного рецептора. Животные практически лишены Т- и В-лимфоцитов и могут жить в безмикробных условиях, но необязательно - в полностью стерильных. Эти мыши не отторгают ксеногенные ткани, в частности им можно вводить с расчетом на приживление самые разнообразные клетки человека. В 1959 г. Расселом и соавт. описаны определенные частично инбредные мыши - спонтанные мутанты-самцы, которые вскоре после рождения покрывались чешуйчатой перхотью (рис. 1.5), заметно отставали в росте, страдали от тяжелой диареи и умирали в возрасте около 3 нед. При морфологическом исследовании у мышей наблюдали массивную лимфоаденопатию, спленомегалию, аномаль-
ную инфильтрацию лимфоцитами кожи, печени, легких, эндокринных желез. Мутантных самцов назвали «скуpфи» (англ. scurfy - покрытые перхотью). Только в 2001 г. M.E. Brunkow и соавт. показали: мутация scurfy затронула ген фактора транскрипции FoxP3 (вставка двух пар оснований в 8-й экзон этого гена), локализованного на Х-хромосоме. В том же 2001 г. несколько исследователей (C. Bennett, R. Wildin) показали: у детей с синдромом IPEX поврежден тот же ген (Xp11.23-Xq13.3), что и у мышей scurfy - FoxP3. В 2003-2005 гг. Джейсон Фонтенот и Александр Руденский показали: экспрессия гена FoxP3 является существенным и определяющим моментом в дифференцировке в тимусе Т-регуляторных клеток (Treg), открытых Сакагучи в 1995-1996 гг. и ответственных за поддержание иммунологической толерантности к нормальным тканям своего организма и гомеостаза в иммунной системе, а также за контроль аутоиммунных и опухолевых заболеваний.
Nude (лишенные волосяного покрова) - замеченные и отобранные в 1960 г. мыши со спонтанной мутацией, в результате которой у мышей-гомозигот по данной мутации (nu/nu) отсутствуют тимус и волосяной покров (рис. 1.6, см. также цв. вклейку). Мутантный ген поддерживают при размножении мышей в гетерозиготном состоянии; он перенесен мышам нескольких других линий, например Balb/c, CBA/Ca, C57Bl/10ScSn и пр.
C57Bl/6-bg/bg (англ. beige - бежевый) - мыши-мутанты бежевого окраса из исходно черной линии. Характеризуются существенно сниженной активностью NK-клеток и фагоцитов с повреждением лизосомальных структур. AKR - белые мыши (рис. 1.7, см. также цв. вклейку). У 90% особей обоего пола к возрасту 6-8 мес развиваются «спонтанные» тимомы и лейкоз.
W/Wv - мыши с существенным дефицитом тучных клеток в слизистых оболочках. ЛИНИИ МЫШЕЙ С АУТОИММУННОЙ ПАТОЛОГИЕЙ NZB (New Zeland Black) - новозеландские черные мыши с аутоиммунной гемолитической анемией. Сывороточные антиэритроцитарные антитела мышей связывают эритроциты, но не агглютинируют их. (NZB χ NZW)F1 - гибриды первого поколения черных и белых новозеландских мышей. У них «спонтанно» развивается синдром, напоминающий красную волчанку человека с гломерулонефритом. В крови содержится много антител к ДНК. MRL/ Mp-lpr/lpr - мыши с СКВ и ревматоидным артритом, с синдромом повышенной лимфопролиферации, увеличенными лимфоузлами. В крови у них увеличено содержание антител против иммуноглобулинов и против ДНК. Мутация идентифицирована в гене Fas, т.е. у этих мышей имеется недостаточность процессов апоптоза лимфоцитов. MRL /Mp- +/+0 - мыши с хроническим гломерулонефритом, антителами к ДНК, но без лимфоаденопатии. C57B\/KS-db/db - склонные к быстрому ожирению мыши, у которых к возрасту 4 мес развиваются существенное повреждение выработки инсулина и тяжелый диабет. NOD (non-obese diabetic mouse) - мыши с диабетом, но без ожирения. Модель с болезнью, наиболее близкой к диабету I типа у человека. EAGM (experimental autoimmune myasthenia gravis) - мыши с аутоиммунной миастенией гравис. EAE (experimental autoimmune encephalitis) - мыши с аутоиммунным энцефалитом. EAT (experimental autoimmune thyroiditis) - мыши с аутоиммунным тиреоидитом. БИОЛОГИЧЕСКИЕ МАТЕРИАЛЫ ДЛЯ ИССЛЕДОВАНИЙ Для исследования иммунной системы используются следующие биологические материалы. 1. Цельная периферическая кровь. 2. Сыворотка крови - жидкая фракция крови, освобожденная от фибриногена. 3. Плазма крови - жидкая фракция крови, содержащая фибриноген, следовательно, способная к образованию сгустков фибрина. 4. Клетки крови, отделенные от жидкой фракции. 5. Цереброспинальная жидкость. 6. Синовиальная жидкость. 7. Бронхоальвеолярный лаваж. 8. Выделения слизистых секретов половых органов (из канала шейки матки, влагалища, семенная жидкость). 9. Выделения из носа (смывы или адсорбция на пористые материалы). 10. Моча. 11. Супернатанты, полученные от культивируемых in vitro клеток 12. Гомогенаты тканей (биопсия или post mortem). 13. Цитоплазматические и ядерные компоненты клеток. Биологический материал разного происхождения отличается по биохимическому составу, ионной силе, вязкости. Все эти параметры имеют существенное значение для реализации связывания антител с антигенами, используемыми для тестирования. Поэтому каждая конкретная тест-система разработана строго для конкретного вида биоматериала и в 99% случаев - для сыворотки крови. Тест-системы для анализа компонентов сыворотки не могут быть использованы в опытах с другими биологическими жидкостям из-за высокой вероятности получения ложных результатов. Тест-системы, предназначенные для человека (за некоторыми исключениями), нельзя примененять на лабораторных животных и наоборот. Исключение составляют перекрестно-реагирующие агенты, например цитокин - трансформирующий фактор роста человека и свиньи. Приведем несколько примеров технических приемов получения биоматериалов. Сыворотка крови Как правило, у человека или животных берут венозную кровь в чистую сухую пробирку. Оставляют при комнатной температуре на 20-30 мин для образования первичного сгустка фибрина. Затем пробирки центрифугируют на цитоцентрифугах при 1000-2000 об/мин в течение 10 мин. Супернатант и есть сыворотка крови. Если анализ выполняют не в тот же день и час, то сыворотку разливают по аликвотам в плотно закрываемые криопробирки (полипропиленовые) и замораживают. Для краткосрочного хранения можно заморозить до -18-20 °С, для более продолжительного хранения лучше использовать морозильные камеры с температурой -70-80 °С. Повторные оттаивания-замораживания нежелательны или недопустимы (в зависимости от конкретного вида анализа). Нежелательно или недопустимо также использовать в работе сыворотки с признаками гемолиза и липидемии. Существуют приемы так называемого осветления мутного биоматериала, в частности центрифугирование при 14 000 об/мин в течение 10 мин. Однако следует иметь в виду: при этой процедуре возможна потеря искомого биопродукта. И все же данную процедуру принято применять для осветления проб мочи, цереброспинальной жидкости, бронхоальвеолярного лаважа, синовиальной жидкости. Плазма крови Для получения плазмы крови следует позаботиться о том, чтобы не образовался сгусток фибриногена. Добиваются этой цели двумя способами: либо работают как можно быстрее, свежевзятую кровь безотлагательно центрифугируют при 2000 g в течение 10 мин с охлаждением, супернатант быстро разливают по аликвотам в охлажденные полипропиленовые пробирки и морозят; либо кровь берут в пробирки с антикоагулянтами (гепарином, цитратом натрия или этилендиаминтетраацетатом - ЭДТА). Но в последнем случае следует учитывать, что присутствие антикоагулянта в биоматериале не повлияет на результаты иммуноанализа. В большинстве случаев антикоагулянты влияют на взаимодействие антител с антигенами, большинство тест-систем рассчитано на работу с сывороткой крови, а не с плазмой. Лабораторная работа 1-1 ВЫДЕЛЕНИЕ ЛЕЙКОЦИТОВ Принцип метода. Для осаждения эритроцитов из периферической крови применяют растворы декстрана, желатины и др. Гепаринизированную кровь смешивают с 6% раствором декстрана или 0,3% раствором желатины в соотношении 1:5. Смесь в пробирке отстаивают 30-40 мин под углом 45° в термостате при температуре 37 °С до осаждения эритроцитов. Плазму, обогащенную лейкоцитами, отбирают, примесь эритроцитов лизируют. Выделенные клетки отмывают центрифугированием в растворе Хенкса или культуральной среде 199 при 1000 об/мин в течение 5 мин. Лабораторная работа 2-1 1. 10 мл гепаринизированной крови человека (20-25 ЕД гепарина на 1 мл крови) разводят в 3 раза (1 часть крови и 2 части питательной среды 199). 2. Разведенную кровь наслаивают на раствор фиколл-урографина (плотность 1,077 г/см3) в соотношении 1:3 (1 часть фиколла и 3 части разведенной крови). Кровь остается над раствором фиколла и не смешивается с ним. 3. Проводят центрифугирование при комнатной температуре в течение 45 мин на центрифуге с горизонтальным ротором при 400 g. Следует иметь в виду, что для определения необходимого числа оборотов в конкретных условиях центрифугирования или получения соответствующего центробежного ускорения одну из необходимых величин (ускорение или число оборотов) находят по формуле:
4. После центрифугирования собирают интерфазное кольцо, содержащее мононуклеарные клетки, в отдельную пробирку. Эритроциты склеиваются фиколлом и оседают на дно пробирки вместе с гранулоцитами (см. рис. 2.2). 5. Суспензию мононуклеарных клеток трижды отмывают средой 199, центрифугируя по 10 мин при 200 g. 6. Клетки ресуспендируют в 1 мл культуральной среды. Подсчет клеток осуществляют в камере Горяева. Жизнеспособность клеток определяют с помощью 0,1% раствора трипанового синего. Необходимо подсчитать процент выхода жизнеспособности клеток (более 90%). Для этого подсчитывают начальное количество клеток и количество выделенных клеток.
Лабораторные методы выделения моноцитов разнообразны, но основные методические приемы преимущественно связаны с фракционированием моноцитов по способности прилипать к стеклу или пластиковой поверхности или по способности при центрифугировании к локализации в определенных зонах ступенчатого градиента. Метод Рекалде Принцип метода. Данный метод выделения моноцитов основан на центрифугировании лейкоцитов в гипертоническом градиенте плотности фиколл-урографина (Recalde Н., 1984). Лабораторная работа 2-2 Постановка метода Рекалде 1. Кровь осторожно перемешивают с 6% раствором декстрана Т-500 («Pharmacia», Швеция), приготовленном на физиологическом растворе из расчета: 1 объем декстрана на 5 объемов крови. 2. Кровь отстаивается в течение 30 мин (15 мин при 37 °С, затем 15 мин при комнатной температуре). 3. Осторожно собирают плазму, обогащенную лейкоцитами (лейкомасса). К полученной лейкомассе трехкратно добавляют раствор NaС1 по следующей схеме: • 0 мин - добавляют 9% NaС1 из расчета 5 мкл на 1 мл лейкомассы, инкубация 10 мин при 37 °С; • 11-я минута - добавляют 9% NaС1 из расчета 10 мкл на 1 мл лейкомассы, инкубация 10 мин при 37° С; • 21-я минута - добавляют 9%?С1 из расчета 10 мкл на 1 мл лейкомассы, инкубация 10 мин при 37 °С. Общее время инкубации составляет 30 мин. 4. К лейкомассе добавляют равный объем раствора Хенкса, соответствующей осмомолярности, полученный путем добавления 25 мкл 9% раствора NaС1 на каждый миллилитр стандартного раствора Хенкса. 5. Немедленно проводят выделение моноцитов на гипертоническом градиенте плотности. Для этого в стандартный раствор фиколлурографина добавляют кристаллический NaС1 из расчета 2,8 мг на каждый миллилитр раствора фиколл-урографина (удельная плотность 1,078 г/см3). Конечная плотность раствора составляет 1,080 г/см3. В силиконированные пробирки на один объем гипертонического градиента осторожно наслаивают 3 объема подготовленной лейкомассы. 6. Пробирки центрифугируют в течение 25 мин при 400 g при комнатной температуре в центрифуге с горизонтальным ротором. После центрифугирования моноциты концентрируются в интерфазном кольце. 7. Моноциты из интерфазы переносят в силиконированные пробирки и дважды отмывают средой 199, содержащей 5% СЭК. Режим центрифугирования - 10 мин при 200 g. 8. Клетки ресуспендируют в питательной среде RPMI-1640, содержащей 1% L-глютамина, 40 мкг/мл гентамицина и 10% СЭК. Количество моноцитов определяют подсчетом в камере Горяева. Жизнеспособность клеток оценивают с помощью 0,1% раствора трипанового синего. ВЫДЕЛЕНИЕ НЕЙТРОФИЛОВ Для выделения нейтрофилов из периферической крови можно использовать несколько методов. Оптические системы Источником света обычно служит лазер. Он способен направить на клетку интенсивный световой сигнал и создать чувствительную систему детекции. Световой сигнал проходит через соответствующие линзы и зеркала и попадает на ФЭУ. На этой стадии передачи сигнала используются оптические фильтры для выделения света с определенной длиной волны, благодаря чему на каждый детектор попадает только избранный тип светового сигнала, например зеленое или красное излучение клеток при флуоресценции или рассеянный свет. Оптический блок предназначен для измерения рассеяния света и флуоресценции. Современные цитометры оборудованы несколькими фотоэлектронными умножителями, что позволяет одновременно регистрировать несколько типов флуоресценции.
Лабораторная работа 2-3 1. Получают гепаринизированную периферическую венозную кровь (20-25 ЕД гепарина на 1 мл крови) в объеме 5 мл. 2. Лейкоциты выделяют из периферической крови. Для этого добавляют в пробирку 0,3% раствор желатины, перемешивают и инкубируют в термостате 30 мин при 37 °С для осаждения эритроцитов. Собирают лейкомассу. Клетки отмывают полной культуральной средой, центрифугируя при 1000 об/мин в течение 10 мин. Процедуру отмывки проводят дважды. 3. К клеточному осадку добавляют 50 мкл полной культуральной среды. Затем в каждую пробирку вносят по 50 мкл предварительно разведенного образца нужных моноклональных антител (монАТ), меченных флуорохромами. Одна пробирка (контроль) содержит только клетки и полную культуральную среду.В остальные пробирки добавляют монАТ - CD3, CD4, CD8, CD19 и другие в зависимости от цели эксперимента. 4. Пробирки инкубируют 30 мин при 4 °С. 5. Клетки отмывают от излишних монАТ в полной культуральной среде центрифугированием при 1000 об/мин в течение 5 мин. 6. Оставшиеся в пробе эритроциты лизируют, добавляя к клеточному осадку лизирующий раствор, состоящий из 0,8% раствора NH4Cl, 0,1% раствора NaHCO3, 0,0037% натриевой соли ЭДТА (рН = 7,2-7,4). 7. Проводят встряхивание проб на шейкере 1 мин. 8. Образцы центрифугируют 5 мин при 1000 об/мин. Надосадочную жидкость сливают, добавляют полную культуральную среду и повторяют центрифугирование в том же режиме. 9. Для фиксации меченых клеток в каждую пробу добавляют по 100 мкл 2% параформальдегида и инкубируют 30 мин при 4 °С. 10. Анализ образцов проводят на проточном цитометре. Содержание основных субпопуляций лимфоцитов в периферической крови здоровых людей представлено в табл. 2.2. Лабораторная работа 3-1 1. 1х106 КМ инкубируют в среде, содержащей изотоп Na251CrO4 (37×105 Bq или 100 мкКю, специфическая активность 5 мкКю/моль), при 37 °С в течение 1-1,5 ч, после чего тщательно отмывают от не вошедшего в клетки изотопа. 2. КМ подсчитывают и раскапывают в подобранной дозе в лунки культуральных круглодонных микропланшетов. 3. В те же лунки вносят КЭ. Соотношение КМ и КЭ обычно составляет от 1:10 до 1:500 в пользу КЭ. 4. Плашки подвергают мягкому центрифугированию - 150 g в течение 1 мин, после чего помещают в СО2-инкубатор при 37 °С на 4-6 ч. 5. По завершении культивирования плашки центрифугируют при 250 g в течение 5 мин для плотного осаждения клеток. 6. Супернатанты собирают в специальные пробирки, в которых радиоактивность подсчитывают в γ-счетчике. 7. В качестве контроля используют: а) лунки с КМ, в которые не вносят КЭ, - это контроль спонтанного выхода метки; б) лунки с КМ, в которые вместо КЭ вносят детергент Triton X-100 1% (v/v), - это контроль максимально возможного высвобождения метки из КМ. Цитотоксичность в опытных лунках рассчитывают обычно по следующей формуле:
Лабораторная работа 3-2 КМ К-562 метят изотопом 3Н-уридином (1 мкКи/мл) и инкубируют 1 ч при 37 °С. Затем клетки трижды отмывают культуральной средой, содержащей 10% СЭК. Отмытые КМ выдерживают в культуральной среде 2 ч при 37 °С и отмывают еще раз с целью удаления 3Н-уридина, не включившегося в РНК КМ. Готовят рабочую суспензию меченых КМ с таким расчетом, чтобы в 1 мл содержалось 1×106 КМ и 5 мкг панкреатической РНК-азы. Цитотоксическую реакцию проводят в круглодонных 96-луночных микропланшетах. В каждую ячейку помещают по 100 мкл рабочей суспензии меченых КМ с РНК-азой и 100 мкл суспензии мононуклеарных клеток (рабочая концентрация - 1х107/мл). Используют различные соотношения КЭ:КМ - 100:1; 50:1; 25:1; 12,5:1. Клетки каждого разведения помещают как минимум в 3 лунки. В контрольных пробах меченые КМ инкубируют без мононуклеарных клеток. Культуры инкубируют 14 ч при 37 °С и с 5% содержанием СО2. После инкубации содержимое лунок переносят на фильтры с помощью собирателя клеток - харвестра. Фильтры высушивают, помещают в сцинтилляционную жидкость, проводят учет реакции с помощью β-счетчика. Показатель функциональной активности естественных киллеров выражают в виде индекса цитотоксичности (ИЦ), который определяют по формуле:
В качестве метки для КМ применяют флуоресцентный краситель 5-, 6-карбоксифлуоресцеин диацетатсукцинилмидиловый эфир (КФДЭ), который образует прочную ковалентную связь с внутриклеточными белками и в используемой концентрации не влияет на жизнеспособность клетки. Первоначально нефлуоресцирующий КФДЭ проникает через клеточную мембрану. Карбоксифлуоресцеины связываются с внутриклеточными молекулами, формируя конъюгаты, обеспечивая стойкое флуоресцентное окрашивание клетки. Окрашенные таким образом КМ К-562 смешивают с КЭ и инкубируют в течение нескольких часов. После окончания культивирования клетки окрашивают пропидий йодидом для определения убитых в ходе реакции КМ. По количеству убитых К-562 определяют активность NK-клеток. Анализ проводят на проточном цитофлуориметре и определяют количество КМ, включивших КФДЭ (зеленое свечение), и количество убитых клеток, включивших пропидий йодид (красное свечение). ФАГОЦИТОВ Фагоцитарные клетки - основная группа клеток системы врожденного иммунитета. Они имеют миелоидное происхождение и обладают способностью к фагоцитозу. По морфологии и функции их разделяют на мононуклеарные клетки (моноциты/макрофаги) и нейтрофилы, что соответствует предложенному И.И. Мечниковым разделению на макро- и микрофаги. Роль фагоцитов в иммунном ответе крайне многообразна. Они выполняют ряд ключевых функций как во врожденном, так и в адаптивном иммунитете. Активация фагоцитов запускается через многие поверхностные рецепторы. Ведущая роль в активации фагоцитов отводится паттернраспознающим рецепторам врожденного иммунитета, таким, как Toll-подобные рецепторы, NOD-рецепторы, манозные рецепторы, рецепторы-«мусорщики», рецепторы комплемента и многие другие. Ответная реакция развивается быстро, не требует пролиферации и дифференцировки клеток. Процесс активации обычно подразделяется на два этапа: прайминг и собственно активация. Суть прайминга заключается в том, что предварительная обработка клеток небольшим количеством стимулятора (1-й сигнал), действие которого не вызывает прямую активацию, сопровождается увеличением ответа фагоцитов на второй сигнал. В результате активированные фагоциты выполняют следующие функции: • выработка активных форм кислорода (АФК); • генерация окиси азота; • хемотаксис; • фагоцитоз; • синтез и секреция цитокинов и других биологически активных медиаторных молекул (метаболитов арахидоновой кислоты, компонентов комплемента, факторов свертывания крови, белков матрикса, ферментов, противомикробных пептидов, гормонов и др.); • бактерицидная активность; • процессинг и презентация антигена («профессиональными» антигенпредставляющими клетками: дендритными, мононуклеарными фагоцитами). Лабораторная работа 3-3 Лабораторная работа 3-4 Лабораторная работа 3-5 Оценка киллинга фагоцитов Наиболее надежный метод оценки завершенности фагоцитоза - микробиологический, заключающийся в измерении числа бактерий, выживших в лейкоцитах после фагоцитоза. Принцип метода. Для постановки метода готовят взвесь лейкоцитов и опсонизированных микроорганизмов в соответствующих соотношениях. Через определенные промежутки времени лейкоциты разрушают, делают посевы на питательный агар и через сутки подсчитывают число выросших колоний. Лейкоциты здоровых доноров убивают до 80% бактерий за 20-30 мин (Czuprynski, 1983). МЕТОДЫ ОПРЕДЕЛЕНИЯ ПРЕЦИПИТАТОВ АНТИТЕЛ С АНТИГЕНАМИ В ГЕЛЕ Лабораторная работа 4-1 Иммуноэлектрофорез В те же 40-е гг. XX в. биохимики научились проводить электрофоретическое разделение белков в гелевых средах. В 1953 г. П. Грабар и К. Уиллиамс (P. Grabar, C.S. Williams) предложили методику иммуноэлектрофореза, которая фактически представляет собой комбинацию электрофоретического разделения белковых смесей и метода Оухтерлони и Элека. В геле с одного края пластины пробивают ряд из несколько лунок, в которые вносят исследуемые на содержание тех или иных интересующих белков растворы или сыворотки пациентов. К пластине с гелем прикладывают электрическое поле и проводят электрофорез. По завершении электрофореза в геле в центре пластины вырезают канавку, параллельную направлению движения белков в электрическом поле. В эту канавку вносят антисыворотку или смесь антител против искомых белков и оставляют на 16-24 ч для диффузии, после чего регистрируют образующиеся полосы преципитации. Число полос преципитации показывает, к какому количеству компонентов, находящихся в биопробе, в антисыворотке есть комплементарные антитела. Если при электрофорезе использовать калибраторы, т.е. известные белки в достаточных концентрациях, то сравнение полос преципитации материала из биопроб с полосами преципитации с калибровочными белками может стать доказательством наличия в испытуемом материале конкретного белка(ов). Существует множество модификаций метода иммуноэлектрофореза. На рис. 4.3 проиллюстрировн наиболее простой и употребляемый вариант.
В стартовые лунки для электрофореза внесены сыворотки крови двух пациентов - 1 и 2, в канавку в центре пластины по завершении электрофореза проб сывороток внесена смесь антисывороток против основных фракций сывороточных белков - альбуминов, α-, β- и γ-глобулинов. После диффузии сыворотки-1 видны дуги преципитации со всеми основными фракциями сывороточных белков, в том числе с иммуноглобулинами. В сыворотке пациента 2 гамма-глобулины отсутствуют. На основании данных электрофореза пациенту 2 поставлен диагноз агаммаглобулинемии. «Ракетный» иммуноэлектрофорез Если к гелю на стеклах, полностью подготовленных для выполнения метода радиальной иммунодиффузии, приложить электрическое поле, то движение компонентов сывороток, в том числе иммуноглобулинов, из лунок в толщу геля будет происходить не в режиме спонтанной диффузии, а в принудительном режиме по силовым линиям электрического поля, что существенно ускоряет процесс. В результате преципитаты станут видны уже примерно через 1 ч, но будут иметь форму не колец, а вытянутых пиков, напоминающих летательные аппараты - ракеты. Такую модификацию метода иммунодиффузии называют «ракетным» иммуноэлектрофорезом. Внешний вид результатов «ракетного» иммуноэлектрофореза показан на рис. 4.4.
В настоящее время во многих лабораториях изотипы иммуноглобулинов определяют нефелометрическим методом. Специфическими реагентами служат моноклональные антиизотипические антитела. Количество иммунных комплексов оценивают на приборе нефелометре. Калибровку и расчет результатов осуществляют с помощью программного обеспечения. АНАЛИЗЫ В основе самых распространенных на сегодня методов иммуноанализов, базирующихся на количественном определении растворимых веществ, лежит взаимодействие антигена с антителом (т.е. иммунологическое распознавание), которое детектируется (визуализуется) с помощью специальной метки, заранее конъюгированной либо с антителом, либо с антигеном. В качестве меток используют вещества, которые при определенных условиях тот или иной прибор может «увидеть» (зарегистрировать) и измерить количество метки. Физико-химическая чувствительность таких анализов обычно составляет нанограммы на миллиметр, но, применяя конкретные тест-системы, нередко выявляют пико- и фемтомоли определяемого вещества. Варианты меток и материалов для твердой фазы Метки 1. Радионуклид используется при радиоиммунном анализе (РИА). 2. Ферменты, катализирующие превращение бесцветного субстрата в цветной или флюоресцирующий продукт. В данном случае исследование называют иммуноферментным анализом (ИФА), его разновидность - анализ иммуноферментно-флюоресцентный. 3. Флюоресцирующие, люминесцирующие вещества и др. В случае РИА результат измеряют на счетчиках радиоактивности в зависимости от того, какие частицы/кванты излучает конкретная метка-радионуклид. Результаты РИА нельзя зарегистрировать без соответствующих приборов. В случае ИФА при образовании цветного продукта результат реакции определяют с помощью спектрофотометра, измеряющего оптическую плотность. Без прибора, на глаз, реакцию можно оценить приблизительно как положительную или отрицательную. При использовании в качестве метки фермента, катализирующего образование флюоресцирующего продукта, результат реакции определяют на флюориметре, измеряющем излучение в определенном диапазоне длин волн. Без прибора в данном случае не обойтись. Впервые методы РИА были разработаны в 1958 г. С. Берсоном и Р. Ялоу. Последняя удостоена в 1977 г. Нобелевской премии за РИА, позволившего впервые в мире определять нанограммовые концентрации пептидных гормонов в крови человека. Менее чем через год после описания РИА в качестве метки стали использовать ферменты с бесцветными субстратами, но окрашенными продуктами. Метод назвали ИФА. По чувствительности и специфичности РИА и ИФА одинаковы, так как их показател
|
||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-10; просмотров: 421; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.41 (0.018 с.) |

 Продолжение табл. 1.1
Продолжение табл. 1.1 Продолжение табл. 1.1
Продолжение табл. 1.1 Окончание табл. 1.1
Окончание табл. 1.1 СВА/J (рис. 1.1, см. также цв. вклейку) и гибриды первого поколения (CBA/J × C57Bl.6)F1 -серо-бурые здоровые выносливые мыши, которые хорошо переносят облучение в кроветворных летальных дозах, и по этой причине их часто используют в радиационных моделях.
СВА/J (рис. 1.1, см. также цв. вклейку) и гибриды первого поколения (CBA/J × C57Bl.6)F1 -серо-бурые здоровые выносливые мыши, которые хорошо переносят облучение в кроветворных летальных дозах, и по этой причине их часто используют в радиационных моделях. Рис. 1.1. Мышь линии СВА/J
Рис. 1.1. Мышь линии СВА/J Рис. 1.2. Мышь линии C57B1/6
Рис. 1.2. Мышь линии C57B1/6 Рис. 1.3. Мышь линии Balb/c
Рис. 1.3. Мышь линии Balb/c Рис. 1.4. Схема получения конгенных линий (Галактионов В.Г., 1986)
Рис. 1.4. Схема получения конгенных линий (Галактионов В.Г., 1986) Рис. 1.5. Мышь линии Scurfy («покрытые перхотью»)
Рис. 1.5. Мышь линии Scurfy («покрытые перхотью») Рис. 1.6. Мышь линии Nude
Рис. 1.6. Мышь линии Nude Рис. 1.7. Мышь линии AKR/J
Рис. 1.7. Мышь линии AKR/J где g - центробежное ускорение; n - число оборотов в минуту; r - радиус от центра оси до границы разделяемых сред.
где g - центробежное ускорение; n - число оборотов в минуту; r - радиус от центра оси до границы разделяемых сред.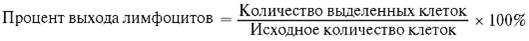 2.3. ВЫДЕЛЕНИЕ МОНОЦИТОВ
2.3. ВЫДЕЛЕНИЕ МОНОЦИТОВ Рис. 2.4. Устройство проточного цитометра
Рис. 2.4. Устройство проточного цитометра где CPM - это число импульсов в минуту соответственно в экспериментальных лунках (СРМn), в лунках со спонтанным высвобождением метки (СРМспонтанно) и в лунках с максимально возможным высвобождением метки (CPMmax).
где CPM - это число импульсов в минуту соответственно в экспериментальных лунках (СРМn), в лунках со спонтанным высвобождением метки (СРМспонтанно) и в лунках с максимально возможным высвобождением метки (CPMmax). Оценка функциональной активности NK-клеток с использованием проточной цитометрии
Оценка функциональной активности NK-клеток с использованием проточной цитометрии Рис. 4.3. Схема иммуноэлектрофореза по Грабару и Уиллиамсу: а - схема установки; б - результаты электрофореза
Рис. 4.3. Схема иммуноэлектрофореза по Грабару и Уиллиамсу: а - схема установки; б - результаты электрофореза Рис. 4.4. «Ракетный» иммуноэлектрофорез: 1 - пациент с агаммаглобулинемией; 2, 3, 4 - калибровочные растворы иммуноглобулинов; 5 - пациент с гипергаммаглобулинемией (возможна миеломная болезнь)
Рис. 4.4. «Ракетный» иммуноэлектрофорез: 1 - пациент с агаммаглобулинемией; 2, 3, 4 - калибровочные растворы иммуноглобулинов; 5 - пациент с гипергаммаглобулинемией (возможна миеломная болезнь)


