
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение факторов транскрипции во внутриядерном содержимом
Процедура получения фракции ядер интересующих клеток может быть следующей. 1. 5х106-2х107 клеток помещают в коническую пробирку объемом 15 мл, дважды отмывают в 10 мл фосфатно-солевого буфера (ФСБ) при 800 g 5-6 мин. 2. Супернатант удаляют и к осадку клеток добавляют гипотонический лизирующий буфер из расчета 0,5 мл буфера на 5х106 клеток. Ex temporo (не ранее, чем за 10 мин до добавления к клеткам) на 0,5 мл гипотонического буфера добавляют 5 мкл ингибиторов фосфатаз, 5 мкл ингибиторов протеаз, 5 мкл DTT (дитиотреитол), 0,5 мкл PMSF. 3. Клетки аккуратно перемешивают в гипотоническом буфере, переносят в чистую пробирку объемом 1,5 мл и оставляют на льду в течение 10 мин. 4. Добавляют 25 мкл на 0,5 мл рабочего материала раствора детергента (0,1% SDS; 1% Triton X-100; 0,1% Tween 20) и перемешивают в течение 5 с. 5. Центрифугируют при 800 g 5-6 мин, 4 °С. 6. Супернатант отделяют (он содержит цитоплазматические белки и может представлять интерес для отдельного анализа), а осадок ядер ресуспендируют в 1 мл полного буфера для отмывки ядер (к буферу добавляют ex temporo 10 мкл ингибиторов фосфатаз, 10 мкл ингибиторов протеаз, 10 мкл раствора DTT, 1 мкл раствора PMSF). 7. Ядра дважды отмывают центрифугированием при 800 g 5-6 мин, 4 °С. 8. Осадок ядер по объему примерно равен 25 мкл. К этому осадку добавляют равный объем специальных экстрагирующих буферов и аккуратно перемешивают в течение 2 с. 9. Смесь инкубируют на льду в течение 30 мин, перемешивая каждые 10 мин. 10. Осветляют ядерный экстракт центрифугированием при 14 000 g 30 мин при 4 °С. 11. Супернатант содержит искомые вещества (факторы транскрипции). Его переносят в чистые охлажденные пробирки. 12. Определяют концентрацию белков по Bredford. Как правило, из 5х106 клеток удается получить 25-100 мкг ядерных белков. 13. Полученные образцы можно морозить при -80 °С в ожидании анализа, но только однократно. Существуют технологии одновременного определения в одном биоматериале нескольких искомых факторов транскрипции (или цитокинов, или киназ и др.). Подобные методы в настоящее время осуществимы главным образом с применением высокотехнологичных коммерческих тест-систем. В качестве примера мы приведем описание процедур для тест-системы «Luminex 100» (Invitrogen. www.invitrogen.com). В данной технологии в качестве твердой фазы для ключевых реагентов используют микрошарики. Оценка результатов возможна только на уникальном приборе (большинство подобных тест-систем - так называемые закрытые, т.е. используют только свои приборы, свои реагенты, свои компьютерные программы).
Факторы транскрипции по своей природе реагируют, т.е. специфически связываются с определенными последовательностями нуклеотидов в двуспиральной ДНК. Поэтому специфическими реагентами на факторы транскрипции являются строго определенные олигонуклеотиды ДНК, меченные биотином. Второй олигонуклеотидный реагент конструируют из двух частей. Первая - последовательность нуклеотидов, комплементарная меченному биотином олигонуклеотиду. В виде двойной спирали они составляют сайт связывания искомого фактора транскрипции. Вторая часть этого олигонуклеотида - «ловушечная» последовательность, комплементарная последовательности нуклеотидов, фиксированной на твердой фазе (микрошариках). Пробы раскапывают в лунки микропланшет, предназначенных для проведения ПЦР, чтобы использовать для инкубаций в качестве термостата термоциклер. Минимальный набор анализируемых образцов включает: • заведомо позитивный контроль; • заведомо негативный контроль; • пробу в виде постороннего белка; • ядерный экстракт из нестимулированных клеток; • ядерный экстракт из одноименных стимулированных клеток. Такой планшет инкубируют в течение 20 мин при 25 °С (можно в ПЦР-термоциклере, который в данном случае используют как удобный динамичный термостат). Затем в лунки с позитивным контрольным реагентом добавляют только буфер, тогда как в остальные лунки вносят буфер с нуклеазой, расщепляющей не связанную с белками ДНК. Инкубируют 20 мин при 37 °С. Только те ДНК-пробы, с которыми связались факторы транскрипции, не расщепляются нуклеазой, так как факторы транскрипции защищают последовательность нуклеотидов от атаки нуклеазы. Таким образом, количество биотиновой метки на молекулах ДНК прямо коррелирует с количеством того или иного фактора транскрипции в биопробе. Стадия гибридизации с твердой фазой: в лунки вносят реагентные микрошарики и инкубируют 45 мин при комнатной температуре под светонепроницаемой крышкой, например, из алюминиевой фольги (рис. 4.14).
На следующей стадии (отмывке) применяют специальные планшеты из фильтрующего материала: содержимое лунок первоначальных планшет переносят в лунки планшет из фильтрующего материала и промывают трижды промывочным буфером с использованием вакуумной аспирации; растворимые компоненты вымываются, микрошарики остаются на дне лунок фильтровальных планшет. Добавляют проявляющий реагент - конъюгат стрептавидина с люминофором, инкубируют 5 мин в темноте (рис. 4.15). Промывают и регистрируют люминесценцию на специальном приборе (например, Luminex 100). Результаты считывают и обрабатывают специальной компьютерной программой (Luminex IS и др.). В каждой биопробе за один цикл анализа, т.е. одновременно, можно количественно определить до 10 факторов транскрипции и более.
Вопросы и задания 1. Дайте определение термина «иммуноанализы». 2. Назовите варианты меток. 3. Назовите технологические варианты иммуноанализов. 4. Что такое «прямые» иммуноанализы? 5. Что такое «непрямые» иммуноанализы? 6. Какие вам известны варианты конструкций тест-систем? 7. Какие ферменты используют в иммуноферментных анализах? 8. Что такое иммунохроматография? 9. Что такое иммуноблот? 10. Дайте определение чувствительности и специфичности тестсистем. 11. Тест-системы с какими чувствительностью и специфичностью (высокой/низкой) следует применять в скрининговых (первичных) обследованиях? 12. Как зависит величина сигнала от концентрации определяемого вещества в биопробе в: а) ловушечном; б) конкурентном; в) ингибиторном; г) «сэндвич»; д) иммунометрическом вариантах иммуноанализов. 13. Нарисуйте схему иммунометрической тест-системы. 14. Что означает вывод о «ложнопозитивном» результате иммуноанализа? 15. Что означает вывод о «ложнонегативном» результате иммуноанализа? 16. Какие варианты регистрирующих приборов применяют в иммуноанализах? 17. Какова в среднем чувствительность иммуноанализов (относительно концентраций определяемых веществ)?
Глава 5 Гибридомная технология. Моноклональные антитела. В конце 60-х - начале 70-х годов XX в. были разработаны лабораторные методы клонирования клеток in vitro. Для этого понадобилось создать питательные среды, материалы для лабораторной посуды и термостаты-инкубаторы, позволившие имитировать условия внутренней среды организма для сохранения жизнеспособности клеток млекопитающих. В течение 10-12 лет удавалось клонировать только опухолевые клетки, поскольку их собственным свойством является способность неограниченно (в благоприятных для них внешних условиях) делиться митозом. Г. Келлер и Ц. Мильштейн в 1974-1975 гг. применили метод получения гибридных соматических клеток, который использовали цитогенетики для изучения локализации генов, контролирующих тот или иной признак в той или иной хромосоме (гибридные клетки выбрасывают большую часть хромосом, но не все), к лимфоцитам, но с иными целями. Г. Келлер и Ц. Мильштейн получили гибридные клетки из лимфоидной опухоли (миелома) и нормального лимфоцита. Гибридные клетки имели часть хромосом (а следовательно, и свойств) нормального лимфоцита (другая часть хромосом выбрасывалась из клеток в течение первых делений, пока геном не стабилизировался) и часть - от опухоли. Размножались только клетки, унаследовавшие от миеломы способность к неограниченному делению. Параллельно в них шел биосинтез тех или иных продуктов нормального лимфоцита, например антител; последние и требовались Г. Келлеру и Ц. Мильштейну. Неограниченно делящиеся клетки «позволяют» себя клонировать, т.е. физически «рассадить» по одной (каждую в отдельную посуду) и получить клоны клеток - потомков одной клетки. Такие клетки назвали гибридомами.
Лимфоциты для гибридизации получают из селезенки или лимфоузлов, предварительно иммунизированных целевым антигеном мышей (чаще всего - линии Balb/c). В качестве опухолевых клетокпартнеров используют специально выведенные для получения гибридом мутантные клетки мышиной миеломы (иногда ее же называют плазмоцитомой, что в данном случае одно и то же), полученные из перевивной линии миеломных клеток МОРС-21 от мышей Balb/c, поддерживаемой в культуре in vitro с 1921 г. Келлер и Мильштейн использовали мутантные миеломные клетки, выведенные цитогенетиками ранее также для получения гибридных клеток млекопитающих, но в иных целях: поскольку гибридные клетки выкидывают большую часть хромосом, по оставшимся цитогенетики устанавливали локализацию тех или иных признаккодирующих генов в конкретных хромосомах. «Мутантность» миеломных клеток необходима для метаболической селекции клеток гибридом от неслившихся с лимфоцитами клеток миеломы. Эта «мутантность» состоит в отсутствии в миеломных клетках действующего гена, кодирующего фермент ГГФРТ. Данный фермент катализирует синтез гуанина (одного из 4 азотистых оснований, входящих в состав ДНК) из гипоксантина. Вскоре после первой публикации Келлера и Мильштейна в распоряжении «гибридомщиков» во всем мире оказались две удобные линии мутантных миелом - P3/X63-Ag8-653 и SP2/0-Ag14, которые быстро пролиферируют и сами не продуцируют никаких частей иммуноглобулинов. Суспензию лимфоидных клеток от иммунных мышей смешивают в одной пробирке в минимальном объеме среды с суспензией миеломных клеток и на 1-2 мин добавляют сливающий агент. У Келлера и Мильштейна сначала этим агентом был, как и у цитогенетиков, вирус Сендай, но через несколько месяцев уже все «гибридомщики» в качестве сливающего агента использовали синтетические полимеры - полиэтиленгликоли с молекулярными массами от 1540 до 6000 D. По прошествии 1-2 мин суспензию клеток, содержащую смесь неслившихся лимфоидных клеток, неслившихся клеток миеломы и гибридных клеток 3 вариантов («лимфоцит-лимфоцит», «миелома-миелома», «лимфоцит-миелома»; из них искомыми клетками являются только гибриды «лимфоцит-миелома»), отмывают и разводят в рассчитанном объеме селективной среды НАТ. НАТ означает «Hypoxanthine-Aminopterin Thymidine». Указанные 3 компонента в известных концентрациях вводят в полную культуральную среду. В течение первых 7-10 дней культивирования названной смеси клеток в культуре происходит следующее:
1) неслившиеся лимфоциты и гибриды «лимфоцит-лимфоцит» погибают в силу своей природной недолговечности; 2) неслившиеся клетки миеломы и гибриды «миелома-миелома» погибают от невозможности осуществлять биосинтез своей ДНК в присутствии аминоптерина - метаболического яда, избирательно блокирующего ферменты биосинтеза пиримидиновых оснований de novo из N5N10-метилен-тетрагидрофолата; биосинтез пуриновых оснований из гипоксантина в этих клетках также невозможен в связи с отсутствием ГГФРТ; 3) единственные клетки, имеющие возможность выжить в среде НАТ, это искомые гибридные клетки «лимфоцит-миелома»: биосинтез пуриновых оснований у них обеспечен ГГФРТ, ген которой получен из нормального лимфоцита, и средовым гипоксантином, а биосинтез пиримидиновых оснований осуществляется из средового тимидина с участием тимидинкиназы. Основные этапы гибридомной технологии показаны на рис. 5.1. От клеток миеломы данные гибридные клетки наследуют свойство неограниченной пролиферации. От нормальных иммунных В-лимфоцитов - биосинтез иммуноглобулинов. Пролиферация «non-stop» позволяет клонировать гибридные клетки, т.е. рассеять по 1 в лунку и подождать, когда из этой одной клетки при благоприятных условиях культивирования вырастет клон, т.е. много одинаковых клеток (с точностью до спонтанных мутаций). Какие из получившихся «лимфоцит-миеломных» гибридных клеток продуцируют заданные антитела, выясняют, отбирая из лунок пробы супернатанта на соответствующий иммуноанализ. В дальнейшем избранные гибридомы неоднократно реклонируют и выводят в массовые культуры - реакторы in vitro или асцитные опухоли у сингенных мышей. Из культуральных супернатантов или асцитных жидкостей выделяют гибридомные моноклональные антитела в очищенном виде. Если клон клеток гибридомы синтезирует антитела, то эти антитела называют моноклональными. Как показал опыт, все клетки клонированной гибридомы синтезируют одинаковые антитела - и по специфичности активного центра, и по изотипу тяжелой цепи, т.е. моноклональные антитела - не только продукт моноклона, но и препарат одинаковых иммуноглобулинов. В конце 1970-х годов научились выращивать in vitro и клонировать Т-лимфоциты, не скрещенные с опухолевой линией клеток. Это стало возможным только после открытия фактора роста Т-лимфоцитов, позже названного ИЛ-2. Именно клонирование Т-лимфоцитов позволило открыть субпопуляции CD4+ Т-лимфоцитов и сделать множество других открытий, в том числе идентифицировать ВИЧ (достаточные для исследования количества генов и белков вируса смогли наработать
только на Т-лимфоцитах, культивируемых in vitro в присутствии факторов роста). В-лимфоциты без превращения их в гибридомы можно заставить делиться (что позволяет их клонировать), если инфицировать их вирусом Эпштейна-Барр (он трансформирует нормальные В-лимфоциты в опухоль из В-лимфоцитов). Таким образом, моноклональные антитела, продуцируемые одним клоном, являются: • высокоспецифичными, направленными к заданной антигенной детерминанте; • идентичными по изотипу, аллотипу и идиотипу, а также по аффинитету и физико-химическим характеристикам. Стабильные культуры гибридом способны продуцировать в неограниченном количестве моноклональные антитела. Моноклональные антитела в настоящее время широко применяют в различных областях медицины. В основе применения монАТ в различных областях лежит возможность получения больших количеств высокоаффинных антител, специфичных по отношению: 1) к иммуногенным антигенам, определяющим гистосовместимость и дифференцировку; 2) дифференцировочным, опухолевым и другим антигенам клеточной поверхности, которые лишены полиморфизма и неиммуногенны в аллогенных системах, но распознаются при ксеногенной иммунизации; 3) вирусным и бактериальным антигенам; 4) единичным антигенным детерминантам разнообразных белков, нуклеиновых кислот и сахаров. Применение монАТ позволяет определять и разделять субпопуляции клеток, различать отдельные стадии развития клеток, более точно типировать ткани, более точно идентифицировать микроорганизмы, а также более надежно определять иммунологическими методами биологически важные макромолекулы. В медицине на основе монАТ разработано большое количество систем диагностирования различных заболеваний (инфекционных, онкологических и др.). Активно разрабатываются и лекарственные препараты на основе монАТ, например противоопухолевые препараты, антицитокиновые антитела (препарат ремикейт и др.) Однако было показано, что применение мышиных монАТ для иммунотерапии опухолевых заболеваний приводит к появлению различных побочных эффектов и отличается слабой эффективностью действия. Модификация мышиных монАТ (гуманизированные антитела и различные конъюгаты монАТ - с радионуклидами, лекарствами, токсинами и пр.) открывает новые возможности в диагностике и лечении опухолевых и других заболеваний.
Глава 6. Генетическая методы исследования в иммунологии. ПОЛИМЕРАЗНАЯ ЦЕПНАЯ РЕАКЦИЯ Полимеразная цепная реакция (ПЦР) - экспериментальный метод молекулярной биологии, который представляет собой специфическую амплификацию нуклеиновых кислот, индуцируемую синтетическими олигонуклеотидными праймерами in vitro. Идея разработки метода ПЦР принадлежит американскому исследователю Kary Mullis, который в 1983 г. создал метод, позволивший амплифицировать ДНК в ходе циклических удвоений с помощью фермента ДНК-полимеразы в искусственных условиях. Через несколько лет после опубликования этой идеи, в 1993 г., К. Mullis получил за нее Нобелевскую премию. В начале использования метода после каждого цикла нагревания- охлаждения приходилось добавлять в реакционную смесь ДНК-полимеразу, так как она быстро инактивировалась при высокой температуре. Процедура была очень неэффективной, требовала много времени и фермента. В 1986 г. ее существенно модифицировали за счет использования ДНК-полимеразы из термофильных бактерий. Эти ферменты способны выдерживать множество циклов реакции, что позволяет автоматизировать проведение ПЦР. Одна из наиболее часто использовавшихся термостабильных ДНК-полимераз была выделена из бактерий Thermus aquaticus и названа Taq -ДНК-полимеразой. Суть метода. Метод основан на многократном избирательном копировании определенного участка ДНК при помощи фермента Taq- ДНК-полимеразы. Полимеразная цепная реакция позволяет получить амплификаты длиной до нескольких тысяч пар нуклеотидов. Для увеличения длины ПЦР-продукта до 20-40 тыс. пар нуклеотидов применяют смесь различных полимераз, но все равно это значительно меньше длины хромосомной ДНК эукаротической клетки. Реакция проводится в программируемом термостате (амплификаторе) - приборе, который может проводить достаточно быстро охлаждение и нагревание пробирок (обычно с точностью не менее 0,1 °С). Амплификаторы позволяют задавать сложные программы, в том числе с возможностью «горячего старта» и последующего хранения. Для ПЦР в режиме реального времени выпускают приборы, оборудованные флуоресцентным детектором. Существуют также приборы с автоматической крышкой и отделением для микропланшет, что позволяет встраивать их в автоматизированные системы. Обычно при проведении ПЦР выполняется 20-45 циклов, каждый из которых состоит из трех стадий: денатурации, отжига праймеров, элонгации (рис. 6.1 и 6.2). На рис. 6.1 представлена динамика изменения температуры в пробирке при проведении цикла ПЦР.
Денатурация ДНК-матрицы проводится с помощью нагревания реакционной смеси до 94-96 °С на 5-90 с, чтобы цепи ДНК разошлись. Следует отметить, что перед первым циклом осуществляют предварительный прогрев реакционной смеси в течение 2-5 мин для полной денатурации исходной матрицы, что позволяет снизить количество неспецифичных продуктов реакции.
Стадия отжига праймеров. При плавном снижении температуры праймеры комплементарно связываются с матрицей. Температура отжига зависит от состава праймеров и обычно она на 4-5° ниже расчетной температуры плавления. Длительность стадии - 5-60 с. Во время следующей стадии - элонгации - происходит синтез дочерней цепи ДНК на матрице материнской. Температура элонгации зависит от полимеразы. Часто используемые ДНК-полимеразы Taq и Pfu наиболее активны при 72 °С. Время элонгации, в основном зависящее от длины ПЦР-продукта, обычно составляет 1 мин на каждую тысячу пар оснований. После проведения ПЦР проба инкубируется при температуре 72 °С в течение 10 мин. Количество специфического продукта реакции (ограниченного праймерами) при 100% эффективности теоретически возрастает в геометрической прогрессии по формуле Р = 2n, где Р - количество специфического продукта, а η - число циклов реакции. Практически эффективность ПЦР меньше 100%, поэтому в действительности P = (1 + E)n, где P - количество продукта; Е - средняя эффективность цикла; а n - число циклов реакции. При большем, чем указано, количестве циклов реакции происходит накопление неспецифических продуктов последней. Рост требуемого продукта в геометрической прогрессии ограничен числом реагентов, присутствием ингибиторов и побочных продуктов реакции. На последних циклах рост замедляется, это называют «эффектом плато» (рис. 6.3). Кинетика ПЦР имеет экспоненциальный характер только на начальном этапе, после чего начинается выход на плато в силу истощений в реакции компонентов (dNTP, праймеров) и нарастающего температурного повреждения Таq-ДНК-полимеразы, конкуренции за фермент амплификонов. Компоненты полимеразной цепной реакции. Компоненты, используемые в ПЦР, следующие: Taq-ДНК-полимераза, дезоксирибонуклеотидтрифосфаты, буферный раствор, «прямой» и «обратный» праймеры, а также ДНК-матрица. Фермент Taq-ДНК-полимераза. При оптимальных условиях в реакционной смеси ПЦР (50-100 мкл) фермент содержится в количестве 0,5-2 единиц на пробу. Taq-ДНК-полимераза синтезирует цепь ДНК до 1000 пар оснований в минуту. Увеличивая время полимеризации и подбирая новые разновидности ДНК-полимеразы, обладающие и экзонуклеазной (редактирующей) активностью, вырезающей ошибочные (некомплементарные) нуклеотиды, удалось получить очень длинные амплифицированные ДНК - до 42 тыс. пар оснований (Лонг-ПЦР). Избыток Таq-ДНК-полимеразы увеличивает образование неспецифических продуктов ПЦР.
dNTP. Дезоксирибонуклеотидтрифосфаты (dNTP), используемые в ПЦР, следующие: dATP, dGTP, gTTP, dCTP. dNTP содержатся в реакционной смеси в эквивалентных концентрациях от 200 до 500 мкм, так как избыток какого-либо из них увеличивает ложное спаривание нуклеотидов в ПЦР. Праймеры. Специфичность ПЦР основана на образовании комплементарных комплексов между матрицей и праймерами, каждый из последних комплементарен одной из цепей двухцепочечной матрицы, обрамляет начало и конец амплифицируемого участка (рис. 6.4). Поскольку праймеры каждый раз встраиваются в амплифицируемые фрагменты ДНК-матрицы (амплификоны), то они должны в реакционной смеси ПЦР присутствовать в избытке, и концентрация их составляет 0,5-1 мкМ. Специфичность получаемого продукта ПЦР в значительной степени определяется так называемой температурой отжига праймеров, при которой они взаимодействуют с комплементарными участками ДНК-матрицы, образуя двухцепочечные структуры.
Буферная система. 10-кратный буфер для ПЦР чаще всего имеет состав: 0,5 М KCl; 0,2 М Трис-HCl, pH 8,4; 25 мМ MgCl2; 1 мг/мл бычьего сывороточного альбумина (БСА) - пример стандартной прописи буферной системы. Tris Cl. Высокое значение рН нужно из-за того, что при повышении температуры рН Tris-буфера падает и при 72 °С составляет ~7,5. KCl. Средние концентрации KCl стимулируют на 40-60% активность Taq-ДНК-полимеразы (но 0,2 M полностью ингибирует полимеразную активность). MgCl2. Диапазон рабочих концентраций: 0,5-5 мМ. Увеличение концентрации Mg2+ оказывает очень резкое влияние на специфичность и эффективность ПЦР: увеличивается выход, но более высокими темпами уменьшается специфичность. Оптимум зависит от последовательностей матрицы и праймеров. Таким образом, слишком низкая концентрация Mg2+ - низкий выход, слишком высокая - неспецифическая амплификация. На молекулярном уровне: Mg2+ образует комплексы с dNTP's. Именно эти комплексы являются субстратом для Taq-ДНК- полимеразы. C Mg2+ стехиометрически связываются dNTP's, PPi, EDTA, PO4. Повышение концентрации Mg2+ вызывает повышение температуры плавления ДНК. В полимеразной цепной реакции используется вода высокой очистки (MQ). В зависимости от конструкции прибора (если «крышка» амплификатора не нагревается) в реакцию бывает необходимым на ПЦР-смесь наслаивать стерильное минеральное масло для предотвращения испарения пробы. ДНК-матрица. Общее количество ДНК, вносимой в пробирку для ПЦР, не должно превышать 1 мкг, ибо большой избыток неспецифической ДНК снижает специфичность и чувствительность ПЦРамплификации ДНК-матрицы. Подготовка пробы материала (выделение ДНК или РНК) должна проводиться в условиях, исключающих перекрестное загрязнение исследуемых проб выделяемыми нуклеиновыми кислотами. Чтобы ПЦР прошла успешно, должна произойти гибридизация праймеров с нужной последовательностью-мишенью. Если эта последовательность слегка различается у разных индивидуумов или у микроорганизмов из разных изолятов (т.е. имеет место полиморфизм), может произойти ее неполное спаривание с амплимером и нарушение нормальной амплификации, что приведет к получению ложноотрицательного результата. Следует отметить: у человека большая часть геномных последовательностей консервативна и не различается у разных индивидуумов, а потому обычно в таких случаях для работы подходят одинаковые наборы «консервативных» праймеров. Контаминация. Для исключения ложноположительного результата необходимо обязательное использование чистых перчаток, одноразовых пробирок и наконечников к автоматическим пипеткам, проведение предварительной ультрафиолетовой обработки помещения и рабочих поверхностей столов и приборов. Подчеркнем: ДНКматрицы генов клеток, вирусов и бактерий пригодны для ПЦР в течение десятков лет даже после замораживания, высушивания, температурной или химической денатурации белков и др. Чувствительность ПЦР порой достигает математически возможного предела (детекции 1 копии ДНК-матрицы), поэтому существует высокая степень опасности получения ложноположительного результата в силу переноса через предметы и реагенты как самой ДНКматрицы (реже), так и амплификонов (очень часто), получаемых в больших количествах во многих пробирках в течение ежедневной работы. Причинами ложноположительных результатов являются следующие 3 вида контаминаций. 1. Контаминация от пробы к пробе (в процессе обработки клинических образцов или при раскапывании реакционной смеси), приводящая к появлению спорадических ложноположительных результатов. 2. Контаминация рекомбинантными плазмидами, содержащими клонированные последовательности детектируемого гена. 3. Контаминация продуктами амплификации (амплификонами). Она - наиболее частая причина ложноположительных результатов, поскольку в процессе ПЦР-генодиагностики амплификоны накапливаются в больших количествах и очень легко переносятся с аэрозолями и через приборы. Поэтому детекция продуктов ПЦР должна проводиться в изолированной комнате сотрудником, не производящим обработку клинических образцов и не готовящим реактивы для ПЦР. Приготовление основных растворов также должно производиться в отдельной чистой комнате. Все растворы следует хранить и использовать небольшими порциями. Необходимо постоянно осуществлять собственные виды лабораторного контроля и периодически применять зашифрованные отрицательные и положительные контрольные образцы для оценки специфичности и чувствительности ПЦР-генодиагностических исследований. Неуклонно выполняя эти требования и выполняя в каждой ПЦР отрицательный контроль разных типов (на процедуру обратной транскрипции, буферный раствор, праймеры), можно практически исключить ложноположительные результаты ПЦР. Очень важен для правильной интерпретации результатов выбор способов контроля. Положительный и отрицательный контроль должен быть хорошо охарактеризован. Часто используют ДНК из клеточных линий, заведомо содержащих или не содержащих последовательность-мишень. В каждом анализе нужны как минимум три вида контроля: 1) положительный контроль (образец заведомо содержит последовательность-мишень); 2) отрицательный контроль (образец заведомо не содержит последовательность-мишень); 3) бланк-контроль (реакционная смесь, в которой присутствуют все компоненты за исключением ДНК; бланк-контроль является индикатором загрязнений). Один тип положительного контроля должен содержать максимальное число последовательностей-мишеней, другой - небольшое их число. Это позволяет определить чувствительность и эффективность ПЦР. Детекция. Для анализа ПЦР-амплифицированной ДНК существуют разные методы: гель-электрофорез, дот-блот-гибридизацию и блот-гибридизацию по Саузерну. С их помощью можно анализировать большинство ПЦР-продуктов, но абсолютно точные результаты получают только при секвенировании. Следует отметить: в дальнейших главах будет описана модификация ПЦР - полимеразная цепная реакция в режиме реального времени, в которой детекция возрастания количества ПЦР-продуктов осуществляется непосредственно в пробирке при прохождении реакции (см. ниже).
Присутствие специфического ПЦР-продукта (амплификона) в подавляющем большинстве случаев детектируют электрофоретическим разделением ПЦР-амплификационной смеси на окрашенных бромистым этидием агарозном или полиакриламидном гелях. Для такого выявления необходимо не менее 20 нг ДНК. Специфичность полосы амплифицированной ДНК подтверждается ее положением (размерами) по отношению к маркерным фрагментам и ДНКстандарту. Дополнительные доказательства специфичности амплификона получают путем расщепления специфическими рестриктазными ферментами или путем гибридизации со специфическим радиоактивным или флуоресцентным олигонуклеотидным зондом.
Электрофорез в агарозном геле позволяет легко, без применения радиоизотопов, обнаружить амплифицированную ДНК и определить ее размер (рис. 6.5 и 6.6). Остановимся на некоторых ее особенностях применительно к анализу ПЦР-амплифицированной ДНК: а) 10-20 мкл амплифицированной ДНК разделяют в 2% агарозном геле вместе со стандартными фрагментами размером 50-1000 пар нуклеотидов; б) электрофорез проводят при высоком напряжении (10-15 В/см), поскольку образующиеся при ПЦР небольшие фрагменты сложно детектировать после электрофореза в течение ночи при небольшом напряжении вследствие их интенсивной диффузии. Разрешение можно повысить, используя полиакриламидные или агарозные гели с высокой концентрацией агарозы (3-4%). Впрочем, если анализ нужно провести быстро и с небольшими затратами, вполне приемлемы 2% агарозные гели. Обычно при амплификации ДНК, выделенной из фиксированных тканей, выход ПЦР-продуктов ниже, и они менее специфичны, чем в случае амплификации высокоочищенной ДНК. Метод гибридизации ПЦР-амплифицированной ДНК (по Саузер- ну) позволяет идентифицировать полосы в геле, наблюдаемые после электрофореза амплифицированной ДНК. Для гибридизации используются как изотопно, так и неизотопно меченые зонды. Дот-блот-гибридизация дает простой ответ по типу «да-нет» и особенно полезна в тех случаях, когда проводится анализ большого числа образцов. Прямое секвенирование амплифицированной ДНК - также высоконадежный метод доказательства ее специфичности, но применяется в основном для определения точечных мутаций генов. В последние годы для детекции и одновременно количественной оценки амплифицированной ДНК все больше начинают применять гибридизационно-ферментный метод на микропланшетах. Но существуют и другие варианты: используются олигонуклеотидный зонд, его метят дигоксигенином или флуоресцеином с последующим проявлением моноклональными антителами к дигоксигенину или флуоресцеину; меченные ферментами моноклональные антитела к двухцепочечной ДНК; зонд, меченный рутением (электрохемилюминесцентный метод). Весьма перспективна для количественных детекций амплификонов на гель-электрофореграммах миниатюрная видеокамера, передающая на экран монитора интенсивность флуоресценции полос ДНК-амплификонов, что позволяет одновременно получить соотношение полос ДНК-стандарта и ДНК-амплификонов исследуемого гена. Результат ПЦР можно квалифицировать как положительный или отрицательный в зависимости от того, обнаружена в образце интересующая вас последовательность-мишень или нет. Однако нарушение нормального хода амплификации, недостаточная чувствительность метода и непредвиденный полиморфизм последовательности-мишени в области связывания праймеров или гибридизационного зонда порой обусловливают ложноотрицательный результат. При загрязнении образцов и случайной гомологии между зондом, праймерами и последовательностью, сходной с мишенью, получаются ложноположительные результаты. Модификации. В последние годы широко используется такой простой прием, как «горячий старт ПЦР», который заключается в предварительном прогревании пробирок с ПЦР-амплификационной смесью при температуре 95 °С в течение 3-5 мин. Такой прием предупреждает амплификацию неспецифических ДНК-фрагментов вследствие низкотемпературного, неспецифического спаривания праймеров. При использовании РНК в качестве матриц для ПЦР предварительно на этой РНК-матрице посредством фермента РНК-зависимой ДНК-полимеразы (обратная транскриптаза, ревертаза) синтезируют комплементарную ДНК (кДНК), затем использующуюся в качестве матрицы в ПЦР. ПЦР с обратной транскриптазой (ОТ-ПЦР) широко применяется для детекции РНК вирусов, определения экспрессии вирусных, бактериальных и клеточных генов по их РНК. Существуют различные модификации ПЦР, использующиеся в зависимости от конкретных целей проведения реакции или от характера последующего молекулярного анализа амплификатов. Так, для трудноамплифицируемых участков ДНК (содержащих различные повторяющиеся последовательности или необычные структурные элементы), а также в тех случаях, когда матричная ДНК присутствует в следовых количествах, ПЦР проводят в два этапа, используя в качестве матричной ДНК на втором этапе амплификации продукты ПЦР, синтезированные на первом этапе. Часто в этих случаях для повышения специфичности посадки праймеров применяют систему так называемых вмонтированных праймеров, т. е. при доамплификации в качестве праймеров выбирают последовательности, локализованные внутри амплифицированного на первом этапе участка ДНК.
|
||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-10; просмотров: 147; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.42.168 (0.079 с.) |
 Рис. 4.14. Связывание с твердой фазой (шариками)
Рис. 4.14. Связывание с твердой фазой (шариками) Рис. 4.15. Проявка
Рис. 4.15. Проявка Рис. 5.1. Основные этапы получения гибридом
Рис. 5.1. Основные этапы получения гибридом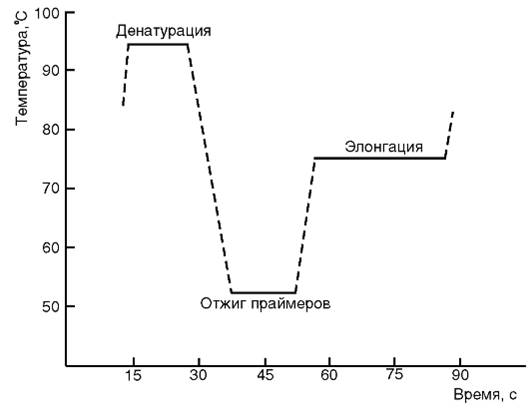 Рис. 6.1. График изменения температуры в пробирке в течение одного цикла полимеразной цепной реакции
Рис. 6.1. График изменения температуры в пробирке в течение одного цикла полимеразной цепной реакции Рис. 6.2. Схема первого цикла полимеразной цепной реакции
Рис. 6.2. Схема первого цикла полимеразной цепной реакции Рис. 6.3. Динамика накопления продукта при полимеразной цепной реакции
Рис. 6.3. Динамика накопления продукта при полимеразной цепной реакции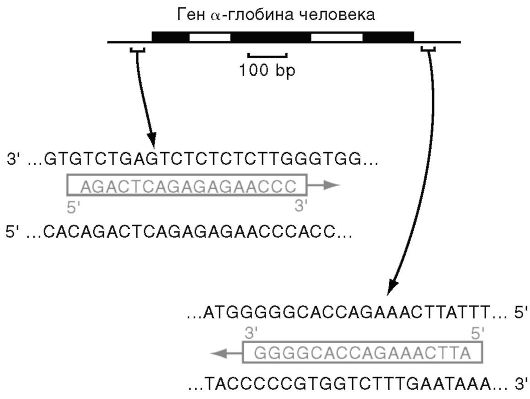 Рис. 6.4. Пример «прямого» и «обратного» праймеров
Рис. 6.4. Пример «прямого» и «обратного» праймеров Рис. 6.5. Фотография электрофоретического геля с ПЦР-продуктами
Рис. 6.5. Фотография электрофоретического геля с ПЦР-продуктами Рис. 6.6. Устройство горизонтальной электрофоретической камеры
Рис. 6.6. Устройство горизонтальной электрофоретической камеры


