
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Неравновесные диаграммы состоянийСодержание книги Поиск на нашем сайте
По определению диаграмма состояния представляет собой набор равновесных состояний сплава, а линии на ней показывают условия равновесных превращений (температуру и концентрацию), при которых равны значения свободной энергии преобразующихся фаз.
На представленной схеме для нонвариантных систем (рис. 16а) T0 – теоретическая равновесная температура при бесконечно малой скорости нагрева или охлаждения. К таким превращениям относятся агрегатные и полиморфные превращения в чистых (однокомпонентных) веществах. Как видно, реальное превращение протекает не при фиксированной температуре, а в некотором интервале температур. Величина этого интервала растет с увеличением скорости нагрева или охлаждения.
Интервал T0’’–T0’ (рис. 16 б) ограничивает диапазон температур, в котором происходит фазовый переход системы, имеющей степень (степени) свободы (примером может служить превращение жидких и твердых растворов). В этом случае температурный интервал превращения расширяется. В любом случае величина перегрева или переохлаждения (разность между равновесной и неравновесной температурами превращения) как правило увеличивается с увеличением скорости изменения температуры, причем система обладает большей склонностью к переохлаждению, чем к переохлаждению. Таким образом, диаграмма состояний представляет собой набор равновесных состояний без учета процессов перегревания и переохлаждения. Однако эта абстрактная модель необходима для описания реальных процессов и условий плавления, кристаллизации и т.д., степень применимости которой растет с уменьшением скорости изменения температуры. При больших же скоростях помимо температуры превращения происходит изменение и его условий, так как сопутствующие процессы (например, диффузионные), не успевают произойти. В этом случае диаграмма состояний уже неприменима и может восприниматься как ориентир для исследования. Для примера рассмотрим процесс равновесной кристаллизации, в результате которой состав жидкости и выпадающих в ней кристаллов меняется равномерно согласно линиям ликвидуса и солидуса. Она реализуется таким образом, что с целью выравнивания состава в жидкой и твердой фазе должна происходить диффузия, причем с одинаковой скоростью. Однако
Примером описанного сплава может служить сталь, в которой образуются древовидные кристаллы – дендриты. В большинстве случаев ранее образующиеся кристаллы при охлаждении твердых растворов обладают более высоким содержанием компонента, имеющего бóльшую температуру плавления. Как следствие, области пространства, закристаллизовавшиеся последними, содержат большее количество легкоплавкого компонента и при этом сами являются легкоплавкими. Подобное явление носит название дендритной ликвации. Образующийся неравновесный твердый раствор по сравнению с однородным обладает более высоким уровнем свободной энергии. Полученное состояние также является неравновесным и может быть устранено длительным нагревом (отжигом и т.п.), при котором выравнивается концентрация компонентов во всех кристаллах (рис. 18).

Схема на рис. 17 описывает относительно невысокие скорости охлаждения (порядка 1-60 °С/мин), вследствие чего можно говорить о большей величине переохлаждения сплава в конце процесса кристаллизации по сравнению с его началом. Значительно бóльшие скорости (103–106 °С/с) достигаются при распылении металлов и сплавов в жидком состоянии с целью получения их в виде порошка. Следствием чего является значительное переохлаждение и образование однородного сильно пересыщенного раствора с менее развитой дендритной структурой (рис. 19).
Таким образом, при закалке из жидкого состояния можно выделить два критических значения скорости охлаждения: при скоростях ниже первого создаются условия, когда составы жидкого и твердого раствора одинаковы (без образования избыточной фазы), выше второго происходит образование аморфного состояния. В случае, когда скорость охлаждения лежит между критическими значениями, избыточная фаза выделяется, но с дисперсной структурой. Вследствие того, что данный способ обработки позволяет получать материалы с широким разнообразием структур и, соответственно, свойств, его часто используют в практических целях. Частным случаем описанной ситуации является неравновесная кристаллизация твердого раствора. Рост скорости охлаждения вызывает необходимость введения поправок в диаграмму состояний, показывающую только протекание процесса распада твердого раствора при очень медленном охлаждении (рис. 20). Это приводит к тому, что температура начала выделения избыточной фазы уменьшается (на рисунке точка 1 смещается вниз, переходя в точку 1’, та в свою очередь 1’’ и т.д.). При еще более высокой скорости охлаждения твердый раствор просто полностью переохлаждается до комнатной температуры. В итоге регуляция скорости охлаждения делает возможным контроль и полное подавление процесса распада.
Процесс фиксации нестабильного состояния посредством быстрого охлаждения получил название закалки, в то время процесс выравнивания состава относительного равновесного состояния – отпуск или старение. Разнообразие структур и, как следствие, свойств привели к их широкому распространению в металлургической промышленности. Они являются важной частью термической обработки, основанной на неравновесной кристаллизации.
1.5. Рекомендуемая литература 1. Берг Г. Г. Введение в термографию. — Изд. 2-е, доп. — М.: Наука, 1969. — 396 с. 2. Тейтельбаум Б.Я. Термомеханический анализ полимеров. М.: Наука, 1979. – 236 с. 3. Уэндландт У. Термические методы анализа / Пер. с англ. под ред. В. А. Степанова и В. А. Берштейна. — М.: Мир, 1978. — 526 с. 4. Шестак Я. Теория термического анализа: Физико-химические свойства твёрдых неорганических веществ / Пер. с англ. — М.: Мир, 1987. — 456 с. 5. Альмяшев В. И., Гусаров В. В. Термические методы анализа. Учебное пособие. С.-Пб. – 1999 6. Термогравиметрия: Учебное пособие для студентов 3 курсап химического факультета / Перм. ун-т; сост. доц. В.С.Корзанов, ст. преп. М.Г.Котомцева, студ. 5-го курса Р.И.Юнусов; Пермь, 2007. – 71 с. [1] Первое знакомство с диаграммой состояния однокомпонентного вещества такого вида обычно происходит при изучении раздела «молекулярная физика» курса общей физики. [2] Мерность m точки равна 0 (нульмерный объект), мерность линии равна 1 (одномерный объект), мерность плоскости равна 2 (двумерный объект).
|
||||||||||||||
|
Последнее изменение этой страницы: 2017-02-10; просмотров: 369; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.139.80.194 (0.01 с.) |


 в реальных процессах скорость твердофазной диффузии меньше. Обратимся к рис. 17, с помощью которого рассмотрим сплав 1-2. Согласно диаграмме состояний при охлаждении изменение состава кристаллической фазы описывается линией a-c (солидус). Однако замедление процесса диффузии вносит существенные коррективы в диаграмму (линия a-c’). При температуре теоретического окончания кристаллизации t’ остается некоторое количество жидкой фазы (описывается отрезком сс’), а жидкость (состав характеризуется точкой f) продолжает охлаждаться, обогащаясь компонентом B. По достижении эвтектической температуры состав жидкости будет соответствовать точке E. В целом же кристаллы не будут однородными, так как оставшаяся жидкость (отрезок e’d) затвердеет с образованием эвтектики. Как следствие реальная структура рассматриваемого сплава существенно отличается от равновесной, определяемой диаграммой состояний, и состоит из эвтектики и неоднородного твердого раствора. В случае совпадения точек e’ и d эвтектика будет отсутствовать и в целом ее наличие будет необязательным.
в реальных процессах скорость твердофазной диффузии меньше. Обратимся к рис. 17, с помощью которого рассмотрим сплав 1-2. Согласно диаграмме состояний при охлаждении изменение состава кристаллической фазы описывается линией a-c (солидус). Однако замедление процесса диффузии вносит существенные коррективы в диаграмму (линия a-c’). При температуре теоретического окончания кристаллизации t’ остается некоторое количество жидкой фазы (описывается отрезком сс’), а жидкость (состав характеризуется точкой f) продолжает охлаждаться, обогащаясь компонентом B. По достижении эвтектической температуры состав жидкости будет соответствовать точке E. В целом же кристаллы не будут однородными, так как оставшаяся жидкость (отрезок e’d) затвердеет с образованием эвтектики. Как следствие реальная структура рассматриваемого сплава существенно отличается от равновесной, определяемой диаграммой состояний, и состоит из эвтектики и неоднородного твердого раствора. В случае совпадения точек e’ и d эвтектика будет отсутствовать и в целом ее наличие будет необязательным.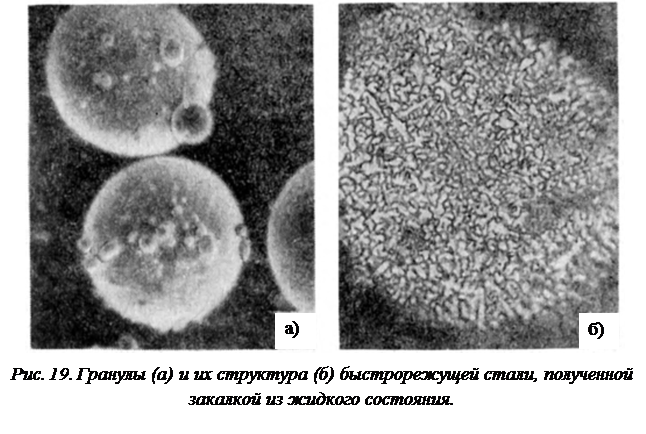
 Побочные фазы, образующиеся в результате описываемых процессов при высокой температуре, составляют не только более крупные по сравнению с маточной фазой области, но и не связаны с ней ориентационно. Низкотемпературная новая β-фаза ориентирована относительно исходной так, что пограничный слой атомов принадлежит обеим структурам, тем самым создавая когерентное соединение решеток. Такая связь при повышении температуры становится неустойчивой благодаря увеличению подвижности атомов, в результате чего метастабильные фазы переходят в стабильную β-фазу, кристаллы которой растут и приобретают округлую форму. Полное протекание этих процессов приводит к образованию тех же структуры и фазового состава, что и при медленном охлаждении (описываемому диаграммой состояния).
Побочные фазы, образующиеся в результате описываемых процессов при высокой температуре, составляют не только более крупные по сравнению с маточной фазой области, но и не связаны с ней ориентационно. Низкотемпературная новая β-фаза ориентирована относительно исходной так, что пограничный слой атомов принадлежит обеим структурам, тем самым создавая когерентное соединение решеток. Такая связь при повышении температуры становится неустойчивой благодаря увеличению подвижности атомов, в результате чего метастабильные фазы переходят в стабильную β-фазу, кристаллы которой растут и приобретают округлую форму. Полное протекание этих процессов приводит к образованию тех же структуры и фазового состава, что и при медленном охлаждении (описываемому диаграммой состояния).



