
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Построение диаграмм состоянийСодержание книги Поиск на нашем сайте Диаграммы состояния Диаграмма состояния представляет собой графическое изображение зависимости фазового состояния сплава от термодинамических параметров. Обычно на диаграммах изображают только термодинамически равновесные (устойчивые) состояния, поэтому их часто называют диаграммами равновесия. Фазой в термодинамике называют совокупность однородных частей системы, отделенных от других частей системы поверхностью раздела, при переходе через которую химический состав или структура вещества изменяются скачком. Однородная жидкость является однофазной системой. Различными фазами в чистом металле являются разные агрегатные состояния или разные кристаллические модификации в случае полиморфизма. Совокупность зерен чистого твердого металла представляет собой одну фазу. Сплав определенного состава, в отличие от чистого металла, может быть как однофазным, так и многофазным. Общие закономерности сосуществования устойчивых фаз определяются правилом фаз Гиббса, которое дает количественную зависимость между степенью свободы системы и количеством фаз и компонентов. Под числом степеней свободы (вариантностью) системы понимают число внешних и внутренних факторов (температура, давление и концентрация), которое можно изменять без изменения числа фаз в системе. Если число степеней свободы равно нулю (нонвариантная система), то нельзя изменять внешние и внутренние факторы системы (температуру, давление и концентрацию) без того, чтобы это не вызвало изменения числа фаз. Если число степеней свободы равно единице (моновариантная система), то возможно изменение в некоторых пределах одного из перечисленных факторов, и это не вызовет уменьшения или увеличения числа фаз. Математическое выражение правила фаз имеет вид:
где с – число степеней свободы системы, k – число компонентов, f – число фаз, n – число внешних термодинамических параметров. Если система не находится во внешних физических полях, то n = 2. Чаще всего в качестве внешних термодинамических параметров рассматривают температуру и давление. Уравнение правила фаз можно вывести на основании следующих соображений. Предположим, что мы имеем систему из k компонентов, образующих f фаз, и система находится в равновесии. Для системы, находящейся в равновесии, термодинамический потенциал каждого компонента (химический потенциал) μ во всех фазах одинаков. В противном случае происходило бы превращение фазы с компонентом, имеющим более высокий термодинамический потенциал. Предположим, что система состоит из k компонент и f фаз. Если система находится в равновесии, то химические потенциалы каждого из компонентов во всех фазах равны между собой, то есть:
………….................
В этих уравнениях верхняя цифра – номер компонента, нижняя – номер фазы. В каждой строчке имеется Так как всего имеем f фаз, то количество переменных по концентрации, температуре и давлению будет равно Число степеней свободы
или
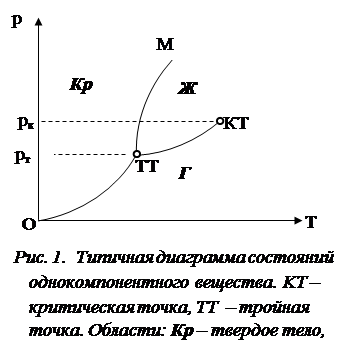
Однокомпонентные вещества Диаграмма состояния однокомпонентного вещества обычно строится в координатах давление – температура (р–T – диаграмма: рис. 1). Каждая точка на диаграмме соответствует определенному сочетанию термодинамических параметров, их называют конфигурационными точками. Для однокомпонентного вещества k = 1 и правило фаз (2) принимает вид
Если в системе есть две фазы, то число степеней свободы равно 1. Это значит, что изменению одного из параметров (давления или температуры) обязательно приведет к изменению второго параметра (температуры или давления соответственно). При заданной температуре термодинамическое равновесие между двумя фазами одного и того же вещества возможно лишь при определенном значении давления в системе. Зависимость равновесного давления от температуры на диаграмме изображается линией, называемой кривой фазового равновесия. Если рассматриваемое вещество может существовать лишь в трех агрегатных состояниях, то возможны три двухфазных состояния: газ – жидкость, жидкость – твердое тело, твердое тело – газ. Три кривые двухфазных равновесий разбивают плоскость р–T – диаграммы на три отдельные области, в которых вещество существует в однородном агрегатном состоянии – твердом, жидком или газообразном (рис. 1)[1]. Кривая O–ТТ, соответствующая равновесию между твердой и газообразной фазами, называется кривой сублимации. Кривая ТТ–TK равновесия между жидкостью и газом называется кривой испарения, она обрывается в критической точке KТ. Кривая TТ–M равновесия между твердым телом и жидкостью называется кривой плавления. Кривые равновесия сходятся в точке ТT, в которой могут сосуществовать в равновесии все три фазы. Эта точка называется тройной точкой. При наличии трех фаз число степеней свободы равно нулю, так что это состояние возможно лишь при единственном сочетании значений давления и температуры Как уже было сказано, многие металлы обладают полиморфизмом, т.е. существуют в различных кристаллических модификациях в разных термодинамических условиях. Каждая кристаллическая модификация данного вещества является самостоятельной фазой. Тогда общее число реализуемых фаз в системе будет больше трех, но при f > 3 число степеней свободы становится отрицательным, что невозможно. Следовательно, согласно правилу фаз, сколько бы кристаллических модификаций не имел данный металл, но каждая из них может находиться в равновесии не более чем с двумя другими фазами. Поэтому на диаграмме состояний может быть несколько тройных точек, но не может быть ни одной четверной или пятерной. Таким образом, на диаграмме состояний однокомпонентной системы (чистого металла) три вида геометрических объектов: точки, определяющие значения температур и давлений, при которых могут сосуществовать в равновесии три фазы; линии, соответствующие двухфазным состояниям; области однофазных состояний. При этом выполняется правило: сумма мерности [2] геометрического объекта на диаграмме состояний и соответствующего этому объекту числа равновесных фаз равна постоянному числу, в данном случае трем. В дальнейшем можно будет убедиться, что для всех диаграмм состояний справедливо более общее правило: сумма мерности m геометрического объекта на диаграмме состояний и соответствующего этому объекту числа равновесных фаз f есть величина постоянная, равна сумме числа компонентов и числа независимых термодинамических параметров:
Большинство технологических процессов получения и обработки металлических материалов, в том числе металлургические процессы, протекают при атмосферном давлении. Изменение этого давления происходит в относительно узком интервале значений, и оно практически не сказывается на фазовом состоянии и свойствах материалов. Это позволяет считать, что все превращения происходят при постоянном давлении. Тогда число термодинамических переменных уменьшится на единицу, и уравнение правила фаз примет вид:
На рис. 2 представлена та же диаграмма, что и на предыдущем рисунке, но оси координат поменялись местами. Здесь проведены три вертикальные прямые линии – изобары. Изобара при давлении р2 пересекает кривые плавления и испарения при температурах Тпл и Тисп соответственно. Изобразим эту изобару отдельно, отметив на ней температуры плавления и кипения (рис. 2б). Зафиксировав давление, мы уменьшили число независимых термодинамических переменных и получили одномерную диаграмму состояний. Так выглядит диаграмма состояний большинства мономорфных металлов при постоянном давлении.
Изобара при давлении р1 на рис. 2 пересекает только кривую сублимации. При таком давлении возможен прямой переход из твердого состояния в газообразное. Изобара при давлении р2 пересекает только кривую плавления. Переход из жидкого состояния в газообразное в этом случае происходит непрерывно, за критической точкой жидкая и газовая фазы физически неразличимы. Эти два случая для металлов не характерны. На одномерных диаграммах состояний (изобарах) полиморфных металлов будут присутствовать также точки (температуры) полиморфных превращений. Нетрудно убедиться в том, что соотношение (4) для одномерных диаграмм также соблюдается.
Двойные системы Многокомпонентной системой будем называть совокупность всех сплавов, состоящих из данных компонентов. В многокомпонентных системах к температуре и давлению добавляется еще (k – 1) независимый параметр – концентрации (k – 1) компонента. Систему обычно обозначают химическими символами компонентов, разделенными дефисом, например, система Cu-Zn-Mg, При рассмотрении теоретических вопросов компоненты обозначаются буквами латинского алфавита, например, система А-В. В двойной системе есть три независимых термодинамических параметра: температура, давление и концентрация одного из компонентов. Следовательно, для изображения диаграммы состояний двухкомпонентной (или двойной) системы необходимы три координатных оси – диаграмма становится объемной, что неудобно для изображения на листе бумаги или на плоском экране компьютерного монитора. Как было сказано выше, для практических целей во многих случаях давление можно считать постоянным. Тогда диаграмму двойной системы можно изображать на плоскости. Ось температур обычно направляют вертикально, а по горизонтали откладывают концентрацию одного из компонентов в относительных единицах или в процентах. Так как концентрация изменяется в ограниченных пределах (от 0 до 1 или от 0 до 100 %), то ось концентраций имеет вид отрезка. Необходимо помнить, что концентрация второго компонента изменяется в обратном направлении – от 1 до 0, или от 100 % до 0. Поэтому для системы А–В на одном конце концентрационного отрезка ставится символ одного из компонентов (В), а на другом – второго (А), как это будет делаться на нижеследующих рисунках. Для анализа процессов, протекающих в конкретном сплаве, на диаграмме состояний проводят вертикальную линию через точку на оси концентраций, соответствующую составу этого сплава. Эта линия называется линией сплава. Общий вид диаграммы состояний зависит от того, в каких фазовых состояниях могут находиться сплавы. Рассмотрим далее основные типы диаграмм состояния двойных систем. Металлические материалы применяются преимущественно в твердом состоянии. В технологических процессах получения сплавов часто используются процессы плавления и кристаллизации. Газообразное состояние металлов практически не используется. Поэтому в дальнейшем будут рассматриваться диаграммы состояний сплавов только в твердом и жидком агрегатных состояниях.
Диаграмма с эвтектикой Как уже говорилось, чаще всего встречаются двойные системы, компоненты которых в твердом состоянии образуют ограниченные растворы друг с другом. Рассмотрим систему, в которой образуются два
Сплавы, находящи+еся между этими двумя линиями, находятся за пределами растворимости и являются двухфазными, состоящими из фаз α и β. Линия AEB является на этой диаграмме линией ликвидус, линия ACEDB – линией солидус. Используя правило фаз и правило отрезков, можно проследить за процессами, протекающими при изменении температуры сплавов. Сплав I. Выше точки 1, расположенной на линии ликвидус, сплав находится в однофазном жидком состоянии.
Сплав II. Выше точки 3 этот сплав также находится в состоянии жидкого раствора. Его кристаллизация происходит между точками 3 и 4, аналогично кристаллизации сплава I. При охлаждении между точками 4 и 5 находится в состоянии однофазного твердого раствора и фазовых превращений в нем не происходит. Точка 5 лежит на линии предельной растворимости, поэтому при более низких температурах из раствора выделяются кристаллы второй, более богатой компонентом В фазы – твердого раствора β. Состав твердого раствора α ниже точки 5 изменяется по кривой 5F. Состав β-фазы также изменяется – по линии 5’-G. Кривая охлаждения и схемы структур этого сплава при различных температурах показаны на рис. 9. Кристаллы β выделившиеся из твердого раствора α, называются вторичными кристаллами (их обозначают символом βII) в отличие от первичных β-кристаллов, выделяющихся из жидкости. Процесс выделения вторичных кристаллов из твердой фазы носит название вторичной кристаллизации в отличие от процесса первичной кристаллизации, когда кристаллы (первичные) образуются в жидкой фазе. Сплав III. При кристаллизации этого сплава, в отличие от предыдущих, при достижении горизонтальной линии CDE наступает нонвариантная реакция. В равновесии находятся три фазы — жидкость эвтектического состава, α-кристаллы состава точки С и β-кристаллы состава точки D. Эвтектическая кристаллизация в сплавах этой системы записывается в виде:
Реакция эта нонвариантна, так как при двух компонентах в реакции участвуют три фазы. Все три фазы, участвующие в реакции, имеют определенные составы (проекции точек С, Е, D) и температура их превращения постоянна. В результате кристаллизации сплава III, кроме первичных (выделившихся при охлаждении от точки 3 до точки 4) кристаллов α, образуется еще эвтектика α + β. При дальнейшем охлаждении вследствие изменения растворимости α-кристаллы выделяют вторичные кристаллы βII и при нормальной температуре α-кристаллы (как первичные, так и входящие в эвтектику) будут иметь состав, отвечающий точке F. Кривая охлаждения сплава III и структуры этого сплава показаны на рис. 9б. Выделение вторичных кристаллов из эвтектических составляющих обычно не обнаруживается при микроскопическом исследовании, так как вторичные выделения объединяются с такой же (одноименной) фазой эвтектики. Сплав IV. Линия этого сплава проходит через эвтектическую точку Е, следовательно, его кристаллизация начнется с одновременного выделения кристаллов двух фаз по реакции (8) и буде протекать изотермически при эвтектической температуре (как для чистого компонента!). После завершения кристаллизации в этом сплаве будут протекать те же процессы, что и сплаве III. В структуре твердого сплава будет присутствовать только эвтектика. Компоненты сплава термодинамически равноправны. Поэтому в сплавах, линии которых на диаграмме состояний расположены правее эвтектической точки, фазовые превращения протекают аналогично процессам в сплавах, линии которых находятся левее этой точки. При описании этих процессов необходимо лишь поменять местами обозначения и названия компонентов и фаз. Так механизм кристаллизация сплава V такой же, что и в сплаве III, но начинается кристаллизация с выделения кристаллов β, остающаяся незакристаллизованной жидкая фаза при уменьшении температуры будет обогащаться компонентом А. Таким образом, твердые сплавы данной системы могут быть либо однофазными (α или β), либо двухфазными (α + β). Структурное состояние твердых сплавов более разнообразно и зависит от того, через какие фазовые области проходит линия сплава. Если линия сплава проходит левее точки F, структура сплава будет представлена физически одинаковыми зернами твердого раствора α. Соответственно, если линия сплава проходит правее точки G, структура сплава будет представлена физически одинаковыми зернами твердого раствора β. В том случае, когда линия сплава проходит между точками F и С, в его структуре будут вторичные кристаллы β-фазы (главным образом по границам кристаллов α-фазы). Аналогичной будет структура сплавов, линии которых проходят между точками D и G, но основу структуры будут составлять кристаллы твердого раствора β, а на их границах – вторичные кристаллы α-фазы. Структура сплавов, состав которых близок к эвтектическому, будет состоять только из эвтектики (сплавы V и VI). В сплавах, линии которых проходят между точками С и Е, содержится эвтектика и первичные кристаллы α-фазы. В сплавах, линии которых проходят между точками Е и D, содержится эвтектика и первичные кристаллы β-фазы. Таким образом, сплав V схож со сплавом III, а сплав VI – со сплавом II. Правило фаз можно применять не только для определения фазового состояния, но и для расчета соотношения структурных составляющих в сплаве. Например, на рис. 8 отрезок ab является конодой для определения фазового состояния сплава с, а отрезок ad – конода для определения структурного состояния этого же сплава. Отношение ас / ab определяет долю фазы β, а отношение ac / ad – долю эвтектики. Отношение сb / ab определяет долю фазы α, а отношение cd / ad – долю первичных кристаллов α. Диаграмма с перитектикой При эвтектическом превращении жидкость кристаллизуется с образованием двух твердых фаз. Возможен и другой тип нонвариантного превращения (трёхфазного равновесия), когда жидкость реагирует с ранее выпавшими кристаллами и образует новый вид кристаллов по реакции
Реакция подобного типа называется перитектической. Диаграмма с перитектическим превращением показана на рис. 10. На диаграмме, как и в предыдущем случае, существуют три однофазные области: жидкости Ж и ограниченных твердых растворов αи β; три двухфазные области: Ж + α, Ж + β, α + β. Горизонталь CD соответствует трехфазному равновесию. Линия ADB является линией ликвидус, линия ACPB — линией солидус, линии CF и PB – сольвус.
Кристаллизация сплавов I, II и VI происходит аналогично кристаллизации соответствующих сплавов на диаграмме с эвтектикой. Кристаллизация сплава III начинается, как и кристаллизация сплавов I и II, с выделения твердого раствора αв точке 6. Затем по мере снижения температуры состав жидкости меняется по линии ликвидус от точки 6 до точки D. Состав твердого раствора α меняется вдоль линии солидус от точки 6’ до точки C. По достижении перитектической горизонтали CPD обе фазы реагируют и дают третью фазу β, концентрация которой определяется точкой P – третьей точкой на горизонтали. Количественное соотношение фаз при перитектической реакции, необходимое для образования β-фазы, определяется по правилу отрезков соотношением
В рассматриваемом же сплаве количество участвующих в перитектической реакции кристаллов α и жидкости определяется соотношением
т. е. в данном сплаве имеется избыток α-фазы по сравнению с тем количеством, которое необходимо для образования β-кристаллов. Поэтому по окончании реакции в избытке остаются α-кристаллы. Следовательно, в структуре будут продукты перитектической реакции (т. е. β-кристаллы) и оставшиеся избыточные первичные α-кристаллы. Чем ближе точка 6лежит к точке P, тем меньше в реакции остается избыточных α-кристаллов. Так как состав β-фазы является промежуточным между составами жидкости и α-фазы, при перитектической кристаллизации зародыши β-фазы образуются на границе жидкости и кристаллов α-фазы и растут затем с одновременным поглощением обеих исходных фаз. В результате получается структура, в которой остатки кристаллов α-фазы окружены β-фазой (рис. 11).
Для сплава, отвечающего по концентрации точке P, соотношение реагирующих при перитектическом превращении жидкости и α-кристаллов таково, что оно как раз достаточно для образования β-кристаллов предельной концентрации согласно формуле (10). Отличие кристаллизации сплавов IV и V от кристаллизации сплава III состоит в том, что при перитектической температуре имеется избыток жидкой фазы по сравнению с тем количеством, которое необходимо для образования α-кристаллов концентрации P. Поэтому перитектическое превращение заканчивается исчерпанием α-твердого раствора, и оставшаяся жидкость в интервале между точками 9 и 10кристаллизуется в β-фазу. По окончании кристаллизации сплав однофазный. Ниже точки 11 из β-фазы выделяются вторичные кристаллы α-твердого раствора. Еще раз обратим внимание на то, что кристаллизация сплавов может происходить в один или несколько этапов. Так, сплавы I, II VI на рис. 10 кристаллизуются в один политермический этап при наличии одной степени свободы. Эвтектический сплав IV на рис. 8 кристаллизуется, как и чистый компонент, в один изотермический этап (нонвариантная кристаллизация). Сплав III на рис. 10, до- и заэвтектические сплавы III и V на рис. 8 кристаллизуются в два этапа: сначала политермически (моновариантная кристаллизация), затем изотермически при эвтектической или перитектической температуре. Кристаллизация сплавов IV и V на рис. 10 происходит в три этапа: сначала политермически с выделением одной кристаллической фазы, затем изотермически (перитектическое превращение) и снова политермически с выделением другой твердой фазы. Диаграммы состояния Диаграмма состояния представляет собой графическое изображение зависимости фазового состояния сплава от термодинамических параметров. Обычно на диаграммах изображают только термодинамически равновесные (устойчивые) состояния, поэтому их часто называют диаграммами равновесия. Фазой в термодинамике называют совокупность однородных частей системы, отделенных от других частей системы поверхностью раздела, при переходе через которую химический состав или структура вещества изменяются скачком. Однородная жидкость является однофазной системой. Различными фазами в чистом металле являются разные агрегатные состояния или разные кристаллические модификации в случае полиморфизма. Совокупность зерен чистого твердого металла представляет собой одну фазу. Сплав определенного состава, в отличие от чистого металла, может быть как однофазным, так и многофазным. Общие закономерности сосуществования устойчивых фаз определяются правилом фаз Гиббса, которое дает количественную зависимость между степенью свободы системы и количеством фаз и компонентов. Под числом степеней свободы (вариантностью) системы понимают число внешних и внутренних факторов (температура, давление и концентрация), которое можно изменять без изменения числа фаз в системе. Если число степеней свободы равно нулю (нонвариантная система), то нельзя изменять внешние и внутренние факторы системы (температуру, давление и концентрацию) без того, чтобы это не вызвало изменения числа фаз. Если число степеней свободы равно единице (моновариантная система), то возможно изменение в некоторых пределах одного из перечисленных факторов, и это не вызовет уменьшения или увеличения числа фаз. Математическое выражение правила фаз имеет вид:
где с – число степеней свободы системы, k – число компонентов, f – число фаз, n – число внешних термодинамических параметров. Если система не находится во внешних физических полях, то n = 2. Чаще всего в качестве внешних термодинамических параметров рассматривают температуру и давление. Уравнение правила фаз можно вывести на основании следующих соображений. Предположим, что мы имеем систему из k компонентов, образующих f фаз, и система находится в равновесии. Для системы, находящейся в равновесии, термодинамический потенциал каждого компонента (химический потенциал) μ во всех фазах одинаков. В противном случае происходило бы превращение фазы с компонентом, имеющим более высокий термодинамический потенциал. Предположим, что система состоит из k компонент и f фаз. Если система находится в равновесии, то химические потенциалы каждого из компонентов во всех фазах равны между собой, то есть:
………….................
В этих уравнениях верхняя цифра – номер компонента, нижняя – номер фазы. В каждой строчке имеется Так как всего имеем f фаз, то количество переменных по концентрации, температуре и давлению будет равно Число степеней свободы
или
Однокомпонентные вещества Диаграмма состояния однокомпонентного вещества обычно строится в координатах давление – температура (р–T – диаграмма: рис. 1). Каждая точка на диаграмме соответствует определенному сочетанию термодинамических параметров, их называют конфигурационными точками. Для однокомпонентного вещества k = 1 и правило фаз (2) принимает вид
Если в системе есть две фазы, то число степеней свободы равно 1. Это значит, что изменению одного из параметров (давления или температуры) обязательно приведет к изменению второго параметра (температуры или давления соответственно). При заданной температуре термодинамическое равновесие между двумя фазами одного и того же вещества возможно лишь при определенном значении давления в системе. Зависимость равновесного давления от температуры на диаграмме изображается линией, называемой кривой фазового равновесия. Если рассматриваемое вещество может существовать лишь в трех агрегатных состояниях, то возможны три двухфазных состояния: газ – жидкость, жидкость – твердое тело, твердое тело – газ. Три кривые двухфазных равновесий разбивают плоскость р–T – диаграммы на три отдельные области, в которых вещество существует в однородном агрегатном состоянии – твердом, жидком или газообразном (рис. 1)[1]. Кривая O–ТТ, соответствующая равновесию между твердой и газообразной фазами, называется кривой сублимации. Кривая ТТ–TK равновесия между жидкостью и газом называется кривой испарения, она обрывается в критической точке KТ. Кривая TТ–M равновесия между твердым телом и жидкостью называется кривой плавления. Кривые равновесия сходятся в точке ТT, в которой могут сосуществовать в равновесии все три фазы. Эта точка называется тройной точкой. При наличии трех фаз число степеней свободы равно нулю, так что это состояние возможно лишь при единственном сочетании значений давления и температуры Как уже было сказано, многие металлы обладают полиморфизмом, т.е. существуют в различных кристаллических модификациях в разных термодинамических условиях. Каждая кристаллическая модификация данного вещества является самостоятельной фазой. Тогда общее число реализуемых фаз в системе будет больше трех, но при f > 3 число степеней свободы становится отрицательным, что невозможно. Следовательно, согласно правилу фаз, сколько бы кристаллических модификаций не имел данный металл, но каждая из них может находиться в равновесии не более чем с двумя другими фазами. Поэтому на диаграмме состояний может быть несколько тройных точек, но не может быть ни одной четверной или пятерной. Таким образом, на диаграмме состояний однокомпонентной системы (чистого металла) три вида геометрических объектов: точки, определяющие значения температур и давлений, при которых могут сосуществовать в равновесии три фазы; линии, соответствующие двухфазным состояниям; области однофазных состояний. При этом выполняется правило: сумма мерности [2] геометрического объекта на диаграмме состояний и соответствующего этому объекту числа равновесных фаз равна постоянному числу, в данном случае трем. В дальнейшем можно будет убедиться, что для всех диаграмм состояний справедливо более общее правило: сумма мерности m геометрического объекта на диаграмме состояний и соответствующего этому объекту числа равновесных фаз f есть величина постоянная, равна сумме числа компонентов и числа независимых термодинамических параметров:
Большинство технологических процессов получения и обработки металлических материалов, в том числе металлургические процессы, протекают при атмосферном давлении. Изменение этого давления происходит в относительно узком интервале значений, и оно практически не сказывается на фазовом состоянии и свойствах материалов. Это позволяет считать, что все превращения происходят при постоянном давлении. Тогда число термодинамических переменных уменьшится на единицу, и уравнение правила фаз примет вид:
На рис. 2 представлена та же диаграмма, что и на предыдущем рисунке, но оси координат поменялись местами. Здесь проведены три вертикальные прямые линии – изобары. Изобара при давлении р2 пересекает кривые плавления и испарения при температурах Тпл и Тисп соответственно. Изобразим эту изобару отдельно, отметив на ней температуры плавления и кипения (рис. 2б). Зафиксировав давление, мы уменьшили число независимых термодинамических переменных и получили одномерную диаграмму состояний. Так выглядит диаграмма состояний большинства мономорфных металлов при постоянном давлении.
Изобара при давлении р1 на рис. 2 пересекает только кривую сублимации. При таком давлении возможен прямой переход из твердого состояния в газообразное. Изобара при давлении р2 пересекает только кривую плавления. Переход из жидкого состояния в газообразное в этом случае происходит непрерывно, за критической точкой жидкая и газовая фазы физически неразличимы. Эти два случая для металлов не характерны. На одномерных диаграммах состояний (изобарах) полиморфных металлов будут присутствовать также точки (температуры) полиморфных превращений. Нетрудно убедиться в том, что соотношение (4) для одномерных диаграмм также соблюдается.
Двойные системы Многокомпонентной системой будем называть совокупность всех сплавов, состоящих из данных компонентов. В многокомпонентных системах к температуре и давлению добавляется еще (k – 1) независимый параметр – концентрации (k – 1) компонента. Систему обычно обозначают химическими символами компонентов, разделенными дефисом, например, система Cu-Zn-Mg, При рассмотрении теоретических вопросов компоненты обозначаются буквами латинского алфавита, например, система А-В. В двойной системе есть три независимых термодинамических параметра: температура, давление и концентрация одного из компонентов. Следовательно, для изображения диаграммы состояний двухкомпонентной (или двойной) системы необходимы три координатных оси – диаграмма становится объемной, что неудобно для изображения на листе бумаги или на плоском экране компьютерного монитора. Как было сказано выше, для практических целей во многих случаях давление можно считать постоянным. Тогда диаграмму двойной системы можно изображать на плоскости. Ось температур обычно направляют вертикально, а по горизонтали откладывают концентрацию одного из компонентов в относительных единицах или в процентах. Так как концентрация изменяется в ограниченных пределах (от 0 до 1 или от 0 до 100 %), то ось концентраций имеет вид отрезка. Необходимо помнить, что концентрация второго компонента изменяется в обратном направлении – от 1 до 0, или от 100 % до 0. Поэтому для системы А–В на одном
|
||||||||||||||
|
Последнее изменение этой страницы: 2017-02-10; просмотров: 434; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.017 с.) |

 , (1)
, (1) ;
; ;
;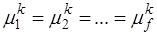 .
. уравнение, а всех строк k, следовательно, всего имеется
уравнение, а всех строк k, следовательно, всего имеется  уравнений. Переменными в нашей системе являются температура, давление и концентрации. Предполагая, что в каждую фазу входят все компоненты, в ней можно изменять концентрацию
уравнений. Переменными в нашей системе являются температура, давление и концентрации. Предполагая, что в каждую фазу входят все компоненты, в ней можно изменять концентрацию  компонентов (концентрация последнего определится по разности).
компонентов (концентрация последнего определится по разности).
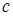 равняется разности между числом переменных и числом уравнений, т. е.
равняется разности между числом переменных и числом уравнений, т. е.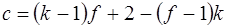 .
. . (2)
. (2) (3)
(3) При наличии лишь одной фазы (например, жидкости) число степеней свободы системы равно 2, так что возможно одновременное независимое изменение и температуры и давления (конфигурационная точка может перемещаться как по горизонтали, так и по вертикали) без изменения фазового состояния. Поэтому на р–T – диаграмме однофазному состоянию соответствует некоторая часть плоскости – фазовая область (рис. 1).
При наличии лишь одной фазы (например, жидкости) число степеней свободы системы равно 2, так что возможно одновременное независимое изменение и температуры и давления (конфигурационная точка может перемещаться как по горизонтали, так и по вертикали) без изменения фазового состояния. Поэтому на р–T – диаграмме однофазному состоянию соответствует некоторая часть плоскости – фазовая область (рис. 1). . (4)
. (4) (5)
(5)
 твердых раствора: α – раствор компонента В в А и β – раствор компонента А в В. Следовательно, около вертикалей, соответствующих чистым компонентам, находятся области существования этих твердых растворов (рис. 8). Предельная растворимость растворенного вещества в твердых растворах, как правило, растет с увеличением температуры. Эта зависимость для фаз α и β на рис. 8 представлена линиями CF и DG, которые называются линиями сольвус (от латинского solvare – р//астворять).
твердых раствора: α – раствор компонента В в А и β – раствор компонента А в В. Следовательно, около вертикалей, соответствующих чистым компонентам, находятся области существования этих твердых растворов (рис. 8). Предельная растворимость растворенного вещества в твердых растворах, как правило, растет с увеличением температуры. Эта зависимость для фаз α и β на рис. 8 представлена линиями CF и DG, которые называются линиями сольвус (от латинского solvare – р//астворять).

 . (8)
. (8) . (9)
. (9)
 . (10)
. (10) , (11)
, (11)
 - фаза появляется на границе реагирующей друг с другом жидкости и
- фаза появляется на границе реагирующей друг с другом жидкости и  - кристаллов. Для сплава I перитектической реакцией заканчивается процесс кристаллизации.
- кристаллов. Для сплава I перитектической реакцией заканчивается процесс кристаллизации.


