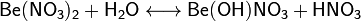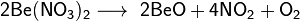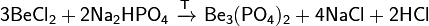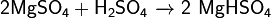Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Соли кислородсодержащих кислот бериллия и магнияСодержание книги
Поиск на нашем сайте
Карбонат бериллия — химическое соединение бериллия с химической формулой ВеСО3. Представляет собой бесцветное кристаллическое вещество (в порошке - белое).[1] Карбонат бериллия не имеет запаха, но, как все соединения бериллия, обладает сладковатым вкусом. Химические свойства · Все формы карбоната бериллия растворяются в избытке карбонатов щелочных металлов и аммония с образованием растворимых комплексных соединений. Например, возможны реакции:
· Карбонат бериллия взаимодействует с кислотами с образованием солей:
· При температуре выше 100 °C карбонат бериллия разлагается:
Сульфа́т бери́ллия — химическое соединение с формулой BeSO4. Белое твёрдое кристаллическое вещество. Впервые было обнаружено в 1815 годуЯкобом Берцелиусом Получение Сульфат бериллия может быть получен взаимодействием в водном растворе любой соли бериллия с серной кислотой с последующим выпариванием и кристаллизацией продукта реакции. Получаемый гидрат может быть разложен на воду и безводную соль при нагревании до 400 °C[4]. Нитрат бериллия — химическое соединение с формулой Be(NO3)2. Представляет собой среднюю соль бериллия и азотной кислоты. Химические свойства Вступает в большинство обменных реакций, свойственных другим нитратам. С карбонатами и сульфидами щелочных металлов и аммония реагирует с образованием гидроксида бериллия:
Нитрат бериллия в водных растворах частично гидролизируется с образованием основного нитрата:
При нагревании в вакууме возгоняется,образуя летучий оксонитрат[1]:
Термическое разложение Be(NO3)2 происходит при 1000°С, при этом образуется оксид бериллия, кислород и оксиды азота:
Фосфат бериллия — неорганическое соединение, кислая соль металлабериллия и ортофосфорной кислоты с формулой Be3(PO4)2, бесцветные кристаллы, растворимые в воде, образует кристаллогидраты. Получение: обработка растворов солей бериллия избытком раствора гидрофосфата натрия Карбонат магния, магний углекислый, MgCO3 — магниеваясоль угольной кислоты. Свойства Белые кристаллы, плотность 3,037 г/см³. При 500 °C заметно, а при 650 °C полностью разлагается на MgO и CO2. Растворимость карбоната магния в воде незначительна (22 мг/л при 25 °C) и уменьшается с повышением температуры. При насыщении CO2 водной суспензии MgCO3 последний растворяется вследствие образования гидрокарбоната Мg(HCO3)2. Из водных растворов в отсутствие избытка CO2выделяются основные карбонаты магния. С карбонатами ряда металлов карбонат магния образует двойные соли, к которым относится и природный минерал доломит MgCO3·CaCO3. Сульфат магния — неорганическое вещество, соль металла магния и серной кислоты с формулой MgSO4, белый порошок, образует несколько кристаллогидратов. В медицине используется при лечении ожирения как солевое слабительное, для достижения так называемого магниевого стресса. Химические свойства · При нагревании выше температуры плавления разлагается:
· С концентрированной серной кислотой образует гидросульфаты:
при нагревании выпадают сольваты состава MgSO4•H2SO4 и MgSO4•3H2SO4. · При нагревании взаимодействует с сероводородом, двуокисью кремния, углеродом:
Нитрат магния Mg(NO3)2 — бесцветные гигроскопичные кристаллы с кубической решеткой (а = 0,748 нм, пространств. группа Ра3); температура плавления 426 °C (с разложением); С°р 141,9 Дж/(моль. К); DH0обр −792,8 кДж/моль, DG0обр −591,4 кДж/моль. Выше 300 °C начинает разлагаться на MgO и оксиды азота. Растворимость в воде (г в 100 г): 73,3 (20 °C), 81,2 (40 °C), 91,9 (60 °C). Растворим также в этаноле, метаноле, жидком NH3. Из водных растворов в зависимости от концентрации кристаллизуются нона-, гекса- и дигидраты. Магния нитрат образует с N2O4 аддукт состава Mg(NO3)2.N2O4, разлагающийся выше 50 °C, а также аммины [Mg(NH3)J(NO3)2 и двойные соли с нитратами др. металлов. Безводный магния нитрат получают взаимодействием Mg с N2O4 с последующим отщеплением N2O4, гидратированный — реакцией MgCO3 или MgO с разбавлением HNO3. Гексагидрат — исходное соединение при синтезе MgO особой чистоты, нитратов др. металлов, а также разложении соединений Mg
Ортофосфат магния — неорганическое соединение,соль магния и ортофосфорной кислоты с формулой Mg3(PO4)2. Бесцветные кристаллы почти не растворимые в воде. Образует несколько кристаллогидратов.
|
||||||
|
Последнее изменение этой страницы: 2017-02-10; просмотров: 633; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.12.34.211 (0.009 с.) |