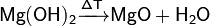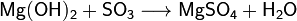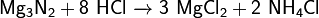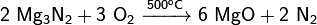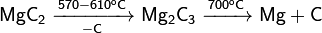Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Гидроксиды бериллия и магния.Нитриды,карбиды,галогениды
Гидрокси́д бери́ллия — амфотерный гидроксид, имеющий химическую формулу Be(OH)2. При стандартных условиях представляет собой гелеобразное белое вещество, практически нерастворимое в воде. Вместе с тем, он хорошо растворяется в разбавленных минеральных кислотах. Гидроксид бериллия получают в виде геля при обработке солей бериллия гидроксидами щелочных металлов или гидролизом нитрида или фосфида бериллия. Химические свойства[править исходный текст] Взаимодействие с щелочами с образованием соли: Be( Взаимодействие с кислотами с образованием соли и воды: Be( Разложение на оксид бериллия и воду при нагревании до 400 °C:
Нитрид бериллия — химическое соединение с формулой Be3N2. Представляет собой желтый или желтовато-белый кристаллический порошок, разлагающийся во влажном воздухе. Нитрид бериллия реагирует с минеральными кислотами с образованием соответствующих солей: Be3N2+8HCl В растворах щелочей нитрид бериллия энергично растворяется с выделением аммиака и образованием гидроксобериллатов: Be3N2+6NaOH+6H2O С холодной водой реагирует медленно, в горячей - быстро гидролизирует с образованием гидроксида бериллия и аммиака: Be3N2+6H2O
Нитрид бериллия окисляется на воздухе при нагревании до 600°С: 2Be3N2+3O2 Реагирует с нитридом кремния Si3N4 в токе аммиака при 1800-1900°С с образованием BeSiN2: Be3N2+Si3N4 Нитрид бериллия при нагревании в вакууме способен разлагаться на металлический бериллий и газообразный азот: Be3N2 Карбид бериллия (англ. Beryllium carbide) — химическое соединение с формулой Be2C. Карбид бериллия достаточно реакционноспособен. При 1000°С взаимодействует с азотом: 3Be2C+2N2 В атмосфере галогенов, за исключением иода, карбид бериллия переходит в галогенид, выделяя углерод: Be2C+2Cl2
При взаимодействии с галогеноводородами образуются галогенид и метан: Be2C+4HCl Карбид бериллия медленно гидролизуется воде и разбавленными кислотами с выделением метана: Be2C+4H2O Be2C+2H2SO4 В горячих концентрированных щелочах карбид бериллия растворяется с образованием бериллатов щелочных металлов и метана: Be2C+4NaOH Йоди́д бери́ллия — химическое соединение с формулой BeI2. Йодид бериллия представляет собой бесцветные игольчатые кристаллы. В присутствие влаги или при растворении в воде соединение быстро гидролизирует, с выделением газообразного йодоводорода. Относится к йодидам, т.е. солям йодоводородной кислоты HI.
Связь Be-I в соединении практически ковалентная. В парах, вблизи температуры плавления, молекулы йодида бериллийия преимущественно димерны (Be2I4).
Йодид бериллия, вследствие гидролиза, бурно взаимодействует с водой: BeI2+2H2O
Йода в йодиде бериллия может быть замещен другим галогеном. Поэтому йодид бериллия легко вступает в реакцию с фтором, образуя фторид бериллия и фториды йода, с хлором и бромом - образуя соответственно хлорида и бромид бериллия,а также иод: BeI2+2F2 BeI2+Cl2 BeI2+Br2 Бериллий йодида легко реагирует с окислителями, таких как хлорат и перманганат калия с образованием молекулярного йода. При высоких температурах (порядка 750—900°С) йодид бериллия диссоциирует: BeI2 Гидрокси́д ма́гния — неорганический гидроксид щелочноземельного металла магния. Относится к классу нерастворимых оснований. Химические свойства · Разложение при нагревании до 350 °C:
· Взаимодействие с кислотами с образованием соли и воды (реакция нейтрализации):
· Взаимодействие с кислотными оксидами с образованием соли и воды:
· Взаимодействие с горячими концентрированными растворами щелочей с образованием гидроксомагнезатов:
Нитрид магния — бинарное неорганическое соединение азота и магния с формулой Mg3N2. Жёлтовато-зелёные кристаллы. Химические свойства · При нагревании разлагается:
· Реагирует с водой:
· и кислотами:
· Окисляется кислородом:
Карбид магния — бинарное неорганическое соединение магния и углерода с формулой MgС2. Известен также карбид магния с формулой Mg2C. Химические свойства · При нагревании разлагается с образованием промежуточного карбида Mg2С3:
· Взаимодействует с водой:
Фторид магния — бинарное неорганическое соединение магния и фтора с формулой MgF2. Бесцветные диамагнитные тетраэдрические кристаллы. Химические свойства · Хорошо растворяется в растворах фторидов и сульфатов щелочных металлов с образованием комплексных анионов:
|
||||||
|
Последнее изменение этой страницы: 2017-02-10; просмотров: 646; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.221.15.15 (0.008 с.) |
 +2NaOH
+2NaOH 
 Be
Be  +2
+2  O
O BeO+
BeO+  3BeCl2+2NH4Cl
3BeCl2+2NH4Cl