
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Теоретические основы получения низких температурСтр 1 из 18Следующая ⇒
Обзор и сравнение способов получения водорода Водород является очень активным. Осн. источники – вода и ж.,г. УВ. Способы: 1)Паровой способ (связывание кислорода): Fe + H2O = FeO + H2 3FeO + H2O = Fe3O4 + H2 Fe3O4 + 4CO = 3Fe + 4CO2 Этот процесс периодический и энергоёмкий. 2)Газификация тв. топлива (перевод из тв. в газ). Осуществляется путем неполного окисл. углерода, кот. входит в тв. топливо, различными окислителями (воздух,водяной пар,смесь водяного пара с воздухом, смесь водяного пара с кислородом). Первичный продукт – СО.Далее подвергается конверсии с получением СО2 + Н2. Получение воздушного регенераторного газа: С + О2 = СО2 + Q CO2 + C = 2CO – Q Процесс газификации проводят с недостатком О2. После первой реакции Т↑ до 1100–1200 С.Вторая реакция обратима. Т.к. она эндотермическая, то для увеличения выхода СО надо ↑Т. Газификацию ведут при Т=600–1000 К. Процесс надо вести в непрерывном режиме фильтрующим слоем тв. топлива.
1-корпус; 2-колоссниковая решетка; 3-штуцер для подачи воздуха; 4-штуцер для загрузки кокса; 5-штуцер для вывода регенерируемого газа;6-течка для выпуска золы. Кокс непрерывно подаётся, в нижнюю часть апп-та подается воздух, соприкасается с золой, охлаждает её,горячий идёт в зону горения Т=1200 С. Контактирует с СО2: С + СО2 =2СО –Q. Зола газифиц-ся.Процесс осущ. Автотермично без подвода теплоты. Для получения водорода регенерируемый газ подается на конверсию вод. Паром: СО + Н2О = СО2 + Н2 –Q. Процесс идет на тв. кат-ре(Fe-Cr).СО2 выделяется путем абсорбц. Получаем 35% водорода. Газификацию можно осущ-ть в кип.или неподвижном слое. 3)Коксование каменного угля с получением коксового газа. Процесс осущ-ся в доменных печах(шахтная печь-сверху руда и кокс, снизу воздух). При коксовании каменных углейиз 1 тонны кам.угля образ-ся до 350 м3 коксового газа(содерж. Н2 55-62%). Коксовый газ служит источником для получения Н2..Ткип.(Н2) отличается от Ткип. др,она самая низкая.На этом и основано выделение водорода.Ступенчато охлаждают коксовый г.,до Ткип. ж.азота.Все примеси входящие в коксовый г. конденс-ся и в г.фазе ост-ся почти чистый Н2.Этот процесс требует очень ↓Т. В РБ этот метод не применяется. 4)Электролиз воды. «–»:↑расход электроэнергии. Использовать нецелесообразно. 5)Конверсия УВ водяным паром или др. окислителями.
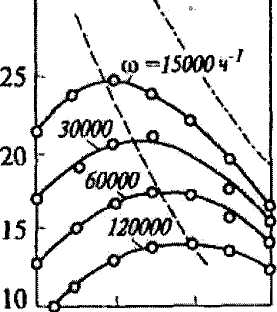
Наиб. Выгодно использовать прир.г.(92–98% СН4) СН4 + Н2О = СО + 3Н2 СО + Н2О = СО2 + Н2 СН4 + 2Н2О = СО2 + 2Н2 В наст.вр.это доминирующий метод. Для получения водорода осущ-ся неполное окисление прир.г. В кач-ве ок-лей могут быть: 1.СН4 + Н2О = СО + 3Н2 2. СН4 + СО2 = 2СО + 2Н2 3. СН4 + ½ О2 = СО + 2Н2 Н2О – наиб. доступна, СО2 в чистом виде нет.1 и 2 реакции сильно эндотермичны и для них надо ↑Т, т.е. ↑ затраты энергии.третяя реакция почти необратима и она экзотермична, пр-сс идет без затрат энергии из вне. Устройство конверторов оксида углерода. Полочные, аксиальные и радиальные конверторы. Конверсия CO-экзотермический процесс, надо проводить при низких температурах. Применяются полочные конверсионные аппараты с промежуточным охлаждением газовой смеси. Осуществляется в 2-ух ступенях:1)среднетемпературный Fe - Cr kat,2)для достижения максимальной степени превращения используют низкотемпературный Fe - Cr – Cu kat.На 1-ой ступени Т=350-380 ºС, на выходе из 1-ой ступени 450 ºС. После 1-ой ступени устанавливают котлы утилизаторы и теплообменники, чтобы понизить температуру.V-ая скорость =2000 нм3/ м3час.Vт смеси увеличивается в 5 раз, Vkat =100 м3.Применяются полочные конверторы аксиального и радиального типа. В радиальных аппаратах высота слоя kat меньше, чем в аксиальных.Следовательно гидравлическое сопротивление меньше. Обоснование оптимального режима синтеза аммиака Влияние давления. И термодинамические, и кинетические факторы свидетельствуют в пользу проведения процесса при высоких давлениях (увеличивается равновесный выход, повышается скорость синтеза).На рис.. приведены зависимости содержания аммиака в азотоводородной смеси стехиометрического состава от давления для промышленного катализатора марки СА-1. Зависимость содержания аммиака при разных давлениях и объемной скорости 30000 ч-1.
\
Из рисунка видно, что с увеличением давления содержание аммиака увеличивается. На ОАО "Гродно Азот" синтез аммиака осуществляется при давлении порядка 20 МПа. Влияние объемной скорости. Зависимость содержания аммиака на выходе из колонны синтеза для давления 30 МПа представлена в таблице
При увеличении объемной скорости удельная производительность катализатора возрастает, следовательно, увеличивается производительность колонны синтеза (съем аммиака с 1 м3 катализатора увеличивается). При этом концентрация аммиака уменьшается, пропорционально падает скорость обратной реакции, а скорость суммарного процесса увеличивается. Однако увеличение объемной скорости отрицательно скажется на системе конденсации аммиака (расход холода увеличится). На ОАО "Гродно Азот" объемная скорость составляет порядка 17000-19000 ч-1. Влияние температуры. Зависимость содержания аммиака от температуры при разных объемных скоростях и давлении 30 МПа представлена на рис.Из рисунка видно, что для синтеза аммиака существует оптимальный интервал температур. Процесс синтеза надо начинать при более высокой температуре, а затем снижать температуру по линии оптимальных температур (процесс синтеза необходимо осуществлять в падающем температурном режиме). Зависимость содержания аммиака от температуры при разных объемных скоростях и давлении 30 МПа
400 450 500 t,ºC На ОАО "Гродно Азот" рабочий интервал температур 400-530°С. Влияние инертов. Введение инертного газа в систему при р =const подобно эффекту уменьшения общего давления. Реакция протекает с уменьшением числа молей (Δn< 0), разбавление инертным газом смещает равновесие реакции в сторону исходных реагентов. Для синтеза аммиака увеличение концентрации инертов в газе будет приводить к уменьшению парциального давления азотоводородной смеси, что равносильно снижению давления в системе, а это приведет к уменьшению концентрации аммиака на выходе. Выводы о влиянии инертного газа непосредственно следуют и из закона Дальтона: Pj=Nj·p где Pj - парциальное давлениеj-ro компонента; Nj· мольная доля j-ro компонента. Из закона Дальтона видно, что эффект разбавления подобен эффекту снижения общего давления в системе.
АК – 72. Мощность 1150 т/сутки. Р = 0.4 МПа окисл., Р = 1.1 МПа на стадии абсорбции.
1-фильтр для очистки воздуха;2-компрессор;3-испаритель ж. NH3;4-фильтр для очистки NH3;5-подогреватель NH3;6-смеситель NH3 с воздухом;7-фильтр для дополнительной очистки аммиачно-воздушной смеси;8-кат-ые сетки;9-котел-утилизатор;10-т/о для подогрева пит. воды 9;11-холод.-конд.;12-промывная колонна нитрозного газа13-сборник HNO3;14-циркул. насос;15-холодильник;16-компрессор для сжатия нитрозных газов;17-холод.-конд.;18-абсорбционная колонна;19-сборник HNO3;20-насос;21-отбелочная колонна;22-сборник продукц. HNO3;23-брызгоуловитель;24-т/о для подогрева хвостовых нитрозных газов;25-топка (смеситель) хвостовых газов с природным;26-ап. для каталитического восстан. ок.;27-г. турбина. Воздух перед подачей в аппарат подвергается очистке от механических примесей путём фильтрации воздуха сжимая до Р=0.45 МПа и в смеситель, туда и NH3. NH3 проходит испаритель (0.6 МПа), очистку от механических примесей, подогрев до 150 °С. Воздух нагревается до 160°С -170°С за счет сжатия. Подогрев надо, т. к. теплоты реакции недостаточно для поддержания оптимального режима. Токисл.=840-860°С. Воздух смешивается с NH3. Концентрация NH3 в см. =10% (поддерживается автоматически). В смесителе дополнительная фильтрация (чтобы кат.служил больше). Допустимое содержание примесей 0.007 мг/м3. NH3-возд. смесь поступает на кат.. Применяют комбинированный кат (Pt,Fe,Cr). Выход ок. азота = 96%, 4% NH3 окисляется доN2. 2-ая стадия окисл. ок.N. Для этого охлаждают нитрозные газы (увел. выход).Нитрозные газы охлаждаются с использованием теплоты экзотермических реакций. Для этого внизу аппарата устанавливается котёл-утилизатор, где вырабатывается водяной пар. Нитрозные газы охлаждаются до 250°С -300°С. Dап. = 4 м, Н = 5.6 м. Охлаждается нитрозный газ в 2-3 ступени: (10) и (11). В (10) нитрозный газ охлаждается до 150°С -120°С, в (11) – до 50-60°С. При этих Т почти полное окисление NO до NO2 и конденсируется водяной пар.
4NH3 + 5O2 = 4NO + 6H2O 2NO + O2 = 2NO2 3NO2 + H2O = 2HNO3 + NO Нитрозные газы сжимаются до Р=1.1 МПа. Перед подачей нитрозного газа на сжатие из них надо выделить HNO3, следовательно для этого устанавливается промывная колонна. Это тарельчатая колонна. Нитр.г. под нижнюю тарелку, на верхней – сконд. HNO3, который выходит из нижней тарелки и возвращается на орошение, проходя через холодильник. По мере циркуляции объем NHO3 увеличивается, часть ее отбирается и подается на абсорбцию C (HNO3) = 45-50%. В промывной колонне HNO3 отделяется от нитрозного газа. Далее нитр. газ идет в компрессор, сж. до Р=1.1 МПа. За счет их сжатия Т увеличивается следовательно потом устанавливается дополнительный холодильник, где Т уменьшается до 50-60°С. Дальше происходит дополнительное окисление NO до NO2. Нитрозный газ под нижнюю тарелку абс-ой кол.. На верхнюю тарелку – вода, которая стекает вниз, встречается с оксидом азота следовательно на тарелках образуется HNO3 и выделяется втор. NO, который в межтарельчатом пространстве окисляется до NO2. Объём абсорбционной колонны рассчитывают по времени окисления NO до NO2. D=4м, Н=57.7 м,45 ситчатых тарелок. Т. к.реакция экзотермическая, то Т увеличивается в колонне следовательно для поддержания необходимого Т-го режима(40-50°С) на нижних тарелках устанавливается змеевик. вод-ые холод. (на 10 нижних тарелках, т. к. там в основном идёт экзотермическая реакция). С(HNO3) на нижней тарелке 60-65%, на 5-й-51%, на 10-ой-31%, на15-ой-15%, на 20-ой- (7-7.5)%, на 25 -4%, на 30-1.5, на 35- (0.5-0.6)%, на 40-0.05%, на последней – вода.
HNO3 60% растворяет ок.N далее HNO3 из нижней тарелки бурая следовательно.После абсорбционной колонны HNO3 подаётся в отбелочную колонну HNO3 на верхнюю тарелку, под нижнюю – воздух. Идёт десорбция растворённых оксидов азота,дальше кислота обесцвечивается, а затем идёт потребителю. Степень превращения в HNO3 99.3-99.5%. Концентрация ок. = 0.05% - это выше нормы следовательно обезвреживают каталитическим окислением природного газа при Т=500-600°С. Следовательно перед подачей нитрозного газа на обезвреживание их подогревают до 400-500°С, смешивается с природным газом и в ап.. Нитрозный газ из абсорбционной колонны в брызгоуловитель, т/о, где нагревается до Т=400°С, смешивается с природным газом. В нитр.газе всегда есть О2 (3-4%): CH4 + O2 =CO + 2H2 Кол-во прир. газа рассчитывается по этой реакции, чтобы образ. восстан-ая атм.. 2NO +H2 = N2 +2H2O Полезно использовать ам. хвост. нитр. г.. Их расширяют в газовой турбине до атмосферного давления после аппарата длякат-го восстановления. Турбина устанавливается на 1 валу с компрессорами для сжатия воздуха и нитрозного газа. Нет расхода энергии на сжатие. Т.е. энерготехнологическая установка. В газовой турбине Т уменьшается до 400-500°С и выбрасывается в атмосферу. Эта схема позволила уменьшить Т окисления, значит уменьшатся потери Pt-го кат.. Увелич. Р на абс. позволило увеличить степень превращения HNO3 и увеличивается её концентрация. В схеме кат-ое окисление оксида оксида азота след. нет загрязнения окружающей среды. Энерготехнолог. Схема: Мощность выше в 3 раза след.меньше капитальные вложения, выше производительность труда. Окисление NH3. Увеличивать Р больше не можем. Если увеличивать Р до 2-2.5 МПа, то производительность выше в 2 раза, но толщина стенок аппарата увеличится.НЕ РЕАЛИЗОВЫВАЮТ!!! С (HNO3) = 60-65%. В этой схеме летом 60%, а зимой 65%. Такая концентрация подходит для получения минеральных удобрений. ВИДА АЗОТНЫХ УДОБРЕНИЙ Азотные удобрения играют важную роль в решении задач повышения урожайности сельскохозяйственных культур, обеспечения страны продовольствием, а также получения валютных поступлений за счет их поставки. Ассортиментный состав выпуска азотных удобрений насчитывает более 20 различных видов и марок удобрений. Выпускаются как одинарные азотные удобрения, так и сложные. Одинарные азотные удобрения производятся следующие: карбамид, аммиачная и калиевая селитры, сульфат аммония, аммиак для сельского хозяйства, аммиачная вода, КАС (карбамид-аммиачная селитра). ОАО «Гродно Азот» является единственным в Республике Беларусь производителем одинарных азотных удобрений. Кроме этого ОАО «Гродно Азот» специализируется на выпуске метанола и капролактама. Мощности предприятия по выпуску основных видов продукции следующие: 1) Аммиак жидкий технический - 900 тыс. т в год; 2) Карбамид - 1000 тыс. т в год; 3) Удобрения жидкие азотные (КАС) - 720 тыс. т в год; 4) Метанол технический - 66 тыс. т в год; 5) Капролактам - 111,2 тыс. т в год; 6) Сульфат аммония - 319 тыс. т в год;
7) Гидроксиламинсульфат кристаллический - 3,3 тыс. т в год. Сульфат аммония Сульфат аммония производится из отходов производства капролактама.Основной реакцией получения сульфата аммония является нейтрализация аммиака серной кислотой.Эта реакция протекает с выделением тепла. Сам по себе сульфат аммония представляет собой белое криссталическое вещество, почти не гигроскопичное, не слеживаемое. Но есть один большой недостаток, из-за которого его применение ограничено: процентное содержание азота в нем невелико, всего лишь 21 %. Содержание свободной серной кислоты = 30 %. Кристаллизация сульфата аммония идет при Т = Ткрис, т.е при 108,5 С. Сушка протекает в 2 стадии (горячяя и холодная). Сам процесс образования сульфата аммония можно описать следующим образом: Раствор слабо концетрированный 10 % → Выпарка → Сгущение → Центрифугирование → Сушка. После центрифуги влажность сульфата достигает 2,5 %, а после сушки всего лишь 0,2 %. Аммонийной селитры Аммиачная селитра является одним из основных и самых востребованных агорохозяйствами азотных минеральных удобрений. Аммиачная селитра NH4N03 содержит 34-35% азота. В нём удачно сочетается быстродействующий нитратный азот с менее подвижным аммиачным. Хорошо растворяется в воде. Это безбалластное удобрение, и стоимость перевозки содержащегося в нём азота ниже, чем при перевозке других азотных удобрений (за исключением карбамида и жидкого аммиака). Кристаллический продукт при хранении слёживается. Поэтому значительную часть этого удобрения промышленность выпускает в гранулированном виде. Аммиачную селитру применяют в качестве основного удобрения при посеве (в лунки, гнёзда, лентой) и в виде подкормки. Только на песчаных и суперпесчаных почвах возможно частичное вымывание азота, внесённого заранее. Поэтому здесь не следует вносить это удобрение осенью. Основной метод: Было отмечено [1],что в промышленном производстве используется безводный аммиак и концентрированная азотная кислота:
Реакция протекает бурно с выделением большого количества тепла. Для использования в качестве удобрения расплав гранулируется в распылительных аппаратах, сушится, охлаждается и покрывается составами для предотвращения слёживания. Цвет гранул варьируется от белого до бесцветного. Метод Габера: из азота и водорода синтезируется аммиак, часть которого окисляется до азотной кислоты и реагирует с аммиаком, в результате чего образуется нитрат аммония: 3H2 + N2 → 2 NH3 (При давлении, высокой температуре и катализаторе); NH3 + 2O2 → HNO3 + H2O; HNO3 + NH3 → NH4NO3. Нитрофосфатный метод: Этот способ так же известен как способ Одда, названный так в честь норвежского города, в котором был разработан этот процесс). Он применяется непосредственно для получения азотных и азотно-фосфорных удобрений из широко доступного природного сырья. При этом протекают следующие процессы: Природный фосфат кальция (апатит) растворяют в азотной кислоте: Ca3(PO4)2 + 6HNO3 + 12H2O → 2H3PO4 + 3Ca(NO3)2 + 12H2O. Полученную смесь охлаждают до 0°С, при этом нитрат кальция кристаллизуется в виде тетрагидрата — Ca(NO3)2·4H2O, и его отделяют от фосфорной кислоты. На полученный нитрат кальция и не удалённую фосфорную кислоту действуют аммиаком, и в итоге получают нитрат аммония: Ca(NO3)2 + 4H3PO4 + 8NH3 → CaHPO4↓ + 2NH4NO3 + 3(NH4)2HPO4. NН3 Химическая формула – NН3. Относительная молекулярная масса – 17. Продуктом производства является синтетический аммиак. Жидкий аммиак (NН3) – бесцветная прозрачная жидкость с резким запахом, образуется в результате охлаждения газообразного аммиака до минус 33,4°С при атмосферном давлении. При температуре минус 78°С затвердевает в виде кристаллов кубической формы. Плотность жидкого аммиака равна 681,4 кг/м3. Критическая температура аммиака равна 132,4°С, критическое давление 115 кгс/см2. Молярная теплоемкость аммиака при атмосферном давлении и 20°С равна 35,66 кДж/моль·град, молярная теплота испарения при минус 33,4°С составляет 22,37 кДж/моль. Карбамид Карбамид представляет собой бесцветные кристаллы легко растворимые в воде, спирте, жидком аммиаке, сернистом ангидриде. Температура плавления 132,7°C, плотность 1,33•103 кг/м3. Карбамид при нормальных условиях пожаро- и взрывобезопасен, не токсичен. Карбамид упаковывают в клапанные бумажные и полимерные мешки по нормативно-технической документации. Навалом в железнодорожные вагоны типа «хоппер», минераловозы, а также в специализированные металлические контейнеры. Для розничной торговли продукт упаковывают в полиэтиленовые пакеты, массой не более 3 кг. Хранят в закрытых сухих складских помещениях. Контейнеры с карбамидом и транспортные пакеты допускается хранить на открытых площадках. Транспортируют в упакованном виде и насыпью всеми видами крытого транспорта, кроме воздушного. КАС Для производства КАС используется раствор карбамида, вырабатываемый цехом карбамид объединенный, и плав аммиачной селитры, вырабатываемый цехом слабой азотной кислоты и жидких азотных удобрений. Для производства плава аммиачной селитры и раствора карбамида исходным сырьем является аммиак. Исходным сырьем для производства капролактама являются: бензол, аммиак, водород, гидроксиламинсульфат (ГАС), олеум (серная кислота) и сода каустическая.
Теоретические основы получения низких температур Для достижения низких температур применяются дросселирование газа и расширение с отдачей внешней работы. Дросселирование газа. Джоуль и Томсон определили значение изменения температуры реальных газов при их дросселировании. Процесс дросселирования происходит при постоянной энтальпии и является необратимым. Дифференциальный эффект Джоуля - Томсона наблюдается при бесконечно малом изменении давления, при этом
Практически за дифференциальный эффект принимают изменение температуры при понижении давления на 0,1 МПа. Для воздуха средняя величина эффекта составляет 0,25º. Эффект дросселирования при больших разницах давлений называется интегральным и выражается:
Что происходит при дросселировании? Рассмотрим цилиндр, разделенный перегородкой на две части. Дросселируемый газ перетекает из левой части цилиндра в правую.
Рисунок-1 – К дросселированию газа При дросселировании давление газа снижается и газ расширяется. Температура идеального газа постоянна, а температура реального газа либо повышается или понижается. Это связано с тем, что при дросселировании реальные газы совершают внутреннюю и внешнюю работу. Внутренняя заключается в преодолении сил взаимного притяжения между молекулами, а внешняя при перемещении объема газа после дросселя. Тепло, подводимое к газу в процессе изменения его состояния расходуется на изменение внутренней энергии и совершение внешней работы.
где
где
Температура газа постоянно понижается. Внешняя работа может быть положительной, отрицательной или равной 0. ü ü ü Изоэнтропное расширение газов. Процесс расширения газа с отдачей внешней работы протекает адиабатически при постоянной энтропии. Дифференциальный эффект изменения температуры при адиабатическом расширении
При таком расширении газа происходит его значительное охлаждение. Расширение газа производится в поршневых машинах или турбомашинах, называемых детандерами. Работа детандера, в котором происходит расширение воздуха, равна разности его энтальпий на входе и выходе из детандера: При
где
|
|||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-17; просмотров: 170; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.134.107 (0.099 с.) |

 ,%(по - объему )
,%(по - объему )





 ,
,
 - внешняя работа, совершаемая газом,
- внешняя работа, совершаемая газом,  - внутренняя энергия до дросселирования.
- внутренняя энергия до дросселирования. ,
, - внутренняя потенциальная энергия,
- внутренняя потенциальная энергия,  - кинетическая энергия молекул.
- кинетическая энергия молекул.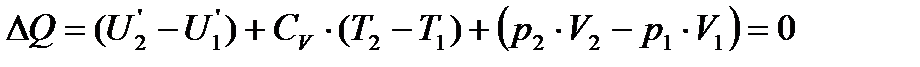

 . Влияние на изменение Т оказывает внутренняя энергия.
. Влияние на изменение Т оказывает внутренняя энергия.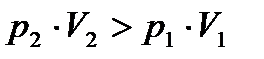 . Понижение Т за счет изменения внутренней энергии.
. Понижение Т за счет изменения внутренней энергии. . Общий эффект дросселирования от соотношения внутренней и внешней работы.
. Общий эффект дросселирования от соотношения внутренней и внешней работы.
 .
. конечная температура
конечная температура  может быть определена по уравнению
может быть определена по уравнению ,
, - соответственно температуры до и после расширения газа;
- соответственно температуры до и после расширения газа; - начальное и конечное давление;
- начальное и конечное давление; - показатель адиабаты.
- показатель адиабаты. В основе техники сжижения лежат холодильные установки. Холодильный цикл – замкнутый процесс сжатия или расширения газа, который сопровождается нагреванием или охлаждением. Процесс удобно рассматривать с помощью энтропийной диаграммы.(рисунок 2)
В основе техники сжижения лежат холодильные установки. Холодильный цикл – замкнутый процесс сжатия или расширения газа, который сопровождается нагреванием или охлаждением. Процесс удобно рассматривать с помощью энтропийной диаграммы.(рисунок 2)


