
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Очистка конвертируемого газа водными р-рами карбонатовщелочных ме
K2CO3+CO2+H2O=2KHCO3+Q Используют активаторы ДЭА, т.к. эти р-ры очень активны, то для уменьшения коррозии вводят ингибиторы. При понижении Т р-ть K2CO3 в воде мала Схема очистки конвертируемого газа от СО2
1-абсорбер СО2 2-теплообменник 3-дросельный вентиль 4-десорбер СО2 (регенератор) 5-подогреватель 6-насос 7-воздушный холодильник
Конвертируемый газ(содержание СО2=18%) с Т 40-500С и Р 3Мпа подается в нижнею часть абсорбера, который орошается р-ром МЭА. Очищенный газ выводится с остаточным содержанием СО2=0,01-0,1%. Р-р из нижней части абсорбера направляют в теплообменник 2, далее р-р дросселируется до Р=0,2-0,3 Мпа и подается на верхнею тарелку десорбера. Регенерированный р-р сжимают в 6 до Р=3 Мпа, затем подается в межтрубное пространство теплообменника 2 и 7 для охлаждения, далее поступает на верхнею тарелку абсорбера1. В настоящее время процесс осуществляют по многоточной схеме(отпадает необходимость регенерации всего р-ра, следовательно, снижение расхода тепла).
18. Физико-химические основы синтеза NH3. Равновесие и кинетика процесса. Виды катализаторов. N2 + 3H2 = 2NH3 + 89,02 кДж Реакция синтеза обратима и экзотермична, идет с уменьшением объема. Экспериментально найдено:
Достичь полного превращения АВС в аммиак невозможно. Без катализатора процесс неосуществим. В реальных условиях степень превращения не превышает 18%. В промышленных условиях синтез NH3 осуществляют по циркуляционной схеме. В реальной АВС содержится метан (0,3…0,5%об), аргон (0,2…0,3%об). Эти газы не оказывают никакого воздействия на катализатор, однако способны накапливаться в системе, что понижает выход NH3. Необходимо выводить инерты из газовой смеси. Для этого часть прореагировавшей АВС выводят из цикла (кол-во инертов, поступающих со свежей АВС, должно равняться кол-ву выводимых инертов). Объем продувочных газов: Для снижения объема продувочных газов необходимо снижать содержание инертов в свежей АВС ( Используется железный катализатор (Тзаж=4000С). Оптимальное кол-во AL2O3 в составе катализатора не менее 4%масс. Это объясняется тем, что AL2O3 имеет высокую адсорбционную емкость к NH3. Чтобы увеличить скорость десорбции NH3 вводят модифицирующие добавки (K2O и др.). Кол-во K2O в 2..3 раза меньше, чем AL2O3. Дальнейшие исследования показали, что промотирующими св-вами обладают оксиды Ca, Mg и Si. В конце 60-х был разработан четырежды промотированный катализатор СА-1 (производство осуществлялось из чистого магнетита или катализаторного железа). Была разработана модификация – восстановленный катализатор СА-1В.
Существуют низкотемпературные катализаторы (Тзаж=3500С). Рабочий интервал температур 350…4750С. Это дает возможность либо увеличить выход NH3 при том же давлении, либо снизить давление при том же выходе NH3. После распада СССР вперед вырвались следующие фирмы по производству катализаторов: 1. Tokse – KM-1(P=12МПа); 2. ICI – AR-16(P=8…10МПа). Процесс синтеза NH3 состоит из следующих стадий: 1) перенос газообразных реагирующих веществ к поверхности катализатора, 2) активированная адсорбция 3) перегруппировка атомов 4) десорбция продукта реакции с поверхности и перенос продукта реакции от поверхности в объем газовой фазы. Лимитирующей стадией является активированная адсорбция. 1. N2 = 2N 2. FexN + H = FexNH 3. FexNH + H = FexNH2 4. FexNH2 + H = FexNH3 Время контактирования измеряется секундами (5…10с). В промышленных условиях время контактирования регулируют объемной скоростью.
Чем выше объемная скорость ( Концентрацию NH3 можно рассчитать по следующему эмпирическому уравнению:
|
|||||
|
Последнее изменение этой страницы: 2017-02-17; просмотров: 197; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.226.93.207 (0.006 с.) |
 процесс проводят при повышенной Т Т=65-900С, Р=2,5-3 Мпа. с конц. паташа 25-30%, ДЭА 2%. Регенерация: Т=135-1450С, Р=0,25-0,3 Мпа.
процесс проводят при повышенной Т Т=65-900С, Р=2,5-3 Мпа. с конц. паташа 25-30%, ДЭА 2%. Регенерация: Т=135-1450С, Р=0,25-0,3 Мпа.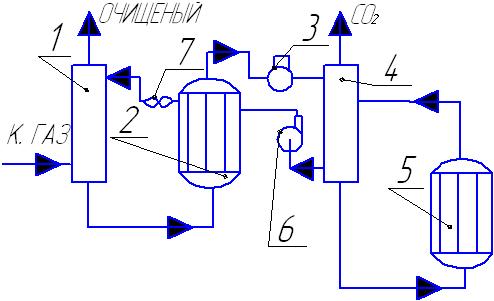
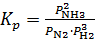

 характеризуют зависимость
характеризуют зависимость  .
.
 ), совершенствовать методы очистки АВС (к примеру, промывка жидким N2) и повышать концентрацию инертов в циркуляционном потоке (
), совершенствовать методы очистки АВС (к примеру, промывка жидким N2) и повышать концентрацию инертов в циркуляционном потоке ( ).
).
 ), тем больше температура. Следует процесс начинать при самой большой Т(500), а затем, по мере продвижения смеси, температуру необходимо снижать по ЛОТ, которая определяется активностью катализатора.
), тем больше температура. Следует процесс начинать при самой большой Т(500), а затем, по мере продвижения смеси, температуру необходимо снижать по ЛОТ, которая определяется активностью катализатора.
 – константа, зависящая от Р,Т. С увеличением
– константа, зависящая от Р,Т. С увеличением  падает и растет объем рециркулирующего газа. Также с увел.
падает и растет объем рециркулирующего газа. Также с увел. 


