
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Диаграммы термодинамических процессов в PV, TS и hS координатах.Содержание книги
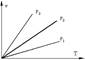
Поиск на нашем сайте Изотермические процессы в P-v координатах Т1>T2 >T3
Процесс, при котором отсутствует теплообмен между системой и окружающей средой, называется адиабатным, при этом количество теплоты в системе остается постоянными (Q=const). В реальной жизни адиабатных процессов не существует поскольку полностью изолировать систему от окружающей среды не возможно. Однако часто происходят процессы, при которых теплообменном с окружающей средой очень мал, например, быстрое сжатие газа в сосуде поршнем, когда тепло не успевает отводиться за счет нагрева поршня и сосуда. 5.Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона).
R - газовая постоянная (у каждого газа свое значение) Если известно уравнение состояния, то для определения состояния простейших систем достаточно знать две независимые переменные из 3-х Р = f1 (v, т); v = f2 (Р, Т); Т = f3 (v, Р)
Термодинамические процессы изменения состояния газа. Рассмотрим термодинамическую систему, состоящую из одного тела v какого либо газа в сосуде с поршнем, причем сосуд и поршень в данном случае является внешней средой. Пусть, для примера, происходит нагрев газа в сосуде, возможны два случая: 1) Если поршень зафиксирован и объем не меняется, то произойдет повышение давления в сосуде. Такой процесс называется изохорным (v=const), идущий при постоянном объеме; Изохорные процессы в P - T координатах: v1>v2>v3
2)Если поршень свободен, то нагреваемый газ будет расширяться, при постоянном давлении такой процесс называется изобарическим (P=const), идущим при постоянном давлении. Изобарные процессы в v - T координатах P1>P2>P3
Если, перемещая поршень, изменять объем газа в сосуде то, температура газа тоже будет изменяться, однако можно охлаждая сосуд при сжатии газа и нагревая при расширении можно достичь того, что температура будет постоянной при изменениях объема и давления, такой процесс называется изотермическим (Т=const). Изотермические процессы в P-v координатах Т1>T2 >T3
Процесс, при котором отсутствует теплообмен между системой и окружающей средой, называется адиабатным, при этом количество теплоты в системе остается постоянными (Q=const). В реальной жизни адиабатных процессов не существует поскольку полностью изолировать систему от окружающей среды не возможно. Однако часто происходят процессы, при которых теплообменном с окружающей средой очень мал, например, быстрое сжатие газа в сосуде поршнем, когда тепло не успевает отводиться за счет нагрева поршня и сосуда.
Смеси идеальных газов. Мольная (молярная) доля вещества — концентрация, выраженная отношением числа молей вещества к общему числу молей всех веществ, имеющихся в растворе.
где xB — мольная доля вещества B в растворе nB — количество вещества B, содержащееся в растворе (измеряется в молях)
Мольная доля отдельных компонентов газа в идеальной газовой смеси может быть выражена в пределах парциальных давлений компонентов или молей компонентов:
и парциальное давление отдельных компонентов газов в идеальном газе может быть получено используя следующее выражение:
xi = мольной доле любого отдельного компонента газа в газовой смеси Pi = парциальному давлению любого отдельного компонента газа в газовой смеси ni = молям любого отдельного компонента газа в газовой смеси n = общему числу молей газовой смеси P = общему давлению в газовой смеси Мольная доля компонентов газа в газовой смеси равна объёмной доле этого компонента в газовой смеси.
Теплоемкость газов. Теплоёмкость тела (обычно обозначается латинской буквой C) — физическая величина, определяющая отношение бесконечно малого количества теплоты δQ, полученного телом, к соответствующему приращению его температуры δT:
Единица измерения теплоёмкости в системе СИ — Дж/К. Теплоемкость идеального газа — это отношение тепла, сообщенного газу, к изменению температуры δТ, которое при этом произошло. Удельной теплоёмкостью называется количество теплоты, которое необходимо для нагревания единичного количества вещества на один (1) градус. Количество вещества может быть измерено в килограммах, кубических метрах и молях. В зависимости от того, к какой количественной единице относится теплоёмкость, различают массовую, объёмную и молярную теплоёмкость.
Истечение газов. Истечение — если две материальные среды отделены друг от друга стенкой, имеющей отверстия, и давления, под которыми находятся эти среды, неодинаковы, то среда, находящаяся под большим давлением, исходит в соседнюю среду в виде струи - потока первой среды, ограниченного со всех сторон второй средой. Это явление называется истечением. Характер течения газа или пара зависит от формы неподвижных каналов и скорости потока. Особая роль принадлежит местной скорости звука, поэтому различают дозвуковой и сверхзвуковой режимы течения. Неподвижные каналы могут быть постоянного и переменного сечения. Последние делятся на суживающиеся и расширяющиеся. В вентиляционной технике они соответственно называются конфузорами и диффузорами, а в энергетике — соплами. Сопла — неотъемлемые элементы паровых и газовых турбин, реактивных и ракетных двигателей. В суживающихся каналах (конфузоры, сопла) скорость потока возрастает, а давление падает, в расширяющихся — скорость может уменьшаться, а давление расти (диффузоры). Скорость может и увеличиваться при падении давления, если на входе обеспечивается скорость потока, равная местной скорости звука (расширяющиеся сопла).
|
||
|
Последнее изменение этой страницы: 2017-02-17; просмотров: 767; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.006 с.) |







 — сумма количества вещества всех компонентов раствора (измеряется в молях)
— сумма количества вещества всех компонентов раствора (измеряется в молях)
 , где:
, где:




