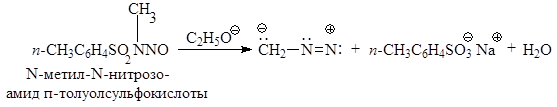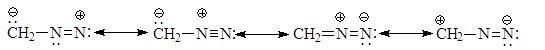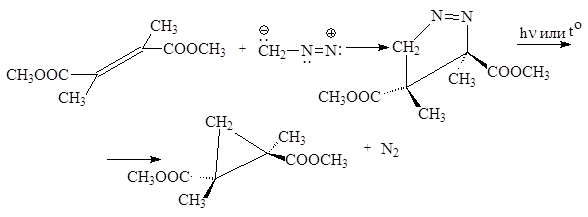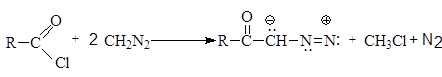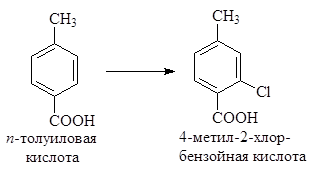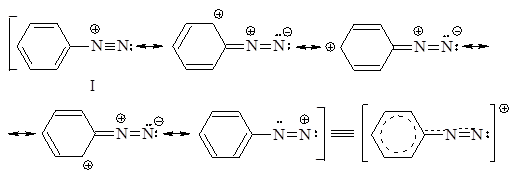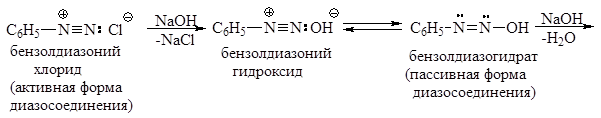Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Строение ароматических солей диазонияСодержание книги
Поиск на нашем сайте АРОМАТИЧЕСКИЕ СОЛИ ДИАЗОНИЯ
ПОЛУЧЕНИЕ Как уже отмечалось в гл. 23, ароматические соли диазония полу-чают реакцией диазотирования – взаимодействием первичных ароматичес-ких аминов с натриевой солью азотистой кислоты в присутствии минеральной кислоты. Общее уравнение реакции диазотирования имеет вид:
При использовании в качестве минеральной кислоты соляной кисло-ты диазотирование протекает следующим образом. На первой стадии при взаимодействии нитрита натрия с соляной кис-лотой образуется азотистая кислота.
В солянокислой среде азотистая кислота образует нитрозилхлорид, кото-рый и является диазотирующим агентом.
Собственно диазотирование протекает по следующей схеме:
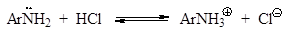
В отличие от алифатических диазоний-ионов ароматические диазо-ний-ионы стабилизированы сопряжением диазониевой группы с аромати-ческим ядром. Вследствие этого, при 0-5оС (а в виде солей с комплексными анионами - и при комнатной температуре) они являются вполне устойчивыми соединениями. Как видно из схемы, первичный амин вступает в реакцию диазотиро-вания в свободном состоянии, а не в виде соли, с которой в кислой среде он находится в равновесии:
На практике при проведении реакции диазотирования соблюдают следующие условия. 1). Реакцию проводят при 0-5оС, поскольку при более высокой температуре происходит разложение азотистой кислоты и соли диазония:
2). Применяют избыток минеральной кислоты (около 2.5-3 моль на 1 моль амина); при недостатке кислоты наблюдается образование диазоаминосоединений:
3) окончание диазотирования определяют по наличию избытка HNO2 про-бой с йодкрахмальной бумагой:
Замещение диазогруппы на йод Если в диазорастворе присутствует такой сильный нуклеофил, как йодид-ион, диазогруппа гладко замещается на атом йода. Замена N2 ® I в этом случае не сопровождается побочными процессами и в присутствии хлорид-ионов.
Эта реакция не осложняется также и образованием фенола. Введение группы SH Обработка водного раствора соли арендиазония этилксантогенатом калия при умеренном нагревании ведет к гладкому образованию S-арил-О-этилксантогената, гидролиз которого с препаративным выходом дает соответствующий тиофенол
Реакция азосочетания Важную в практическом отношении группу реакций ароматических диазониевых солей составляют реакции ароматического замещения, приводящие к образованию азосоединений. В этих реакциях диазониевые соли выступают в качестве электрофильного агента:
Поскольку положительный заряд в арендиазоний-ионе делокализован по системе p-связей, включая ароматическое кольцо, то электрофильность такого катиона невелика. Вследствие этого, ион арендиазония может вступать в реакции электрофильного замещения только с соединениями, содержащими сильные электронодонорные заместители, например, ОӨ –, ОН– и NR2-группы, т.е. с феноксид-ионами, фенолами и аминами.
Как гидрокси-, так и аминогруппы повышают электронную плот-ность в ароматическом кольце и тем самым облегчают реакцию даже со слабыми электрофильными реагентами, к числу которых относятся и ионы арендиазония. Реакции электрофильного ароматического замещения солей арендиазония называют реакциями азосочетания. Ароматические субстраты (амины и фенолы) выступают в этих реакциях в качестве азосоставляющих.
В случае очень активной соли диазония сочетание может происхо-дить при Y = ОСН3. Для каждой реакции азосочетания имеется оптимальное значение рН. В частности, наибольшая скорость азосочетания для фенолов наблю-дается при рН 9–11. При этом значении рН фенол существует в виде феноксид-иона, а отрицательно заряженный атом кислорода является значительно более эффективным донором электронов по механизму сопряжения, нежели гидроксигруппа. При рН 4–9 в растворе имеется значительное количество свобод-ного амина. По этой причине в данном интервале рН наблюдается наиболее высокая скорость азосочетания с участием ариламинов в качестве азосоставляющей. При рН более 10 скорость азосочетания мала как для аминов, так и для фенолов. Это обусловлено превращением солей диазония в диазогид-раты и диазотаты, которые не имеют электрофильных свойств. Таким образом, для сочетания аминов наиболее благоприятной является слабокислая и нейтральная среда (рН 4–8), для фенолов – умеренно-щелочная среда (рН 8–10). Механизм азосочетания представляет собой электрофильное арома-тическое замещение. Реакция азосочетания с амином идет по схеме:
На активность арендиазоний-иона значительное влияние оказывают заместители, находящиеся в ароматическом ядре. Электроноакцепторные заместители повышают его электрофильность, а следовательно и активность в азосочетании
Азосочетание имеет важное промышленное значение, поскольку образующиеся азосоединения интенсивно окрашены и широко исполь-зуются в качестве красителей. ДИАЗОАЛКАНЫ Выше в разделе 23.7. мы уже отмечали неустойчивость алкилдиазониевых ионов и их малую ценность для препаративного органического синтеза. Однако, при наличии протона у углеродного атома, связанного с диазогруппой, алкилдиазониевый ион может трансформироваться в другое диазосоединение – диазоалкан
Диазоалканы представляют собой двухзарядные ионы, вполне устойчивы при низких температурах и широко используются в синтетических целях.
ПОЛУЧЕНИЕ ДИАЗОАЛКАНОВ В препаративных целях диазоалканы получают взаимодействием нитрозоамидов карбоновых и сульфоновых кислот с сильными основаниями. Ниже в качестве примера приведен ряд способов получения диазометана: а) действием этилата натрия на N-метил-N-нитрозоамид п -толуолсульфо- кислоты
б) действием раствора щелочи на N-метил-N-нитрозокарбамат
в) действием раствора щелочи на N-метил-N-нитрозоамид карбоновой кислоты
г) действием 30% водного раствора гидроксида натрия на бис(N-метил-N- нитрозоамид)терефталевой кислоты; в этом – одном из наиболее ценных в препаративном отнощении способов – выход диазометана достигает 90%.
РЕАКЦИИ ДИАЗОМЕТАНА Электронное строение диазометана представляют набором резонансных структур
Характер резонансных структур указывает на значительную делокализацию зарядов в этой частице. Диазометан является мягким алкилирующим агентом. Его применение позволяет эффективно метилировать карбоновые и минеральные кислоты, фенолы. Диазометан при этом является карбеноидной частицей, которая генерирует карбен в ходе реакции.
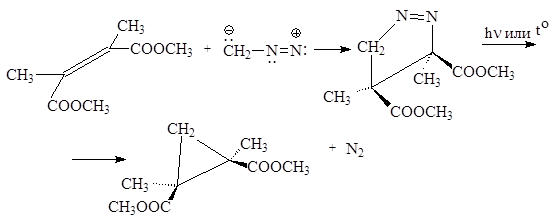
Частица карбена может внедряться в С-С-связи, а также присоединяться по кратным связям
Диазометан и другие диазоалканы обнаруживают также реакции, характерные для 1,3-диполярных соединений.
Как видим, реакция протекает стереоспецифично как син -присоединение. Термолиз (или фотолиз) промежуточно-образующегося аддукта – производного пиразолина с хорошим выходом дает соответствующий циклопропан. РЕАКЦИЯ АРНДТА-ЭЙСТЕРТА Диазометан гладко реагирует с хлорангидридами карбоновых кислот с образованием a-диазокетонов.
хлорангидрид диазометан диазокетон хлорметан В качестве растворителя применяют высококипящий спирт (бензиловый спирт, 2-октанол и т.д.). a-Диазокетоны значительно стабильнее диазоалканов, поскольку возможна их дополнительная резонансная стабилизация с участием С=О-группы.
Тем не менее и диазокетоны отщепляют азот при их нагревании до 160-180 оС в высококипящем спирте (бензиловый спирт, 2-октанол) в присутствии катализатора (соль серебра Ag (I)) или при облучении.
Гидролиз алкилкетена с количественным выходом дает карбоновую кислоту, содержащую более длинную углеродную цепь по сравнению с исходным хлорангидридом.
алкилкетен карбоновая кислота
Превращение карбоновой кислоты в ее ближайший гомолог взаимодействием хлорангидрида с диазометаном, перегруппировка образовавшегося диазокетона в кетен и превращение последнего в кислоту получили название реакции Арндта – Эйстерта (1927 г.) Стадия превращения диазокетона в кетен имеет самостоятельное значение и носит название перегруппировки Вольфа (1912 г.).
ОСНОВНЫЕ ТЕРМИНЫ Азосоединение – органическое соединение, которое содержит азогруппу –N=N-, связанную с двумя углеводородными заместителями.
Арндта – Эйстерта реакция – реакция удлиннения цепи углеродных атомов карбоновой кислоты на один углеродный атом с использованием диазометана. Диазосоединение – органическое соединение, которое содержит диазогруппу –N=N-Х, связанную с углеводородным заместителем. Диазония соль – органическое соединение, которое содержит диазониевую группу, связанную с углеводородным заместителем. Диазотирование – взаимодействие первичных ароматических аминов с нитритом натрия в присутствии минеральной кислоты. Зандмейера реакция – замещение диазогруппы на Cl, Br или CN- группу в присутствии солей одновалентной меди.
ЗАДАЧИ
Задача 24.1. Предложите, каким образом бензойную кислоту можно превратить в фенилуксусную кислоту.
Задача 24.2. Покажите схему превращений, которые претерпевает анилин в условиях реакции диазотирования с последующим изменением pH диазораствора от 3 до 10.
Задача 24.3. Какую минеральную кислоту следует применить для превращения п -толуидина в п -крезол по реакции замещения диазогруппы на гидроксигруппу. Ответ поясните написанием соответствующих реакций.
Задача 24.4. В каких превращениях бензолдиазоний-иона в качестве промежуточной частицы выступает фенил-катион? Приведите реакции, согласующиеся с фактом его образования.
Задача 24.5. Приведите примеры реакции Зандмейера. Какую роль в этой реакции выполняют частицы катализатора? Напишите реакции, подтверждающие ее механизм.
Задача 24.6. Предложите оптимальный способ превращения п -толуиловой кислоты в 4-метил-2-хлорбензойную кислоту
Задача 24.7. Предложите оптимальный способ превращения 14С-бензойной кислоты в 14С- п -нитробензойную кислоту
Задача 24.8. Предложите оптимальные схемы следующих превращений
Задача 24.9. Предложите оптимальную схему синтеза из п -нитроанилина следующих соединений: а) 3,4,5-триброманилина; в) 3,5-дихлоранилина; б) 2,6-дихлор-4-нитроанилина; г) п -ацетамидофенола.
Задача 24.10. Предложите оптимальные схемы следующих превращений: а) п -фторацетофенона из бензола; б) 1-хлор-2-фтор-3,5-диметилбензола из м -ксилола; в) о -хлор- трет- бутилбензола из бензола; г) п -диметиламинометилбензонитрила из бензола.
Задача 24.11. Завершите следующую реакцию
Поясните строение ее продукта написанием его резонансных структур.
Задача 24.12. Почему бензолдиазоний-ион рассматривается в качестве активной формы, бензолдиазогидрат – в качестве пассивной формы, а бензолдиазотат – в качестве неактивной формы диазосоединения? Ответ поясните написанием взаимных превращений названных частиц.
АРОМАТИЧЕСКИЕ СОЛИ ДИАЗОНИЯ
ПОЛУЧЕНИЕ Как уже отмечалось в гл. 23, ароматические соли диазония полу-чают реакцией диазотирования – взаимодействием первичных ароматичес-ких аминов с натриевой солью азотистой кислоты в присутствии минеральной кислоты. Общее уравнение реакции диазотирования имеет вид:
При использовании в качестве минеральной кислоты соляной кисло-ты диазотирование протекает следующим образом. На первой стадии при взаимодействии нитрита натрия с соляной кис-лотой образуется азотистая кислота.
В солянокислой среде азотистая кислота образует нитрозилхлорид, кото-рый и является диазотирующим агентом.
Собственно диазотирование протекает по следующей схеме:
В отличие от алифатических диазоний-ионов ароматические диазо-ний-ионы стабилизированы сопряжением диазониевой группы с аромати-ческим ядром. Вследствие этого, при 0-5оС (а в виде солей с комплексными анионами - и при комнатной температуре) они являются вполне устойчивыми соединениями. Как видно из схемы, первичный амин вступает в реакцию диазотиро-вания в свободном состоянии, а не в виде соли, с которой в кислой среде он находится в равновесии:
На практике при проведении реакции диазотирования соблюдают следующие условия. 1). Реакцию проводят при 0-5оС, поскольку при более высокой температуре происходит разложение азотистой кислоты и соли диазония:
2). Применяют избыток минеральной кислоты (около 2.5-3 моль на 1 моль амина); при недостатке кислоты наблюдается образование диазоаминосоединений:
3) окончание диазотирования определяют по наличию избытка HNO2 про-бой с йодкрахмальной бумагой:
СТРОЕНИЕ АРОМАТИЧЕСКИХ СОЛЕЙ ДИАЗОНИЯ
Строение ионов диазония, например, иона бензолдиазония, выражается следующим набором резонансных структур:
Структура I, имеющая минимальную энергию, вносит наибольший вклад в резонансную стабилизацию бензолдиазониевого иона. Соответственно этой структуре, фрагмент C-N-N имеет линейное строение. Соли диазония обычно применяют в виде водных растворов, так как в сухом виде они взрывоопасны. Водные растворы солей диазония нейт-ральны, поскольку эти соединения являются солями сильных оснований и сильных кислот. Гидроксид диазония получают действием влажного оксида серебра на раствор соли диазония:
Бензолдиазонийгидроксид – очень неустойчивое соединение. Он быстро перегруппировывается в диазогидрат, который является ОН–кислотой. С избытком NaOH диазогидрат дает соль, называемую диазотатом:
Как показывают представленные превращения, арендиазониевые ионы можно рассматривать как двухосновные кислоты:
Поскольку К 2 >> К 1, арендиазогидроксид находится в равновесной смеси в весьма незначительном количестве. В целом, форма ароматического диазосоединения зависит от концентрации протонов в растворе. В кислом и нейтральном растворе равновесие смещено в сторону иона диазония, в щелочном растворе – в сторону диазотата. Ионы арендиазотатов, как и других соединений, содержащих C=N- и N=N-связи, могут существовать в син - и анти -формах. При подщелачивании соли арендиазония сначала образуется син -форма, которая медленно перегруппировывается затем в более стабильную анти -форму.
24.2.3. РЕАКЦИИ АРОМАТИЧЕКИХ СОЛЕЙ ДИАЗОНИЯ С ВЫДЕЛЕНИЕМ АЗОТА
Препаративное значение ароматических солей диазония столь велико, что некоторые химики называют их «реактивами Гриньяра» в химии ароматических соединений. Ряд реакций ароматических солей диазония протекают с разрывом связи Ar–N2. Этот разрыв проходит как гетеролитически, так и гомолитически, сопровождается замещением диазониевой группы и введением нового заместителя в ароматическое ядро.
|
||
|
Последнее изменение этой страницы: 2017-02-17; просмотров: 1308; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.016 с.) |

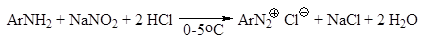

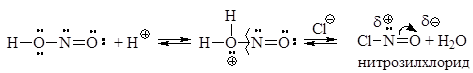


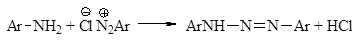


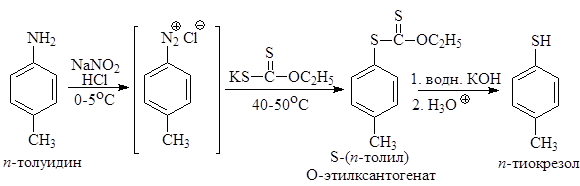
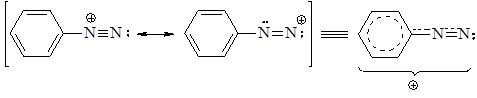

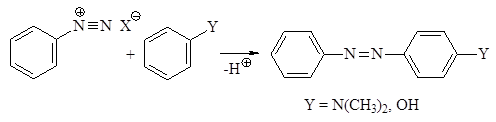
 Реакция азосочетания с феноксид-ионом протекает аналогично:
Реакция азосочетания с феноксид-ионом протекает аналогично: