
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
О-ацетилбензолдиазония п-карбоксибензолдиазония
2. Соединения типа 2 - " бензолдиазо-"
ацетат бензолдиазония ( ионная связь)
N-(м-хлорбензолдиазо)-анилин о-нитробензолдиазогидроксид п-толуолдиазотат калия ИЗОМЕРИЯ I. Структурная: положение заместителей в бензольном кольце (для соединений типа 1 и 2)
II. Пространственная: геометрическая ( цис- транс ) изомерия (для соединений типа 2)
Атом N в sp2-гибридизации, на образование π-связи предоставляет р-орбиталь с 1e-, sp2-орбитали с 2-мя е- - в плоскости N=N -группы. Орбиталь с неподеленной электронной парой - младший заместитель.
СПОСОБЫ ПОЛУЧЕНИЯ I. Получение солей диазония - реакция диазотирования (единственный способ получения). Это реакция AE/SЕ по атому азота.
1. Общая схема ArNH2 + NaNO2 + 2.5 HX → ArN2X + NaX + 2H2O HX = H2SO4, HCl, HBr, HClO4 2. Схема образования активной электрофильной частицы NaNO2 + 1 моль HX → HONO + NaX Азотистая кислота - неустойчивая, ее генерируют из смеси взаимодействием нитрита натрия и избытка минеральной кислоты.
Активные нитрозирующие частицы: азотистая кислота HNO2 азотистый ангидрид N2O3 нитрозацидий-катион H2NO2+ нитрозил-галогенид NO-Hal нитрозоний-катион NO+ Образование активной частицы зависит от кислотности среды и природы минеральной кислоты: в HCl – NOCl, в H2SO4разб. - N2O3, H2SO4кон. - NO+. Сила нитрозирующей частицы: NO+ > H2NO2+ > NOBr > NOCl > N2O3 >> HNO2
Алифатические. Ттребуются более сильные Е-нитрозирующие агенты, более кислые среды. Выбор реагента зависит от активности субстрата (амина).
Пример: составить пары для реакции диазотирования
ароматический амин
нитрозирующая смесь NaNO2 + HCl NaNO2 + H2SO4 активная частица NOCl NO+
Если Е = NO+, то механизм представлен в следующем виде:
Условия проведения реакции: а) расход кислоты: 1- ый моль - выделение азотистой кислоты; 2- ой моль - образование Е; избыток - стабилизация катиона диазония. Избыток кислоты ~ 2,5 молей, зависит от природы заместителя в бензольном кольце: Для соединений с акцепторами А - 2,6-2,8 молей, для соединений с донорами Д - 2,2-2,3 моля.
-образованию электрофила, -растворению амина, переводя его в соль аммония, -стабилизации образующейся соли диазония. Выбор рН среды - важный вопрос.
б) избыток NaNO2 способствует осмолению
в) конец реакции по индикатору - иодкрахмальной бумаге (крахмал, пропитанный иодидом): избыток HNO2 окислитель 2 HNO2 + 2 I- = I2 + 2 NO + 2 OH- небольшой избыток - исчезающее сине-фиолетовое окрашивание бумаги, большой избыток - неисчезающее темно-бурое окрашивание.
г) избыток свободного амина - побочный продукт взаимодействия с образующейся солью диазония. Твердые вещества, реакционная масса гетерогенна, требуется интенсивное перемешивание.
д) реакция сильно экзотермическая, а продукт реакции устойчив при низких температурах, требуется сильное охлаждение, точное соотношение реагентов, добавление раствора нитрита натрия по каплям.
|
|||||
|
Последнее изменение этой страницы: 2017-02-17; просмотров: 226; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.202.167 (0.008 с.) |
 бензолдиазоацетат (ковалентная связь)
бензолдиазоацетат (ковалентная связь) 


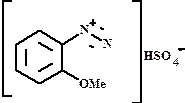
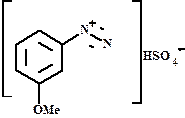 о- и м-метоксибензолдиазоний гидросульфат
о- и м-метоксибензолдиазоний гидросульфат м-метиламинобензолдиазоцианид
м-метиламинобензолдиазоцианид
 Ароматические амины - слабее как нуклеофилы, чем
Ароматические амины - слабее как нуклеофилы, чем




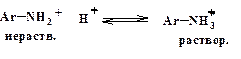 Кислая среда способствует
Кислая среда способствует



