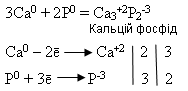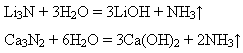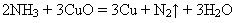Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Взаємодія неметалів із неметалами.
За певних умов неметали взаємодіють між собою, утворюючи сполуки з ковалентнимхімічним зв’язком, які називають за зазначеними вище правиламиноменклатури. У всіх випадках утворилися бінарні сполуки, формули таназви яких складають за такими загальними правилами: 1)зазвичай першим пишуть символ менш електронегативногоелемента (з позитивним ступенем окиснення), а після нього —більш електронегативного (з негативним ступенем окиснення); 2)першим зазначають у називному відмінку менш електронегативний елемент (елемент з позитивним ступенем окиснення); 3)якщо елемент проявляє змінну валентність, її зазначаютьу назві римською цифрою; 4)другою зазначають у називному відмінку назву або частинуназви більш електронегативного елемента (з негативним ступенемокиснення), тобто неметалічного, додаючи при цьому суфікси +ид або +ід. *складіть 5-6 рівнянь рекцій металів із неметалами на вибір Взаємодія неметалів з киснем *напишіть рівняння реакцій сульфуру,фосфору,азоту з киснем,визначте ступені окиснення елементів Взаємодія неметалів із воднем: При взаємодії більшості неметалів із воднем утворюються бінарні сполуки з ковалентним полярним хімічним зв’язком. *напишіть рівняння реакції сірки і хлору з воднем. Взаємодія неметалів з іншими неметалами. Окрім взаємодії з киснем і воднем, неметали взаємодіють такожз іншими неметаллами. *напишіть рівняння реакцій взаємодії неметалів між собою. * визначте ступені окиснення елементів у карбон(IV) сульфіді та силіцій(IV) хлориді. *якй тип зв’язку у сполуці металу з неметалом? Продуктами взаємодії двох неметалів є речовиниз різним агрегатним станом, що мають ковалентний типхімічного зв’язку, спільні електронні пари якогозміщуються до атома більш електронегативногонеметалічного елемента. Поширення неметалів у природі. Неметали більш поширені вприроді, аніж метали. До складу повітря входять: азот, кисень,інертні гази. Сірка утворює поклади самородної сірки. Родовищасамородної сірки в Передкарпатті — одні з найбільших у світі. Існують родовища графіту, дуже рідко трапляються алмази. Промисловим родовищем графіту в Україні є Заваллівське родовище, сировину якого використовує Маріупольський графітовий комбінат. У декількох регіонах України виявлені поклади порід, якіможуть містити алмази (зокрема, у Житомирській області, на Волині), проте промислові родовища поки що не відкриті. Значнобільше атомів неметалічних елементів утворюють різноманітніскладні речовини, серед яких домінують оксиди, солі.
Кисень Кисень відкрив К.В. Шеєле в 1772р і незалежно від нього -Дж.Прістлі в 1774р.Є у вільному стані в атмосфері,входить до складу води,оксидів,і солей,які утворюють тверду оболонку землі. *наведіть приклади сполук з відповідними ступенями окиснення
Фізичні властивості. Кисень – безбарвний газ, без смаку і запаху, мало розчинний у воді (у 100 об’ємах води при 20оС розчиняється близько 3 об’ємів кисню), трохи важчий за повітря (ρ=1,43 г/л). Добування кисню:
Хімічні властивості кисню *допишіть рівняння реакцій 1)взаємодіє з металами (за винятком золота, платини та платинових металів) з утворенням оксидів і пероксидів: 4Li + O2 = 6Na + 2O2 = 4K + 3O2 = 3Ba + 2O2 = 2Mg + O2 = 2Ca + O2 = 3Fe + 2O2 = 2)взаємодієзусіманеметалами (крімгалогенів) зутвореннямкислотнихабонесолетвірнихоксидів: S + O2 = 4P + 5O2 = 2C + O2 =
3)взаємодієізскладнимиорганічнимитанеорганічнимиречовинамизутвореннямоксидів:
На кисень припадає близько 49% маси земної кори,вміст у повітрі-21%,він входить до складу білків,жирів,вуглеводів. Застосування кисню: -випалювання сульфідних руд -для функціонування паливних печей -дихання -добування кислот -вмедицині Озон Молекула озону O3(OO2) складається з трьох атомів Оксигену. Один з атомів Оксигену виявляє ступінь окиснення +4 (О+4О2-2). Фізичні властивості. Озон – газ синього кольору із своєрідним різким запахом, розчинність у воді майже в 7 разів вища, ніж у кисню. Отруйний навіть у малих концентраціях. Хімічні властивості озону. Озон – дуже сильний окисник. Він дуже активний. Це пояснюється тим, що озон – нестійка сполука, він легко розкладається з утворенням атомів Оксигену:
O3 = O2+O.............2O = O2 Атоми Оксигену хімічно активніші за молекули кисню. Тому озон виявляє сильніші окисні властивості, ніж кисень окиснює плюмбум сульфід, перетворюючи його на сульфат:
витісняє йод із водного розчину йодидів – це якісна реакція на озон:
Добування озону. У лабораторії озон добувають дією електричних розрядів на кисень у приладах, що називаються озонаторами:
Якісна реакція на озон: 2KI+O3+H2O=I2+2KOH+O2 Властивості кисню й озону
Сульфур
Алотропні видозміни Сульфуру. Природною алотропною видозміною Сульфуру є ромбічна сірка. Це лимонно-жовта, крихка, кристалічна речовина без запаху, нерозчинна у воді. Назва пов’язана з тим, що її кристалимають форму октаедра зі зрізаними кутами. Молекула такої сірки складається з 8 атомів Сульфуру(у рівняннях реакцій послуговуються записом одного атома S).При температурі +119,5 °С ромбічна сірка плавитьс й перетворюється на моноклінну сірку — майже білі кристалічні пластинки. Ця алотропна видозміна Сульфуру нестійка і вже при температурі +95,6 °Сзнову перетворюється на ромбічну сірку.Якщо доведену до кипіння сірку (температуракипіння +444,6 °С) вилити в холодну воду, то під впливом різкого перепаду температур вона перетвориться на пластичну сірку. Пластична сірка має жовто-коричневий колір, ріжеться ножем, гумоподібна й еластична (витягується в нитки). На повітрі вона за кількаднів знову стає ромбічною сіркою. До досягнень сучасної хімії належить створення кластерних частинок. Кластер у хімії — це складне об’єднання атомів чи молекул, яке є самостійною частинкою йнаділене певними властивостями. Кластерні частинки з60–70 атомів Карбону дістали назву фулерени і вуглецевінанотрубки. З їх відкриттям набули стрімкогорозвитку нанотехнології У природі сірка трапляється у вільному стані (самородна сірка) і у вигляді різних мінералів:
Сірка входить до складу білків, тому без сірки неможливий розвиток рослин і тварин. Фізичні властивості. Сірка – тверда речовина жовтого кольору, не має металічного блиску, не проводить електричний струм, нерозчинна у воді, але розчиняється у сірковуглеці СS2 та інших органічних розчинниках. За стандартних умов стійкішою є ромбічна модифікація.
Застосування сірки. -виробництво сульфатної кислоти та сульфатів; -добування барвників, гуми, чорного пороху, сірників, ліків; -у сільському господарстві для боротьби зі шкідниками Добування сірки: 2H2S+O2=2S+2H2O 2SO2+4H2S=6S+4H2O FeS2=FeS+S Хімічні властивості сірки: За високих температур сірка взаємодіє з усіма речовинами, за винятком азоту, золота і платини, виявляючи, залежно від умов властивості окисника чи відновника: взаємодіє з металами з утворенням сульфідів:
взаємодіє з неметалами (за винятком азоту, йоду та інертних газів):
взаємодіє з окисниками і відновниками:
Карбон
Відомо кілька алотропних модифікацій Карбону – алмаз, графіт, карбін, фулерен. Це тверді речовини з атомними кристалічними гратками, які різняться будовою кристалів і фізичними властивостями. Алотропні видозміни Карбону
Існують ще так звані вуглецеві матеріали (раніше їх називали „аморфний вуглець”). До них належать кокс, деревне вугілля, сажа. Вони не є самостійними алотропними формами Карбону, оскільки вони мають таку кристалічну структуру як графіт, але кристали розміщені безладно. Сажу використовують як наповнювач для гуми і пластмас, пігмент для друкарської фарби, копіювального паперу, стрічки для друкарських машинок. Кокс використовують у металургії як паливо і відновник. Застосування деревного вугілля ґрунтується на його здатності притягувати до своєї поверхні молекули речовин із навколишнього середовища (вбирання на поверхні). Таке явище називають адсорбцією. Зрозуміло, що чим більша поверхня, тим сильніша адсорбція. Щоб збільшити поверхню вугілля, його активують - обробляють поверхню водяною парою для видалення з його пор сторонніх домішок і збільшення поруватості. Таке вугілля називають активованим. Активоване вугілля чудовий адсорбент (вбирник). Його використовують у промисловості для очищення газів, вловлювання цінних органічних розчинників, виготовлення протигазів, у медицині – для очищення крові і вбирання шкідливих речовин із шлунково-кишкового тракту. Вуглець Хімічні властивості Вуглець виявляє невисоку хімічну активність: більшість реакцій за його участю відбувається лише за високої температури. Найголовніша хімічна властивість вуглецю – його відновна здатність. Вуглець – чудовий відновник: взаємодіє з киснем. Вуглець легко горить на повітрі. При цьому виділяється багато теплоти, що свідчить про велику міцність зв’язків у молекулі карбон(IV) оксиду, що утворюється:
Продукт реакції залежить від температури. За порівняно невисоких температур горіння утворюється карбон діоксид (карбон(IV) оксид), а за високих (понад 1000OC) – поряд із карбон діоксидом утворюється карбон монооксид (карбон(ІІ) оксид):
взаємодіє з водою. Якщо на розжарений вуглець подавати водяну пару, то внаслідок реакції утвориться водяний газ – суміш карбон(ІІ) оксиду і водню:
Водяний газ використовують як сировину для синтезу хімічних продуктів. відношення до лугів та кислот. Вуглець стійкий до дії лугів і кислот. Лише концентровані сульфатна і нітратна кислоти за температури 100OC окиснюють його:
взаємодіє з металами з утворенням карбідів:
У реакціях вуглець виступає як окисник, що для нього не характерно. взаємодіє з воднем за високої температури і наявності каталізатора:
Прозорі алмази красивого синього, зеленого, червонуватого кольору надто рідкісні й оцінюються дуже високо. Чим більше граней має кристал, тим краще він «грає». Маса діамантів вимірюється каратами (1 карат = 0,2 г). Найбільший з будь-коли знайдених на Землі алмазів — це алмаз «Куллінан». Його знайшли у 1905 р. Назву він здобув від імені одного із володарів. До огранювання його розмір був з жіночий кулак і маса 3106 каратів, тобто 621 г. Під час обробки алмаз розкололи за напрямом тріщин, що були у ньому, і вирізали 105 діамантів. Найбільший серед них назвали «Зоряна Африка». Він має форму краплі і масу 530 каратів.
Цікаво, що серед індійських алмазів є славнозвісний «Шах» масою 89 каратів, яким перський уряд, щоб «уласкавити білого царя», розплатився за кров відомого російського дипломата і видатного письменника О. С. Грибоєдова, полеглого від рук розлюченого натовпу перських фанатиків у 1829 р. у Тегерані — столиці Персії. Розроблено штучне добування алмазів (1954 p., США) з графіту в умовах високих тисків і температур. Як правило, утворюються дрібні кристали. Їх використовують для виготовлення різальних інструментів і як опору для підшипників та інших рухливих частин у точних вимірювальних інструментах. Нині виробляються й синтетичні алмази ювелірної якості. Промисловий синтез алмазів — велике досягнення науки і техніки. *Який ступінь окиснення виявляє атом Карбону в молекулі метану СН4? Як ви гадаєте, окисником чи відновником у даному разі є вуглець. Чому для нього взаємодія з воднем нехарактерна? *Здійснити перетворення СaCI2 C → CO2→CO → CO2 → CaCO3 CO2 → H2CO3 Фосфор
Алотропні видозміни Фосфору. Серед алотропнихвидозмін Фосфору найбільш поширені: білий фосфор(молекулярна будова кристалічної ґратки), червоний і чорний фосфор (атомна будова кристалічної ґратки). Усівони — тверді речовини з кольором, зазначеним у назві.Змінюючи температуру, одну алотропну видозміну Фосфору можна за кілька годин перетворити на іншу.
У природі Фосфор трапляється тільки в сполуках. Найважливіші мінерали, до складу яких увіходить кальцій фосфат – це фосфорити й апатити. Ca3(PO4)2 Фосфор – життєво важливий елемент для організму людини, тварин і рослин. В організмі людини він виявлений у складі всіх тканин, особливо нервової і кісткової, входить до складу деяких ферментів, міститься в зубах. Хімічні властивості. Фосфор хімічно активніший ніж азот. Його активність залежить від алотропної форми. Найактивніший білий фосфор. Хімічна формула фосфору, умовна для всіх його алотропних форм, - Р. Взаємодіє з металами:
Фосфіди розкладаються водою – реакція гідролізу – з утворенням фосфінуРН3 (безбарвний газ, дуже токсичний, легко окиснюється на повітрі, має запах гнилої риби):
Взаємодіє з неметалами. З воднем фосфор практично не взаємодіє *напишіть рівняння реакції взаємодії фосфору з неметалами Взаємодіє з сильними окисниками:
Добування. Фосфор добувають із кальцій фосфату (складова фосфориту і апатиту) за допомогою піску і коксу. Суміш прожарюють в електропечах:
Використання. Білий фосфор широкого використання не має. Його застосовують для добування інших алотропних форм, фосфатних кислот, як бойову запалювальну речовину і для утворення димових завіс. Червоний фосфор: для виробництва сірників; у металургії як розкисник під час добування сплавів; для одержання феромагнітних плівок в елементах пам’яті обчислювальних машин; для добування напівпровідникових фосфідів; для добування фосфорорганічних препаратів – засобів знищення комах – шкідників сільськогосподарських рослин. У 1831 р. французький винахідник сірників Шарль Соріа почав застосовувати білий фосфор для виготовлення сірникових головок. Такі сірники легко займалися піц час тертя об будь-яку поверхню, але були отруйними, шкідливими для здоров'я і вогненебезпечними. Невдовзі від них відмовились. Сучасні безпечні сірники винайдено у 1855 р. в Швеції. Білий фосфор замінено червоним. Він входить не до складу головки сірника, а до складу намазки, що наноситься на коробку (разом із сульфідом стибію (III) Sb2S3, залізним суриком Fe203, домішкою кварцу SiO2 і клею). Головки сірників складаються, головним чином, з бертолетової солі КСl03, молотого скла, сірки та клею. Під час тертя головки по намазці сірникової коробки червоний фосфор займається, підпалює головку, а від неї загоряється дерево. Крім виробництва cірників, фосфор застосовують у металургії. Використовують його і для виготовлення напівпровідників, фосфорорганічних препаратів — засобів знищення комах — шкідників сільськогосподарських рослин. *Обчисліть, чи вистачить 100 л кисню (н. у.) для спалювання 100 г фосфору. Нітроген
Поширення в природі. Нітроген у складі азоту – основна складова повітря (w(N2) = 78%). У вигляді неорганічних сполук Нітроген у невеликих кількостях є в грунті. У вигляді складних органічних сполук – білків – він увіходить до складу всіх живих організмів, беручи участь у їх життєдіяльності. У вільному стані Нітроген існує у формі простої речовини – азоту. Азот. Молекулярна формула азоту N2 Фізичні властивості. Азот за стандартних умов – газ без кольору і запаху. Його молекули неполярні, тому взаємодія між ними дуже слабка, вона не може перешкодити їх хаотичному руху. Цим пояснюється газуватий стан азоту і це є причиною того, що азот зріджується (-196OC) і твердне (-210OC) за дуже низьких температур. У твердому стані має молекулярні кристалічні гратки. Неполярністю молекул азоту пояснюється низька розчинність його у воді (в 1 об’ємі води за 20OC розчиняється 0,0154 об’єми азоту). Він трохи легший за повітря, маса 1 л азоту дорівнює 1,25 г. Хімічні властивості. Молекула азоту має потрійний зв’язок між атомами Нітрогену (один σ -зв’язок і два π -зв’язки), він міцний і тому азот малоактивний. За звичайних умов він взаємодіє тільки з літієм, утворюючи літій нітрид:
З іншими металами азот сполучається за високої температури:
Нітриди металів, особливо лужних й лужноземельних – йонні сполуки, що належать до класу солей. Вони зазнають гідролізу, утворюючи гідроксид металу та амоніак:
За високих температур і тиску, а також наявності каталізатора азот взаємодіє з воднем, утворюючи амоніак:
З киснем азот сполучається за температури електричної дуги, понад 2000OC, утворюючи нітроген(ІІ) оксид:
Оскільки Нітроген у сполуках виявляє як позитивний, так і негативний ступінь окиснення, його проста речовина – азот – у реакціях може бути як окисником, так і відновником. Добування. У лабораторії азот одержують такими способами: а) під час нагрівання амоній нітриту або суміші концентрованих розчинів натрій нітриту і амоній хлориду:
б) під час розкладу амоніаку над купрум(ІІ) оксидом:
У промисловості азот добувають фракційною перегонкою зрідженого повітря. *Доведіть розрахунком, що азот трохи легший за повітря. *На кальцій кількістю речовини 1,5 моль за високої температури подіяли азотом кількістю речовини 1 моль. Які речовини в якій кількості можна виявити після закінчення реакції? Використання. Азот застосовують для: -добування амоніаку; -наповнення електричних ламп; -одержання сильного охолодження (пари рідкого азоту викликають сильне охолодження – у холодильних установках (рефрижераторах) для перевезення фруктів; для охолодження пошкодженого чорнобильського реактора навіть збудували завод для виробництва рідкого азоту).
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-07; просмотров: 713; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.188.40.207 (0.128 с.) |

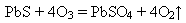

 Озон реагує так само як кисень,але реакції за його участі проходять енергійніше,тому що при його розкладі утворюється атомарний кисень: О3=О2+О
Озон реагує так само як кисень,але реакції за його участі проходять енергійніше,тому що при його розкладі утворюється атомарний кисень: О3=О2+О