
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Розв’язування розрахункових задач на надлишок та вихід продукту.
Відносна атомна маса Аr – це відношення маси атома даного елемента до 1/12 маси атома Карбону. Молярний об’єм – це фізична величина, що дорівнює відношенню об’єму речовини до його кількості. Для розв’язування задач на надлишок потрібно: Наприклад: До розчину, що містить 35 г нітратної кислоти, добавили 14 г кальцій оксиду. Визначте масу солі, що утворилася внаслідок реакції.
Вихід продукту – це відношення фактично добутого продукту до максимально можливого, обчисленого за рівнянням реакції.
|
|||||||||||
|
Последнее изменение этой страницы: 2017-02-07; просмотров: 281; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.36.141 (0.004 с.) |


 ,
, = 41 (г) Відповідь: маса одержаної солі склала 41г
= 41 (г) Відповідь: маса одержаної солі склала 41г
 ∙ 100% φ=
∙ 100% φ=  ∙100%
∙100%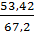 ∙ 100% = 78 % Відповідь: об’ємний вихід амоніаку становить 78%.
∙ 100% = 78 % Відповідь: об’ємний вихід амоніаку становить 78%.



