Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основні поняття електрохіміїСодержание книги Поиск на нашем сайте
Гальванічні елементи Загальні поняття по гальванічний елемент. Окисні та відновні процеси на електродах. Катоди і аноди. ЕРС Окиснювально-відновна реакція може відбуватися хімічним шляхом – коли електрони від відновника безпосередньо переходять до окисника. Енергія хімічної реакції в цьому процесі перетворюється на теплову. Якщо окиснювально-відновні процеси просторово відокремити, що відбувається у гальванічних елементах, то перехід електронів від відновника до окисника по зовнішньому провіднику спричинює виникнення електричного струму та перетворення хімічної енергії в електричну. Гальванічним елементом називається будь-який пристрій для безпосереднього перетворення хімічної енергії окиснювально-відновної реакції у електричну енергію. Гальванічний елемент складається з зовнішнього і внутрішнього кіл, електрохімічно з'єднаних між собою. До зовнішнього кола відносяться електричні дроти та електричні прилади (вимірювачі величини струму і напруги, споживачі або джерело струму, тощо). Внутрішнє коло складається з електродів, причому електроліти з'єднуються між собою напівпроникною мембраною або електролітичним містком. Електролітичний місток виготовляється з скляної або пластмасової трубочки, заповненої насиченим розчином КСl і з обох кінців закритої пористим матеріалом. Мембрани виробляються з різних матеріалів, наприклад, щільних тканин, полімерних плівок. Через них можуть переміщуватися іони, але не переміщуються молекули розчинника. У гальванічному елементі, потенціали електродів якого не дорівнюють один одному, процеси на електродах не будуть рівноважними. На одному з них, більш активному, обов’язково йде процес окиснення, на іншому (менш активному) - процес відновлення. Окиснювальна форма речовини (позначається Ох) завжди має у своєму складі атоми елемента з більшим ступенем окиснення, ніж у відновній (позначається Red). Слід нагадати, що кожна окиснювально-відновна реакція складається з двох напівреакцій − окиснення і відновлення. Коли реакція відбувається у гальванічному елементі, або здійснюється за допомогою електролізу, то кожна напівреакція відбувається на відповідному електроді, тому напівреакції називаються у цих випадках − електродними процесами або електродними реакціями. Розглянемо приклад гальванічного елементу (елемент Якобі – Даніеля, рис.2).
V 3 1 К (−) А (+) 2
Рис.2. Схема гальванічного елемента (елемент Якобі-Даніеля). 1 - цинковий електрод − цинкова пластина, занурена у розчин цинк сульфату; 2 - мідний електрод − мідна пластина, занурена у розчин купрум сульфату; 3 - електролітичний місток; 4 - вольтметр
У його зовнішньому колі електрони рухаються від аноду до катоду, тобто виникає електричний струм. Катод – це електрод, на якому відновлюються катіони або нейтральні молекули: Ох + n ē ® Red.
Сu+2 + 2ē ® Cu0 приклади катодних реакцій. 4H2O + 2ē ® H Анод - це електрод, на якому окиснюються катіони, аніони та нейтральні молекули: Red - n ē ® Ox.
4OH– - 4ē® O Zn0 - 2ē ® Zn+2 Катод– це завжди інертний електрод, на якому є надлишок електронів і які він віддає частинкам електроліту. Анод може бути інертним (неактивним) або активним. Інертний анод має достатньо велике значення електродного потенціалу (ним можуть бути, як правило, благородні метали та графіт) і тільки приймає на себе електрони від частинок електроліту, тобто служить для їх накопичення. Активний анод сам розчинюється і посилає катіони у розчин, тобто матеріал аноду безпосередньо приймає участь у окисному процесі: Zn0 - 2ē ® Zn2+. Віднесення електродів до певного типу залежить від співвідношення значень потенціалів обох електродів: функції катоду виконує електрод з більшим потенціалом, тобто jкат завжди більше, ніж jан. Наприклад, в елементі Якобі-Даніеля анодом буде цинк, а катодом - мідь тому, що потенціал першого значно менший. Рівняння електродних процесів, що відбуваються при роботі елемента Якобі-Даніеля, мають вигляд: К: Cu+2 + 2ē ® Cu0; A: Zn0 − 2ē ® Zn+2. При схематичному записі, що заміняє рисунок гальванічного елемента, межу розподілу між провідником першого роду і провідником другого роду позначають вертикальною рискою, а межу розподілу між провідниками другого − двома рисками. Наприклад, схема цього елемента буде така: (–)Zn|ZnSO4||CuSO4|Cu (+). Якщо необхідно, у схемі вказують і концентрації електролітів, наприклад: (–)Zn|ZnSO4, 1 М ||CuSO4, 0,1 М |Cu (+). Найголовнішою характеристикою гальванічного елемента є його електрорушійна сила - ЕРС (Е), яка дорівнює різниці потенціалів катода та анода Е = j кат - j ан. ЕРС завжди позитивна величина, тому що j кат > j ан.
Рівняння Нернста Незалежно від того, за яким шляхом, хімічним або електрохімічним, проходить реакція, енергетичні зміни у системі однакові. З курсу термодинаміки відомо, що максимальна робота виконується системою у рівноважному стані, тобто коли система є оборотною. Гальванічний елемент є оборотним, якщо виконуються дві умови: він складається з оборотних електродів; до нього підключено зовнішнє джерело електричного струму, ЕРС якого має протилежний напрямок і на нескінченно малу величину відрізняється від ЕРС самого елементу. При цих умовах -D G = А макс = n·E·F, де n - кількість електронів у сумарній електродній реакції; Е - ЕРС гальванічного елементу, В; F - число Фарадея (кількість електрики, яку переносить один еквівалент електронів): F = e NА, Кл/моль. З другого боку, зміна енергії Гіббса повязано з константою хімічної рівноваги рівнянням DG = -RT . ln K. В цьому випадку К - константа рівноваги відповідної окиснювальної реакції і дорівнює добутку рівноважних концентрації продуктів, поділеному на добуток рівноважних концентрацій вихідних речовин з урахуванням стехіометричних коефіцієнтів. Виходячи з цих рівнянь Нернст довів формулу для розрахунку потенціалів електродів. j = j 0 - 2,3 j = j 0 - Церівняння залежності потенціалу електроду від складу електроліту було виведено німецьким вченим Нернстомі носить його ім'я.
Типи електродів Електроди, які застосовують у електрохімії залежно від типу оборотності, числа і агрегатного стану фаз, поділяють на кілька груп. Деякі з них ми розглянемо. Електроди першого роду. До них відносяться метал-іонні та напівметал-іонні електроди. Найбільш поширені метал-іонні електроди. Наприклад, цинковий (Zn2+|Zn), мідний (Cu2+|Cu), залізний (Fe 2+|Fe ) електроди, у яких метал занурено у розчин власних іонів. Загальна електродна реакція має вигляд: Ме - n ē ® Ме n + Рівняння Нернста для них має вигляд: j (Ме n +|Me) = j 0(Me n +|Me) + Потенціал цих електродів залежить тільки від концентрації катіонів у електроліті, тому що концентрація самого металу практично не змінюється і є сталою. Ці електроди оборотні відносно катіону. Напівметал-іонні електроди менш поширені, наприклад селеновий електрод: Se0 + 2ē ® Se2- j = j 0 - Вони оборотні відносно аніону. Електроди другого роду. Вони складаються з металу, покритого нерозчинним осадом його сполуки (солі або гідроксиду) і зануреного у розчин, який містить такі ж аніони, як і осад. До них належать, наприклад, каломельний електрод і хлор-срібний електрод. Хлор-срібний електрод складається з срібного дротика, покритого шаром аргентум хлориду, який занурено у розчин калій хлориду. Електролітичний контакт із зовнішнім розчином відбувається крізь гніт з азбесту. Схема хлор-срібного електрода така: Ag,AgCl|KCl. Він оборотний відносно катіону Ag+ і аніону Сl- згідно з реакціями: Ag+ + ē ® Ag0 та AgCl + ē ® Ag0 + Cl-. Його потенціал залежить від концентрації КСl: j (1 н. КСl) = +0,237 В; j (0,1 н. КСl) = +0,29 В. У загальному вигляді в таких електродах встановлюється рівновага: МеАn (осад) ® Меn+ + A n -(розч) ® Ме0 + A n - + n ē. Концентрація катіонів залежить від добутку розчинності малорозчиненої речовини: [ Меn+] = Потенціал цих електродів визначається за формулою: φ = φ о + 0,059 / n lg [ А -n], де φ о = φ о (Меn+ / Me) + 0,059 / n lg ДР МеА Електроди другого роду використовують як електроди порівняння, замість не дуже зручного водневого електроду. Вони відрізняються простотою виготовлення і сталим значенням потенціалу. Газові електроди. Прикладом газового електроду є водневий електрод. До них відносяться також кисневий (Pt,O2/OH-) та хлорний (Pt,Cl2/2Cl-) електроди. Для виготовлення цих електродів використовують платиновий дротик, покритий шаром губчастої платини, яка має високу адсорбційну властивість. На поверхні розділу фаз встановлюються рівноважні процеси, які платина каталізує:
Н2 адс Û 2Н адс Û 2Н+ + 2е О Сl Потенціал газових електродів залежить від активностей окиснювальної та відновної форм речовини. Наприклад, при Р φ = – 0,059 рН Окиснювально-відновні електроди. До окислювально-відновних електродів (або редокс-електродів), належать напівелементи, які складаються з інертного металу (платина, золото), зануреного у розчин, в
якому містяться окислена та відновна форма однієї і тієї ж речовини. Наприклад: Pt, Fe3+ / Fe2+; Fe3+ + e = Fe2+ Pt, MnO Атоми платини не беруть участь у електродному процесі, а є тільки переносниками електронів. Величина електродного потенціалу залежить від концентрацій окиснювальної та відновної форм речовини: φ = φ о + 0,059/n lg ([ Oх ]/ [ Red])
φ = φ о + 0,059/ 1 lg [ Fe3+] / [Fe2+];
φ = φ о + 0,059 /5 lg [MnO4-] [H8+] / [Mn2+]
Стандартні окиснювально-відновні потенціали зведені у таблиці і також визначаються за водневою шкалою, тобто порівнюються зі стандартним водневим електродом. Вони характеризують здатність системи функціонувати в якості окисника або відновника. Чим більш позитивне значення ОВ потенціалу, тим сильнішим окисником є система. Знак (–) означає, що самодовільно відбувається процес відновлення, знак (+) – процес окиснення. Наприклад:
Використання розрахунку ЕРС для окиснювально-відновних кіл дає можливість визначити напрямок окиснювально-відновної реакції незалежно від того, хімічним, або електрохімічним шляхом вона йде. Враховується, що відновна реакція відповідає анодному процесу, а окиснювальна реакція – катодному. Тоді: ЕРС = φ кат – φ ан = φ окис – φ від > O. Наприклад: Визначити, у якому напрямку буде відбуватися реакція Sn2+ + Pb4+ Û Sn4+ + Pb2+ Знайдемо по таблиці значення стандартних потенціалів даних ОВР: Sn4+ +2e Û Sn2+; φ o = 0,15 В – анод Pb4+ + 2e ÛPb 2+; φ o = 1,69 В – катод ЕРС = φ кат – φ ан = 1,69 – 0,15 = 1,54 В, тобто реакція відбувається за прямим напрямком. Іоноселективні електроди. Іоноселективними звуться електроди, потенціал яких залежить від концентрації (активності) певного виду іонів (потенціалутворюючих іонів).Вони складаються з пластмасового або скляного корпусу, внутрішнього допоміжного інертного електроду, який занурено у розчин певної концентрації досліджених іонів і мембрани, розташованої на кінці корпусу, яка контактує з дослідженим розчином і розчином певної концентрації. Мембрана – основна складова частина електроду. Такі електроди часто називають мембранними і класифікують за типом мембрани: скляні, кристалічні, рідкі та плівкові. Мембрани вміщують електродно-активні речовини, які забезпечують процес селективного обміну іонами між мембраною та розчином. При зануренні іоноселективного електрода у досліджуваний розчин, виникає потенціал, величина якого залежить від активності потенціалутворюючих іонів. До цих електродів належить скляний електрод для вимірювання рН. Він складається з скляного корпуса, до якого припаяна куляста мембрана з електродного скла. У середину корпуса заливають розчин НСl з певною концентрацією та занурюють допоміжний хлорсрібний електрод. Електродне скло мембрани є сплавом силікатів лужних та лужноземельних металів. Потенціал скляного електрода лінійно залежить від рН розчину: φ = φ о – 0,059 рН. φ о залежить від сорту електродного скла і змінюється з часом, тому перед застосуванням їх калібрують за стандартними розчинами відповідних електролітів.
Електроліз Поляризація електродів Поляризацією називається зміщення потенціалу електродів від рівноважних значень при проходженні крізь електрохімічну систему електричного струму (відбувається при електролізі та у гальванічних елементах). Існує два типи поляризації – концентраційна та електрохімічна. Концентраційна поляризація зумовлена тим, що швидкість дифузії гідратованих іонів менше, ніж швидкість електрохімічних процесів. Цю поляризацію можна зменшити перемішуванням і нагріванням. Електрохімічна поляризація зумовлена неоднаковою швидкістю руху іонів у електролітах та електронів у провідниках. Вона залежить від природи провідників, стану їх поверхні та густини струму на електроді. Чим більше густина струму, тим більше поляризація. Для зменшення електрохімічної поляризації реальну площину поверхні збільшують, використовуючи пористі та губчасті електроди. Катодна поляризація зміщує потенціал катоду до більш негативних значень, анодна поляризація зміщує потенціал аноду до більш позитивних значень. При електролізі процеси поляризації залежать від густини струму на електродах. Густина струму і (D) – це відношення величини струму, якій подається у електролізну ванну, до площини поверхні електроду, тому у загальному випадку і кат = і ан: і (D) = I / S (А/дм2) Перенапругою потенціалу електроду, або просто перенапругою h називається різниця потенціалів поляризованого електроду і електроду у рівноважному стані при даній густині струму: h = φ 0 – φ рівн Катодна перенапруга завжди має знак мінус, анодна – знак плюс. Особливе значення має перенапруга відновлення водню, оскільки у водному розчині завжди є іони водню. Вона залежить від матеріалу електрода і стану його поверхні, значення рН, температури. Для деяких електродів вона досягає –2,0 В. Найменша вона на губчастому платиновому електроді (φ 0 = φ рівн). Для більшості іонів металів при умові відновлення на електроді тієї ж природи і невеликих значеннях густини струму перенапруга незначна.
Процеси на електродах Порядок розряду іонів на електродах залежить від значення рівноважного потенціалу (φ рів) і від перенапруги. На катодах у першу чергу відновлюються катіони з більшим значенням електродного потенціалу та з найменшим негативним значенням перенапруги. На анодах спочатку окиснюються іони з меншим значенням потенціалу та з найменшим позитивним значенням перенапруги. Процеси на катодах. При електролізі кислот, солей і основ на катодах відновлюються катіони металів і водню (з води або кислот) за наступними правилами: 1. Метали, які стоять у ряді напруг після водню завжди відновлюються з водних розчинів та розплавів у порядку зменшення їх потенціалів φ і. Сu2+ + 2e = Cu0; φ 0 = + 0,34 В; 2. Метали, які стоять у ряді напруг до алюмінію включно відновлюються тільки з розплавів Na+ + 1e = Na0; φ 0 = –2,70 В. З водних розчинів замість них відновлюється водень з води, тому що їх потенціал значно менше потенціалу відновлення водню: 2Н2О + 2е = Н або в кислих середовищах 2Н+ + 2е = Н 3. Метали, які стоять у ряді напруг від алюмінію до водню теоретично можуть відновлюються на катоді разом з воднем. У більшості випадків реакцію відновлення водню можна довести до мінімуму збільшенням перенапруги іонів водню. Fe2+ + 2e = Fe o; φ і = – 0,44 В; Zn2+ + 2e = Zn0; φ 0 = – 0,76 В. Процеси на анодах. На анодах відбуваються процеси, які характеризуються найменшим значенням потенціалу. Вони відбуваються згідно з наступними правилами: 1. Розчинні аноди окиснюються з утворенням відповідних іонів металів: Znо – 2e = Zn2+; φ 0 = – 0,76 В. 2. На нерозчинних анодах відбувається процес окиснення компонентів електроліту згідно зі значеннями потенціалів реакцій: а) якщо у електроліті є аніони без кисневих кислот, вони окиснюються у першу чергу (крім іонів F–) 2Cl– – 2e = Cl 2І– – 2e = І б) якщо у розчині є іони кисневмісних кислот, то вони не окиснюються на аноді внаслідок великого значення їх електродних потенціалів. Замість них на аноді розряджаються молекули води з виділенням кисню: 2SO 2H2O – 4e = O в) у випадку лужного середовища (наявність іонів ОН-) проходить реакція окиснення гідроксид-іонів: 4ОН- - 4ē = О Наведемо декілька прикладів. 1. Електроліз розплаву NaCl. K: Na+ +1e = Na0 А: 2Сl- - 2e = Cl 2. Електроліз розчину NaCl. К: 2Н2О – 2е = 2Н+ + 2ОН- на аноді можливо два процеси: А: 1. 2Н2О – 4е = О2 + 4Н+; φ рівн = 1,23 В; h = 0,45 В; φ 0 = 1,23 + 0,45 = 1,68 В; 2. 2Cl– – 2e = Cl φ 0 = 1,36 + 0,16 = 1,52 В. У даному випадку на аноді будуть окиснюватися іони хлору, тому що реальний потенціал окиснення хлору менше, ніж потенціал окиснення води. 3.Електроліз розчину Na2SO4 (інертні аноди): К: 2Н2О + 2е = Н А: 2Н2О – 4е = О В результаті електролізу цієї солі буде відбуватися розкладення води і концентрація солі зростає. 4. Електроліз солі CuSO4 з розчинними мідними анодами А: Сu0–2e = Cu 2+ K: Cu2+ + 2e = Cu0. В результаті електролізу мідний анод розчинюється, на катоді відновлюється мідь, тобто відбувається перенос речовини міді з аноду на катод. 5. Електроліз солі CuSO4 з нерозчинними анодами К: Сu2+ + 2e = Cu0 А: 2Н2О – 4е = О Розв'язання типових задач Гальванічні елементи Задача 1. Розрахувати потенціал водневого електрода з концентрацією [Н+] = 10-3 М. Розв'язання: 1. рН -? рН = – lg[Н+] = – lg10-3 = 3. 2. j(2Н+½Н2) -? j 2Н+½Н2= - 0,059 рН = - 0,059 . 3 = – 0,0177 В. Відповідь: потенціал водневого електроду при рН = 3 дорівнює – 0,0177 В. Задача 2. Розрахувати потенціал залізного електрода, зануреного у 0,1 М розчин ферум(ІІ) хлориду. Розв'язання: Для розрахунку потенціалу в таблиці знаходимо значення стандартного потенціалу (j0Fe+2½Fe0= – 0,44 В) і використовуємо формулу Нернста: jFe+2½Fe0 = j0Fe+2½Fe0 + 0,059 / 2 . lg C (Fe+2) = - 0,44 + 0,059/2 lg10-1 = -0,44 -0,03 = - 0,47 В. Відповідь: потенціал залізного електрода дорівнює - 0,47 В. Задача 3. Розрахувати потенціал окиснювально - відновного манганового електрода, якщо концентрації перманганат-іона та іона Mn+2 дорівнюють одиниці, а рН розчину - 3. Розв¢язання: 1.jМnO4-+8H+зMn2++4H2O-? Використовуємо значення стандартного потенціалу, взятого з таблиць і рівняння Нернста для окиснювально-відновних електродів. j0МnO4-+8H+зMn2++4H2O= 1,55 В. jМnO4-+8H+зMn2++4H2 = j0МnO4-+8H+зMn2++4H2O+ = 1,55 + Відповідь: потенціал манганового електрода у розчині з рН 3 дорівнює 1,27 В. Задача 4. Розрахувати гальванічний елемент, складений з цинкової пластини, зануреної у розчин цинк сульфату з концентрацією 10-3 моль/л та залізної пластини, зануреної у розчин ферум хлориду з концентрацією 10-1 моль/л. Розв'язання: 1. jZn2+|Zn, jFe2+|Fe-? В таблиці стандартних потенціалів знайдемо значення стандартних електродних потенціалів систем Zn2+|Zn0 та Fe2+|Fe0 і розрахуємо потенціали окремих електродів за рівнянням Нернста. j0Zn2+|Zn0== - 0,76 B, j0Fe2+|Fe0= - 0,44 B. jZn2+|Zn0 = j0Zn2+|Zn0 + (0,059 / 2) lg С (Zn2+) = - 0,76 + (0,059 / 2) lg 10-3 = = - 0,76 + (- 0,09) = - 0,85 В. jFe2+|Fe0= j0Fe2+|Fe0+ (0,059 / 2) lg С (Fe2+) = - 0,44 + (0,059 / 2) lg 0,1 = = - 0,44 + 0,03 (-1) = - 0,47 В. 2.Визначення катода і анода.
Цинковий електрод буде анодом, оскільки має більш від¢ємний потенціал, залізний електрод буде катодом (більша алгебраїчна величина потенціалу).
(-) Zn |Zn(NO3)2 (10-3 М) || Fe(NO3)2 (0,1 М)| Fe (+). 4. Електродні процеси. А: Zn0 - 2е ® Zn2+; на цинковому електроді відбувається процес окиснення цинка. К: Fe2+ + 2e = Fe0; на залізному електроді відбувається відновлення заліза. 5. ЕРС -? Е = jFe2+|Fe0 - jZn2+|Zn0 = - 0,47 – (-0,85) = 0,38 В. 6. D G 0 -? D G 0 = – Аmах – nEF = – 2 0,38 96500 = – 73340 Дж/моль Відповідь: ЕРС елемента дорівнює 0,38 В, D G 0 = – 73340 Дж/моль. Задача 2. Складіть схеми електролізу водних розчинів:а) купрум (ІІ)сульфату; б) магній хлориду; в) калій сульфату. В усіх випадках електроліз проводиться з використанням вугільних електродів. Розв' язання: а) у розчині купрум (ІІ) сульфату дисоціює на іони:
Іони купруму (ІІ) можуть відновлюватися на катоді у водному розчині. Сульфат-іони у водному розчині не окиснюються, тому на аноді відбуватиметься окиснення води. Схема електролізу:
або
б) дисоціація магній хлориду у водному розчині:
Іони магнію не можуть відновлюватися у водному розчині (відбувається відновлення води), хлорид-іони — окиснюються. Схема електролізу:
або
в) дисоціація калій сульфату у водному розчині: K2S04 = 2К+ + SO2-4. Іони калію і сульфат-іони не можуть розряджатися на електродах у водному розчині, отже, на катоді відбуватиметься відновлення, а на аноді — окиснення води. Схема електролізу:
або, враховуючи, що 4Н+ + 40Н – = 4Н20 (здійснюється при перемішуванні),
Задача 3. Під час електролізу водного розчину калій гідроксиду з інертними електродами на катоді виділився водень об'ємом 11,2 л (нормальні умови). Розрахуйте об'єм кисню, який виділився при цьому на аноді. Розв'язання: Записуємо рівняння електролізу, враховуючи, що на катоді відновлюється вода (катіони калію не відновлюються при електролізі водних розчинів), а на аноді окиснюються гідроксид-іони:
або
Визначаємо кількість речовини водню, що виділився:
Із рівняння реакції випливає, що
Обчислюємо об'єм кисню, що виділився: V(O2) = n (O2)Vm; V(O2)= 0,25×22,4=5,6(л). Питання і задачі
1. Що називається електродами? Які реакції відбуваються на них? 2. Що трапиться, якщо активний або неактивний метал занурити у розчин власної солі? 3. Дати визначення поняттям «потенціал» і «стандартний потенціал». Як вони експериментально вимірюються і розраховуються? 4. Намалювати схему і пояснити дію водневого електрода. 5. Яка формула встановлює залежність значення електродного потенціалу від концентрації електроліту? 6. Дайте визначення поняттю «гальванічний елемент». З чого він складається? 7. Охарактеризуйте катоди і аноди у гальванічному елементі. 8. Наведіть умови оборотності гальванічного елемента. При якому стані його виконуються умови -D G 0 = А макс = nEF. 9. Що таке ЕРС гальванічного елемента і за якою формулою розраховується ця характеристика? 10. Які типи гальванічних елементів ви знаєте? Чим вони відрізняються? 11. Навести приклади концентраційного гальванічного елемента. 12. Скласти схеми гальванічних елементів, в одному з яких мідь була б анодом, а у іншому - катодом. Написати рівняння реакцій, які відбуваються на електродах при роботі цих гальванічних елементів та розрахуйте ЕРС, використавши стандартні значення потенціалів. 13. Гальванічний елемент складається з срібного електрода, зануреного у 1 M розчин AgNО3, та стандартного водневого електрода. Визначити його ЕРС. Написати електродні та сумарну реакції, які відбуваються у гальванічному елементі. 14. Напишіть схему концентраційного гальванічного елемента, складеного з цинкових електродів. Концентрація іонів цинку у розчинах дорівнює відповідно 0,1 та 0,5 моль/л. Розрахувати ЕРС та максимально корисну роботу, яку виконує цей гальванічний елемент. 15. У якому напрямку будуть рухатись електрони у зовнішньому колі наступних гальванічних елементів: а) Mg|Mg+2||Pd+2|Pb; б) Pb|Pb+2||Cu+2|Cu; в) Cu|Cu+2||Ag+|Ag, якщо всі розчини електролітів одномолярні? Розрахуйте ЕРС цих елементів. 16. Розрахувати потенціал мідного електрода у розчині Сu(NО3)2 з концентрацією іонів Сu+2 0,12 моль/л. Скласти з цього і стандартного мідного електродів гальванічний елемент та розрахувати його DG0. Як зветься такий гальванічний елемент? 17. Що називається електролізом? 18. Які бувають типи поляризації? 19. Чим зумовлена концентраційна поляризація? 20. Від чого залежіть електрохімічна поляризація? 21. Що таке перенапруга і як вона впливає на потенціал конкретної реакції? 22. Поясніть, чому особливе значення має перенапруга виділення водню для електролізу водних розчинів і від чого вона залежить? 23. Сформулюйте правила відновлення на катодах. Від чого залежать ці процеси? 24. Сформулюйте правила окиснення на анодах. Які процеси можуть відбуватися на розчинних і нерозчинних анодах? Чим вони зумовлені? 25. Записати схеми електролізу наступних розплавів: КСl, NaBr, MgCl2, RbI. 26. Записати схеми електролізу наступних розчинів з нерозчинними анодами: K2SO4, MgSO4, CuCl2, NiBr2, FeCl2, Na2SO4 +CuI2. 27. Записати схеми електролізу наступних розчинів з розчинними анодами: FeCl2, CuCl2, NiSO4, Co(NO3)2, AuCl3. 28. Крізь розчин ZnСl2 пройшло 96500 Кл електрики. При цьому маси виділених цинку та хлору відповідно дорівнюють 19,61 та 6,20 г. Записати електродні процеси та розрахувати вихід за струмом. 29. При електролізі солі двовалентного металу струмом силою 1 А протягом 2 год виділилось на катоді 2,219 г металу. Визначити цей метал. Список рекомендованої літератури
1. Гельфман М.И., Юстратов В.П. Химия. – С.-Пб.: Изд-во «Лань», 2000. – 480 с. 2. Глинка Н.Л. Задачи и упражнения по общей химии. – Л.: Химия, 1998. 3. Григор'єва В.В., Cамійленко В.М., Сич А.М. Загальна хімія. – Київ: Вища школа., 1991. 4. Романцева З.Л., Лещинская Л.М., Суханова В.А. Сборник задач и упражнений по общей химии. – М.: Высшая школа, 1991. 5. Угай Я.А., Общая химия. – М.: Высшая школа, 2000. – 547 с. Зміст
1 2
+ − − + − + + − + − − + − + + − + − − + − + + − + − − + − + + − + − − + − + + −
3 3 а б Рис. 1. Перерозподіл зарядів біля поверхні розділу фаз: а – електрод з активного металу (1); б – електрод з неактивного металу (2), занурених у розчини електролітів (3).
V 3 1 К (−) А (+) 2
Рис.2. Схема гальванічного елемента (елемент Якобі-Даніеля). 1 - цинковий електрод − цинкова пластина, занурена у розчин цинк сульфату; 2 - мідний електрод − мідна пластина, занурена у розчин купрум сульфату; 3 - електролітичний місток; 4 - вольтметр
Основні поняття електрохімії Електрохімія – розділ хімії, що вивчає фізико-хімічні процеси, що супроводжуються появою електричного струму або, навпаки, відбуваються під дією на хімічні сполуки електричного струму. Електродом називається електронно-провідна фаза − провідник першого роду (метали, графіт або напівпровідники), що контактує з іонним провідником − провідником другого роду (розчини або розплави електролітів). У провідниках першого роду електричний струм виникає завдяки напрямленого руху електронів, у електролітах – завдяки руху іонів, причому електрони не можуть рухатись у електролітах, а іони – у металах, тому на поверхні розділу фаз у електрода відбуваються реакції особливого типу, що мають назву електрохімічних. Електрохімічні реакції – це окисно-відновні реакції, що відбуваються під час обміну електронами між провідниками першого роду і частинками електроліту – іонами та молекулами. У металах і графіті у вузлах кристалічної решітки знаходяться катіони, між якими відносно вільно рухаються електрони, причому сумарний позитивний заряд іонів металів дорівнює кількості електронів. Якщо провідник першого роду занурити у електроліт, то на межі розділу фаз виникає перерозподіл позитивних та негативних зарядів, що несуть іони і електрони, а також з’являється напрямлена орієнтація диполів, при цьому одна з фаз завжди заряджується позитивно, інша – негативно. Розглянемо два випадки цього процесу, звертаючи уваг
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-06; просмотров: 341; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.72.55 (0.017 с.) |

 4
4 2Н+ + 2ē ® Н
2Н+ + 2ē ® Н 
 Fe+2 - 1ē ® Fe+3
Fe+2 - 1ē ® Fe+3
 = 0,059(2,3 – основа натурального логарифму), тому для температури 298 К рівняння можна спростити
= 0,059(2,3 – основа натурального логарифму), тому для температури 298 К рівняння можна спростити
 lg [Me n +].
lg [Me n +]. lg [Redn-] = j 0-
lg [Redn-] = j 0- 
 = 101,3 кПа потенціал водневого електроду розраховується за формулою.
= 101,3 кПа потенціал водневого електроду розраховується за формулою. + 8H+ / Mn2+ + 4H2O; MnO
+ 8H+ / Mn2+ + 4H2O; MnO  – 2e = S2O
– 2e = S2O  lg
lg  =
= = 1,55 +
= 1,55 + 
 А К
А К
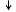

 3. Схема гальванічного елемента і напрямок електричного струму.
3. Схема гальванічного елемента і напрямок електричного струму. .
. ,
, .
. .
. ,
, .
. ,
, .
. ,
, .
.