Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Восстановление – процесс присоединения электронов, сопровождающийся понижением степени окисления.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Окислитель – атом или ион, который принимает электроны, а сам восстанавливается. Восстановитель – атом или ион, который отдает электроны, а сам окисляется. Вещества, в которых элемент находится в высшей степени окисления, являются только окислителями:
Процессы окисления и восстановления протекают всегда одновременно, при этом число электронов, отданных восстановителем, должно быть равно числу электронов, принятых окислителем. На этом основан подбор коэффициентов в уравнениях ОВР методом электронного баланса. Метод электронных уравнений Пример. Ответ. • Видно, что степень окисления изменилась у марганца и серы: марганец был +7, стал +2, сера была –2, стала 0. • Отражаем эти изменения степени окисления в электронных уравнениях и определяем элемент-окислитель и элемент-восстановитель:
Слева от электронных уравнений проводим вертикальную черту и проставляем коэффициенты, соответствующие числу электронов, отданных восстановителем и принятых окислителем. Множители перед вертикальной чертой «5» и «2» и есть основные коэффициенты перед окислителем и восстановителем. • Переносим найденные основные коэффициенты при восстановителе и окислителе в заданную схему реакции:
• Находим коэффициенты при других реагирующих веществах в следующем порядке: металлы, кислотные остатки (или неметаллы), водород, кислород. • Правильность подбора коэффициентов проверяем равенством атомов кислорода в обеих частях уравнения: 2KMnO4 + 5H2S + 3H2SO4 = 2MnSO4 + 5S + K2SO4 + 8H2O. Обычно этот метод применим для уравнивания ОВР, протекающих между газообразными, твердыми или жидкими веществами без их электролитической диссоциации. Если реакция протекает в растворе используют метод ионно-электронный или метод полуреакций.
Опыт 1. Влияние среды на продукты ОВР а) Налить в пробирку 10 капель перманганата калия, подкислить 5 каплями серной кислоты и добавить один микрошпатель сульфита натрия. Наблюдения: Вывод: б) Налить в пробирку 10 капель перманганата калия, создать щелочную среду добавив 5 капель гидроксида натрия и добавить один микрошпатель сульфита натрия. Наблюдения: Вывод: в) Налить в пробирку 10 капель перманганата калия и добавить один микрошпатель сульфита натрия. Наблюдения: Вывод: Составить уравнение реакции, уравнять методом электронного (электронно-ионного) баланса. Опыт 2. Окислительные свойства дихромат иона а) Налить в пробирку 10 капель дихромата калия, подкислить 5 каплями серной кислоты и добавить один микрошпатель сульфата железа (II). Наблюдения: Вывод: б) Налить в пробирку 10 капель дихромата калия, подкислить 5 каплями серной кислоты и добавить 5 капель иодида калия. Наблюдения: Вывод: Составить уравнение реакции, уравнять методом электронного (электронно-ионного) баланса. Литература 1. Коровин Н.В. Общая химия — М: Академия, 2011. 2. Гельфман М.И. Неорганическая химия. -С.Пб., Лань. 2007 3. Вассель Н.П. Неорганическая химия: Учебно-методическое пособие. Курс лекций. Ростов н/Д, 2001 4. Вассель Н.П. Комплексные соединения: Учебно-методическое пособие. Ростов н/Д, 2001. 5. Вассель Н.П. Химическая кинетика и равновесие: Методические указания по выполнению лабораторных работ. Ростов н/Д, 2001. 6. Вассель Н.П. Гидролиз солей: Методические указания по выполнению лабораторных работ. Ростов н/Д, 2001.
|
||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 523; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.41 (0.006 с.) |

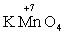 ,
,  ,
,  ,
,  .
. ,
,  ,
,  .
. ,
, 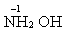 ,
,  , HNO2
, HNO2