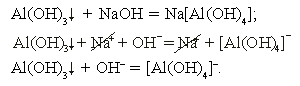Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Реакции, протекающие между растворенными в воде веществами за счет обмена составляющих их ионов, называются ионными реакциями обмена.
Такие реакции протекают необратимо, если образуются: При написании реакций ионного обмена следует составить: а) Молекулярное уравнение, в котором все исходные вещества и продукты реакции записываются в виде молекул. б) Полное ионное уравнение, в котором все молекулы сильных электролитов записываются в виде ионов, а молекулы слабых электролитов (в том числе и Н2О) и неэлектролитов – в виде молекул. Продукты реакции ионного обмена образуются за счет электростатического притяжения положительно заряженных частиц одной молекулы и отрицательно заряженных частиц другой. 1. Реакции, протекающие за счет образования малорастворимых веществ:
Реакция необратима за счет образования не растворимого в воде фосфата меди. б) нитрат свинца + хромат калия
Реакция необратима за счет образования нерастворимого в воде хромата свинца. 2. Реакции, протекающие за счет образования газообразных веществ:
Реакция необратима за счет образования газообразного вещества сероводорода.
Реакция необратима за счет образования слабодиссоциирующего вещества – уксусной кислоты.
Растворение осадка гидроксида алюминия происходит в избытке щелочи (за счет амфотерных свойств). Реакция необратима за счет образования слабого электролита – комплексного иона [Al(OH)4]–. Изучив теоретический материал, приступают к экспериментальной части. Экспериментальная часть Опыт 1. Получение малорастворимых веществ. а) В одну пробирку внесите 5—6 капель сульфата меди, в другую — хлорида железа (III). Добавьте в обе пробирки по 5—6 капель 2 н. раствора гидроксида натрия. Наблюдение. Укажите цвет полученного осадка. Вывод. Объясните, почему протекает данная реакция.
б) К 5—6 каплям раствора нитрата (хлорида) бария добавьте несколько капель 2 н. раствора серной кислоты. Наблюдение: Вывод: в) К 2—3 каплям раствора нитрата серебра добавьте 2—3 капли раствора хлорида натрия. Наблюдение: Вывод: г) К раствору нитрата свинца прилейте раствор иодида калия. Наблюдение: Вывод: Приведите уравнения реакции в молекулярном, ионном полном и сокращенном виде. Опыт 2. Реакции с образованием газов а) К 10-15 каплям раствора карбоната натрия добавьте несколько капель 2 н. раствора серной кислоты. Наблюдение: Вывод: б) В пробирку поместите 2 микрошпателя хлорида аммония (сухая соль) и добавьте 5—6 капель 2 н. раствора гидроксида натрия. Определите по запаху, какой газ выделяется. Наблюдение: Вывод: Приведите уравнения реакций в молекулярном, ионном полном и сокращенном виде. Опыт 3. Реакции с образованием малодиссоциирующих веществ а) Поместите в пробирку 2 микрошпателя ацетата натрия (сухая соль) и добавьте 10—15 капель раствора соляной кислоты (2 и.). Определите позапаху, какое соединение получилось. Наблюдение: Вывод: б) Реакция нейтрализации. Налейте в пробирку воды на одну треть ее объема. Добавьте 2 капли индикатора метилового оранжевого. Какова реакция среды в пробирке? В какой цвет окрасился индикатор? Добавьте туда же несколько капель серной кислоты. Как изменился цвет индикатора? Прибавляйте в пробирку по капле 2 н. раствор гидроксида натрия до тех пор, пока среда раствора в пробирке не станет нейтральной. Наблюдение: Вывод: Приведите уравнения реакций в молекулярном, ионном полном и сокращенном виде. Опыт 4. Реакции с образованием комплексных соединений В двух пробирках получите осадок гидроксида цинка. Раствор каких веществ надо взять для этой цели? В одну из пробирок с осадком налейте избыток раствора гидроксида натрия, в другую — раствор кислоты. Что происходит с осадком в обеих пробирках? Наблюдение: Вывод: Приведите уравнения реакций в молекулярном, ионном полном и сокращенном виде. Лабораторная работа 2. Гидролиз солей
|
|||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 311; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.12.242 (0.008 с.) |
 ;
;